您当前的位置:检测资讯 > 生产品管
嘉峪检测网 2020-06-10 19:13
新版《药品生产质量管理规范(2010年修订)》(GMP)自2011年3月1日实施以来,为提升药品生产质量管理水平、降低药品生产环节面临的风险、确保人员群众用药安全起到了极大的推动作用。尽管新修订《药品管理法》中取消了药品GMP认证,不再发放药品GMP认证证书,但从事药品生产活动必须遵守药品GMP,保证药品生产全过程持续符合法定要求;监管部门对管理相对人的生产场所及活动开展的检查,需要进行合规确认和风险研判。
质量控制与质量保证是企业生产确保药品符合预定用途的关键环节,对药品生产质量有着至关重要的作用。“人、机、料、法、环”(4M1E)是在生产企业全面质量管理理论中影响产品质量的主要因素的简称,本文在此思路的基础上围绕“人、机、料、法、环”等因素去探究和分析药品GMP检查中质量控制与质量保证方面存在的主要问题。
这些问题你重视了吗?
1、“人”的问题
人是实施药品GMP最核心、最积极的要素,是药品生产企业实施质量管理活动的基础。质量控制与质量保证方面涉及“人”的问题主要表现在三个方面:一是关键人员质量管理意识淡漠,擅自变更药品处方和生产工艺违规生产药品,企业质量管理体系不能有效运行,如在提取的浸膏中添加外购提取物,用于中药制剂的生产;未按法定标准要求进行成品全检,质量管理人员签字放行。二是质量管理人员对国家相关法规或规定认识不足(缺乏认识和理解),理解不到位,将不允许委托的检验项目委托给其他机构完成,如明胶空心胶囊检测项目中铬的检验。人员数量明显不足,不能满足企业实际生产中质量控制和质量保证工作需要,如部分饮片企业常年生产千余批产品,涉及上百个品种,而从事QC和QA岗位的人员不足十人;少数企业在不同地点有不同生产厂区,QA人员需要在不同的厂区承担质量保证任务;质量管理人员承担职责过多,无法有效履行质量保证和质量控制工作职责。三是质量控制与质量保证岗位人员履职不力,不能有效完成岗位工作,如质量保证方面常见的问题:QA人员在现场监控时未按文件要求取样,存在选择性取样现象,导致成品检验不合格;QA取样人员对取样方法不了解;QA人员对生产过程的监控不规范,未按文件要求定时取样监测。质量控制方面常见的问题:检验操作不规范,如供试品峰面积超出标准曲线范围、理论塔板数不符合药典规定;检验数据无法溯源,如检验数据的保存或备份不规范,无法提供高效液相电子图谱;检验记录填写或存档不规范,缺少检验及复核人员签字,或检验记录中未附相关检验图谱;检验人员操作能力不足,现场安排的动态检验不能按时正确完成,大型检测设备如原子吸收分光光度计等不会操作。
2、“机”的问题
“机”的问题主要涉及质量保证和质量控制方面所需要的设施设备,常见问题表现在两个方面:一是企业硬件投入不足,不具备申报品种的检验条件,如缺少所生产品种的检验检测仪器、色谱柱等,或购置了检验仪器,但未配置仪器的配套设备,如生物显微镜无测量显微特征组织直径及长度的功能。二是管理方面的问题,如老旧的色谱工作站无法配备审计追踪软件,但企业缺少保证数据完整性措施;检验仪器的维护保养不及时,以致无法正常使用;部分仪器在使用前未进行确认;检验用容量瓶和移液管未校正等。
3、“料”的问题
“料”的问题主要涉及到质量控制实验室物料的管理,从近两年的检查情况看,常见的问题表现在四个方面:一是实验室相关物料管理混乱,如菌种保存和使用存在问题,前期已销毁的菌种,在后期记录中发现有传代使用记录,以致检验数据存在真实性问题;实验室试剂管理不规范,试剂无领用登记台账或相关记录,试剂的领用记录中剩余量与现场复核剩余量不一致;试剂配制及使用不符合相关规定,如碘化钾试液、淀粉指示液、糊精溶液等,不符合药典规定的临用新配的要求。二是缺少相关标准物质,如缺少对照品和对照药材。三是物料供应商管理不完善,如未收集相关物料的质量标准,未与物料供应商签订质量保证协议,对主要物料供应商审计与企业文件规定不符等。四是留样管理不规范,部分原料和成品未留样。
4、“法”的问题
“法”的问题主要涉及执行国家相关法律法规情况,如未按相关质量标准对成品进行全检,具体有制远志未测黄曲霉毒素、川贝母未进行聚合酶链式反应-限制性内切酶长度多态性检测、黄芪未进行有机氯农药残留检验;成品未经全检即放行,如麸炒薏苡仁、罗汉果未进行含量测定、金银花未检测重金属及有害元素。检验方法未进行确认,如微生物限度检查;培养基适用性未进行确认;未采用标准规定的方法进行含量测定的计算;部分物料未制定质量标准,未规定检测周期,如压缩空气、纯蒸汽等;微生物限度检查方法学未进行验证;外购培养基未开展适用性试验;检验仪器未开展确认,已用该仪器进行检验;杂质含量计算未采用质量标准规定的方法。
5、“环”的问题
“环”的问题主要涉及质量控制实验室工作环境问题,是否满足质量保证尤其是质量控制工作环境需要,常见的问题:质量控制实验室空调系统设置不能满足要求,如微生物实验室阳性对照间与缓冲间呈现正压,不符合微生物实验室要求;实验室缺少必要的硬件条件,如化验室的阳性室未配备生物安全柜;企业不同生产厂区共用质量控制实验室时,未对原辅材料、中间品、成品的取样样品的运输转移过程的风险进行评价,也未对质量控制、运输条件进行确认等。
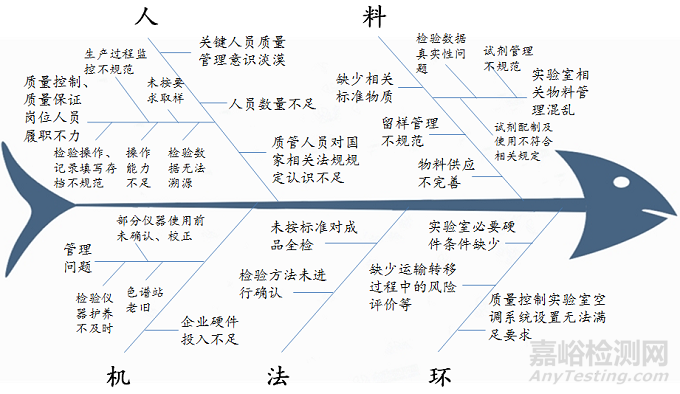
“人、机、料、法、环”分析图
小建议
企业在实施药品GMP过程中需重视质量控制与质量保证方面的工作,强化风险管理意识,加强资源的合理配置,确保质量管理体系有效运行;同时加强培训工作的针对性,丰富教育培训方法,突出培训实效,提高人员履职能力。
监管部门可在充分调研基础上,结合产品热点和生产规模,细化药品GMP条款,增强GMP实施效果;放宽委托生产许可条件,药品上市许可持有人可将生产批次少的产品委托给其他药品企业生产,有效减轻企业检验工作任务,释放药品生产潜能。
(文章摘编自《中国药事》2020年1月第34卷第1期《药品GMP检查中质量控制与质量保证方面存在的主要问题及建议》作者:钱利武等)

来源:中国药事


