您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-04-23 09:48
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
抗肿瘤药临床试验影像程序标准化征求意见稿发布。为鼓励抗肿瘤新药研发,进一步规范临床试验影像学终点评估,提供可参考的技术标准,CDE组织起草了《抗肿瘤药临床试验影像终点程序标准技术指导原则(征求意见稿)》,本指导原则将以临床试验影像标准相关的设计、实施和数据管理三方面的考虑为逻辑,阐述临床试验影像终点程序标准化的审评考虑,并附相关影像章程的规范化和科学性考虑,以及上市申请时影像相关资料清单建议,为医药研发企业、影像合同研究机构、研究者及各临床试验参与者提供临床试验影像程序相关标准的建议。
1. 维奥制药米格列醇片首家通过一致性评价。维奥制药米格列醇片(50mg)获国家药监局批准,成为该品种首家通过一致性评价的产品。米格列醇是由拜耳原研的一款第三代α-葡萄糖苷酶抑制剂类降糖药,配合饮食控制和运动,用于改善成人2型糖尿病患者血糖控制,以及用于降低患者餐后高血糖。目前米格列醇国内市场,维奥制药约占60%,浙江医药占约30%,山东新时代约占10%。
2. 嘉逸医药盐酸西那卡塞片首仿获批。嘉逸药业按新4类申报的盐酸西那卡塞片获国家药监局批准上市,为国内首仿,并视同通过一致性评价。该药用于治疗慢性肾脏病(CKD)维持性透析患者的继发性甲状旁腺功能亢进症。盐酸西那卡塞是由NPS Pharmaceuticals研发的一款钙敏感受体激动剂,最早于2004年3月由安进开发在美国获批上市,商品名Sensipar,目前该原研药已获批进口中国(盖平,协和发酵麒麟制药),为2017版国家医保目录药品。
3. 豪森盐酸鲁拉西酮片申报上市。4月21日,豪森药业按新4类提交的盐酸鲁拉西酮片上市申请获得CDE受理。这是继海正药业之后,国内第2家提交该仿制药上市申请的厂家。鲁拉西酮(Latud)是由住友制药研发的一款非典型(第二代)抗精神病药物,为多巴胺D2、5-HT2A及5-HT7受体拮抗剂,已于2019年1月在中国获批上市,用于成人精神分裂症的治疗。目前国内仅有原研产品上市销售。
4. 东曜贝伐珠单抗生物类似物III期结果积极。东曜药业贝伐珠单抗生物类似药TAB008(朴欣汀/Pusintin)III期临床达主要终点。该研究比较TAB008与原研药安维汀(Avastin,罗氏)的疗效,评估治疗开始后18周内两组患者的客观缓解率。近期该研究达到了预设的主要终点,东曜将继续如期推进TAB008的新药申请。贝伐珠单抗是罗氏开发的一种抗血管内皮细胞生长因子单抗药物,已获批转移性结直肠癌、非小细胞肺癌、恶性胶质瘤等7种适应症。2019年,安维汀的全球销售额为70.7亿瑞士法郎;中国销售额达到28.8亿元人民币。
5. 靶向Trop-2抗体偶联药物在中国获批临床。Everest公司与云顶药业联合申报的抗体偶联药物(ADC)sacituzumab govitecan在中国获批临床,用于接受过至少2线既往治疗的转移性三阴性乳腺癌。sacituzumab govitecan由靶向人滋养层细胞表面抗原2(Trop-2)的人源化单克隆抗体hRS7 IgG1κ和细胞毒性化合物SN-38偶联而成,由Immunomedics公司开发。目前,这款药物已在美国提交上市申请,PDUFA日期为2020年6月2日,有望成为首个治疗TNBC的ADC药物。
6. 贝达药业2019财报公布。4月20日,贝达药业发布2019年年度业绩报告,营业总收入为15.54亿元,同比增长26.94%。归属于上市股东的净利润2.31亿元,同比增长38.37%。新药研发投入持续增加,2019年达到6.75亿元,占营业收入比例43.41%,同比增长14.33%。报告显示,其用于治疗EGFR突变的晚期NSCLC的埃克替尼2019年持续放量,销售额达15.02亿元,占营业收入比重96.65%,同比增加24.28%。
1. 伊布替尼第11项适应症获批。艾伯维宣布FDA批准Imbruvica(伊布替尼)联合利妥昔单抗一线治疗慢性淋巴细胞白血病(CLL)/小淋巴细胞白血病(SLL)。这是Imbruvica获批的第11项适应症,也是该药在CLL适应症上的第6项批准。在一项III期E1912研究中,与氟达拉滨+环磷酰胺+利妥昔单抗治疗方案(FCR)相比,Imbruvica联合利妥昔单抗显著延长患者PFS。中位随访37个月时,Imbruvica组合将疾病进展风险降低66%(HR=0.34,95% CI: 0.22-0.52;p <0.0001)。中位随访49个月时,OS数据尚未成熟,Imbruvica联合组有11例(3%)患者死亡,FCR治疗组有12例(7%)患者死亡。
2. 勃林格殷格翰nintedanib新适应症在欧盟获批。勃林格殷格翰小分子酪氨酸激酶抑制剂nintedanib新适应症获EMA批准,用于治疗系统性硬化症相关间质性肺病(SSc-ILD)成人患者。2019年9月,nintedanib已获FDA批准用于延缓SSc-ILD患者的肺功能下降,是唯一一款获批这一罕见肺部疾病的治疗药物。在一项III期临床SENSCIS中,与安慰剂相比,nintedanib治疗组SSc-ILD患者肺功能下降显著降低了44%(FVC调整后的年下降率:-52.4毫升/年 vs -93.3毫升/年,绝对差异:41.0毫升/年[95%CI:2.9-79.0],p=0.04);而且nintedanib治疗SSc-ILD的安全性和耐受性与治疗特发性肺纤维化(IPF)患者相似。
3. EMA取消光化性角化病药物Picato销售授权。欧洲药管局(EMA)撤销丹麦利奥制药用于治疗光化性角化病的皮肤病凝胶剂型产品Picato(巨大戟醇甲基丁烯酸酯)的销售许可。据悉,EMA的撤销决定是基于两项研究结果。在一项为期三年的研究中,与咪喹莫特相比,Picato治疗的皮肤区域中皮肤恶性肿瘤(尤其是鳞状细胞癌)的发生率更高(3.3%vs0.4%)。在另一项为期八周的赋形剂对照试验中,Picato治疗组中皮肤肿瘤的发生率为1%,而赋形剂组仅为0.1%。
4. Scynexis广谱抗菌药达Ⅲ期临床研究终点。Scynexis公司新型口服葡聚糖合成酶抑制剂ibrexafungerp在治疗外阴阴道念珠菌病的第二项关键性Ⅲ期临床VANISH—306中获积极结果。与安慰剂组相比,ibrexafungerp治疗组在治疗的第10天有63.3%的患者达到所有阴道体征和症状(S&S,评分范围为0至18)完全消退的主要终点;58.5%的患者达到了真菌学根除的次要终点;72.3%的患者获得临床改善。在第25天随访时,73.9%的患者症状得到完全消除。Scynexis预计在下半年递交ibrexafungerp用于治疗VVC的新药申请。
5. Cara突破性瘙痒疗法Korsuva达Ⅲ期临床终点。Cara Therapeutics公司外周κ阿片受体激动剂Korsuva(CR845/difelikefalin)注射液,在治疗患有中重度慢性肾病相关瘙痒(CKD-aP)的血液透析患者的关键性Ⅲ期试验KALM-2中,获积极顶线数据。在治疗第12周时,Korsuva治疗组有54%患者的WI-NRS评分(每日24小时瘙痒强度数字评定量表)降低3分或以上,而安慰剂组这一数值为42%;Korsuva组中有41%患者的WI-NRS评分较基线时改善4分或以上,安慰剂组这一数值仅为28%。FDA已授予Korsuva突破性疗法认定,预计Cara公司下半年将递交其新药申请。
6. Opdivo联合Yervoy治疗恶性胸膜间皮瘤达Ⅲ期终点。百时美施贵宝PD-1纳武利尤单抗(Opdivo)联合CTLA-4抗体伊匹木单抗(Yervoy)一线治疗恶性胸膜间皮瘤的关键Ⅲ期临床CheckMate -743达主要研究终点。中期分析显示,与标准化疗(培美曲塞联合顺铂或卡铂)相比,纳武利尤单抗联合伊匹木单抗在总生存期方面实现了统计学意义的显著改善。临床中,该组合疗法的安全性与其既往已知的安全性报道一致。
1. 2019年全国样本医院药物销售额TOP50。根据PDB数据,2019年全国样本医院药物销售额TOP50新鲜出炉,TOP50合计销售额764.14亿元,上榜门槛9.10亿元。TOP50中增速超过30%的品种有10个,分别是奥希替尼(989.40%)、聚乙二醇化重组人粒细胞集落刺激因子(73.50%)、贝伐珠单抗(55.62%)、曲妥珠单抗(48.39%)、乙酰半胱氨酸(47.93%)、重组人血小板生成素(42.28%)、紫杉醇(40.86%)、碘克沙醇(38.44%)、替加环素(36.86%)、丁苯酞(30.49%)。其中,奥希替尼增速最快,2019年全国样本医院销售额为10.04亿元,同比增长989.40%。
2. 瑞士开发出可探测空气中新冠病毒的新型传感器。瑞士科学家宣布已开发出一种能够灵敏、可靠地检测到空气中新冠病毒的生物传感器,不但可以作为新冠病毒感染临床诊断替代方法,还可用于实时监测火车站、医院等人流密集场所空气中是否存在新冠病毒。据悉,该传感器是基于在玻璃基质上制备的被称为“金纳米岛”的金纳米结构,研究人员在金纳米结构上“嫁接”人工合成的与新冠病毒RNA序列相匹配的DNA受体,使其能够识别新冠病毒。相关论文已发表在《美国化学学会·纳米》杂志上。
【恩华药业】公司于近日收到国家药品监督管理局签发的枸橼酸芬太尼口腔黏膜贴片《临床试验通知书》。
【哈药股份】1)2019年度实现营业收入118.25亿元(+9.35%);归母净利润0.56亿元(-83.88%);扣非归母净利润-0.12亿元。2)分公司世一堂收到国家药品监督管理局颁发的关于布洛芬颗粒的《药品补充申请批件》,该药品通过仿制药质量和疗效一致性评价。3)公司吸收合并下属全资子公司三精四厂,吸收合并完成后,三精四厂的全部资产、负债、权益以及人员由哈药股份承接,其独立法人资格将被注销。4)分公司哈药总厂收到国家药品监督管理局颁发的关于阿莫西林胶囊两个规格的《药品补充申请批件》,该两个规格药品通过仿制药质量和疗效一致性评价。
【新天药业】公司完成对参股公司上海汇伦生物的三轮增资。
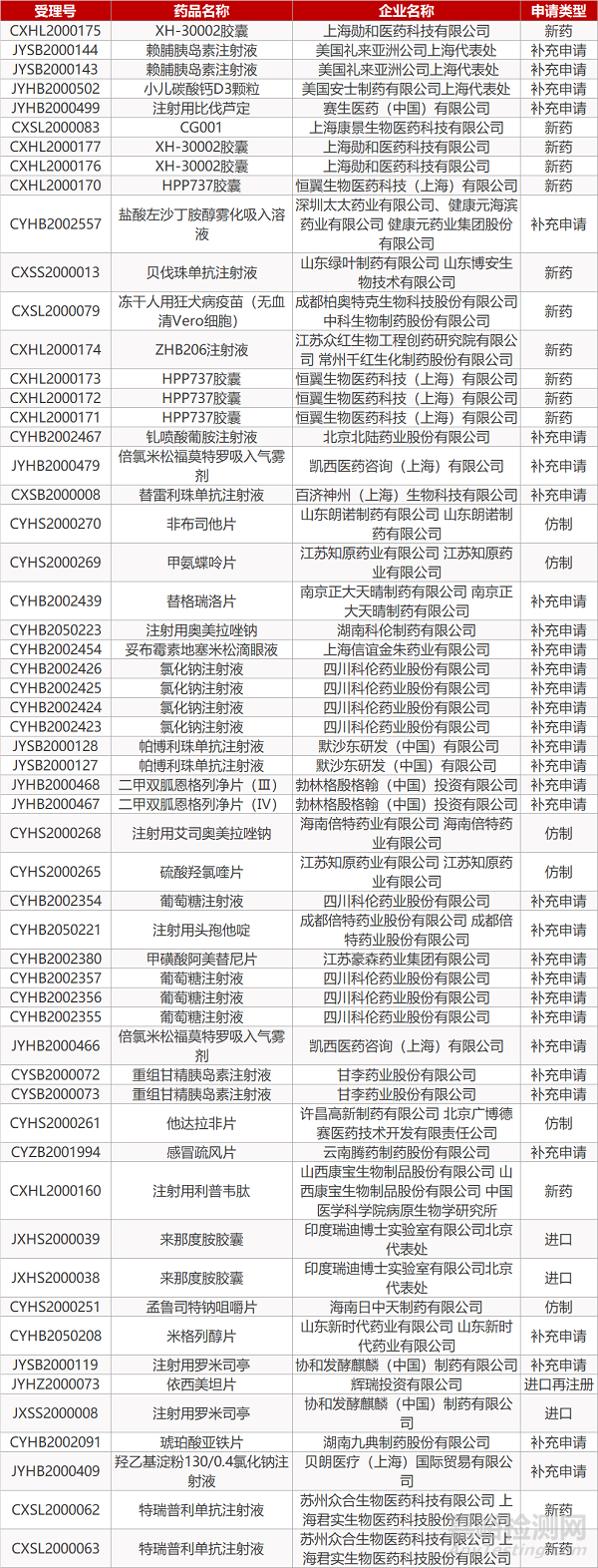
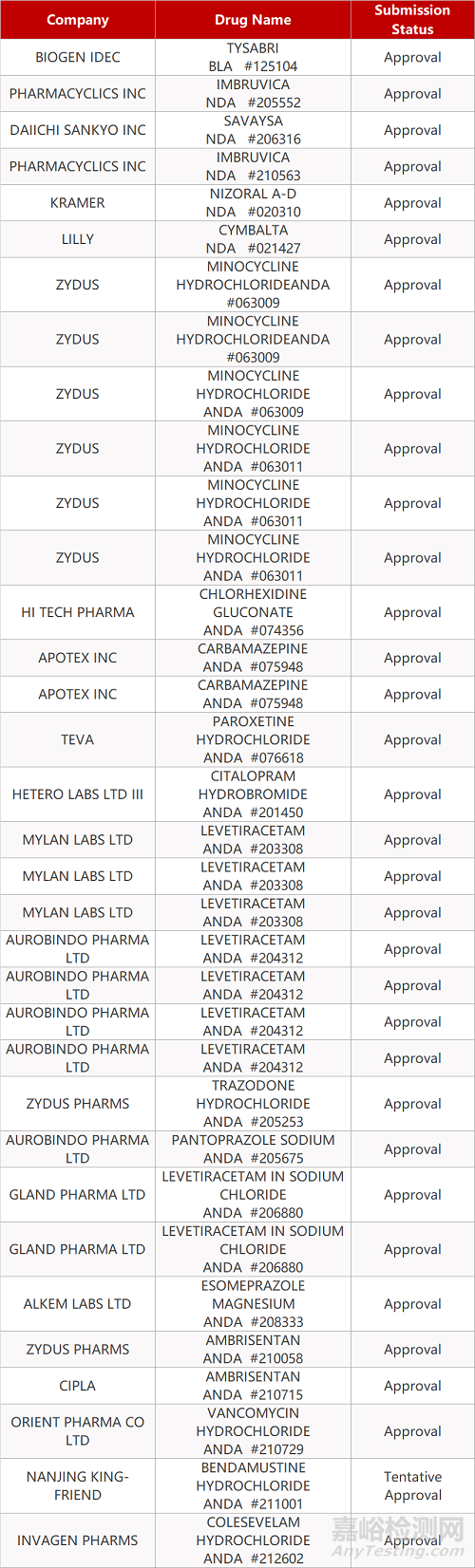
- The End -

来源:药研发


