您当前的位置:检测资讯 > 生产品管
嘉峪检测网 2020-02-27 16:31
作者:钱利武 qianlw@163.com, 罗京京 , 王浩 , 刘小琼 , 王慧
安徽省食品药品审评认证中心, 合肥 230000
收稿日期:2019-05-29
作者简介:钱利武, 副研究员, 研究方向:药品GMP认证检查, E-mail:qianlw@163.com
摘要:
目的:
探讨安徽省药品GMP检查中质量控制和质量保证方面缺陷项目的分布规律和特点,为药品上市许可持有人有针对性地提升质量控制与质量保证水平和监管部门加强药品生产监管提供依据和思路。方法: 对2017-2018年安徽省230家药品生产企业GMP现场检查中发现的质量控制与质量保证方面缺陷项目进行汇总分析。结果: 大多数企业对样品检验、实验室物料管理和偏差调查等方面的条款理解不透彻,执行不到位,与药品GMP要求有一定差距。结论: 药品上市许可持有人是药品质量的责任主体,应不断提高认识,在药品的质量控制与质量保证方面持续改进,确保人民群众的用药安全有效。
关键词:GMP 质量控制与质量保证 缺陷项目 上市许可持有人
新版《药品生产质量管理规范(2010年修订)》(GMP)自2011年3月1日实施以来, 为提升药品生产质量管理水平、降低药品生产环节面临的风险、确保人员群众用药安全起到了极大的推动作用[1]。尽管新修订《药品管理法》中取消了药品GMP认证, 不再发放药品GMP认证证书, 但从事药品生产活动必须遵守药品GMP, 保证药品生产全过程持续符合法定要求; 监管部门对管理相对人的生产场所及活动开展的检查, 需要进行合规确认和风险研判[2-3]。近年来, 国家药品检查报告和安徽省药品GMP检查情况显示, 在质量控制与质量保证方面发现的缺陷项目分布最多[4-6]。本文以2017-2018年安徽省药品GMP检查在质量控制与质量保证方面所发现的缺陷项目为研究对象, 总结药品生产企业在质量保证和质量控制方面存在的主要问题, 分析其原因并提出解决问题的思路和建议。
1 近两年安徽省药品GMP检查总体情况
1.1 GMP检查总体情况
2017-2018年, 安徽省食品药品审评认证中心共组织230家次药品GMP检查, 通过对现场检查报告和整改材料进行审核, 185家企业通过药品GMP检查, 45家企业未通过, 不通过率为19.57%。企业申请检查范围包括中药饮片、普通制剂、无菌药品、原料药、医用氧5种类型, 各类型企业数分别为110、59、42、15和4家次(见表 1)。
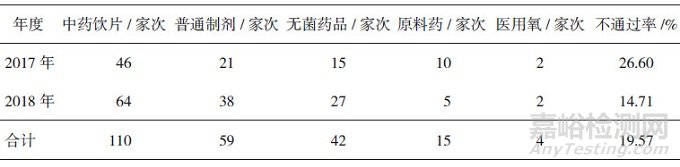
表 1 GMP检查申请范围
1.2 缺陷项目情况
通过对230份现场检查报告进行审核确认, 共发现检查缺陷项目3166项, 包括严重缺陷项目56项、主要缺陷345项和一般缺陷2765项。缺陷项目主要分布于质量控制与质量保证、文件管理、相关附录、设备、确认与验证、机构与人员、厂房与设施和物料与产品等部分, 发现的缺陷项目分别为593、480、467、396、271、221、201和189项, 占缺陷项目总数的89.01%(见表 2), 其中质量控制与质量保证占整个缺陷项目的比例为18.73%。
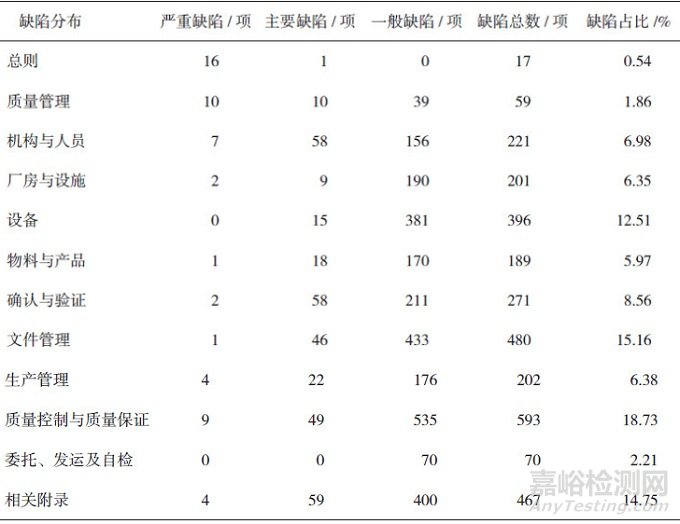
表 2 GMP检查缺陷项目分布情况
1.3 质量控制与质量保证方面缺陷项目情况
质量控制与质量保证方面发现检查缺陷项目593项, 包括严重缺陷9项、主要缺陷49项和一般缺陷项535项。缺陷项目主要集中于质量控制实验室管理, 为334项, 占质量控制与质量保证缺陷项目的56.32%;其次为供应商评估和批准, 为91项, 比例为15.35%。
通过对质量控制与质量保证章节高频缺陷项目分析, 安徽省药品GMP检查申请企业大多存在生产物料与产品检验不规范、实验室物料管理不规范、偏差处理不规范、合格供应商管理不规范等问题。出现频次最高的缺陷条款是第223条, 出现频次为154次, 占申请认证企业的66.96%;其余依次为226条, 出现频次为65次; 第250条, 出现频次为34次。
2 质量控制与质量保证方面存在的主要问题
"人、机、料、法、环"(4M1E) [7]是在生产企业全面质量管理理论中影响产品质量的主要因素的简称, 药品生产企业质量控制与质量保证环节存在的问题, 是多种因素共同作用的结果, 但归纳起来, 均可围绕"人、机、料、法、环"等因素去探究和分析。
2.1 "人"的问题
人是实施药品GMP最核心、最积极的要素, 是药品生产企业实施质量管理活动的基础。质量控制与质量保证方面涉及"人"的问题主要表现在四个方面:一是关键人员质量管理意识淡漠, 擅自变更药品处方和生产工艺违规生产药品, 企业质量管理体系不能有效运行, 如在提取的浸膏中添加外购提取物, 用于中药制剂的生产; 未按法定标准要求进行成品全检, 质量管理人员签字放行。二是质量管理人员对国家相关法规或规定认识不足, 理解不到位, 将不允许委托的检验项目委托给其他机构完成, 如明胶空心胶囊检测项目中铬的检验。人员数量明显不足, 不能满足企业实际生产中质量控制和质量保证工作需要, 如部分饮片企业常年生产千余批产品, 涉及上百个品种, 而从事QC和QA岗位的人员不足十人; 少数企业在不同地点有不同生产厂区, QA人员需要在不同的厂区承担质量保证任务; 质量管理人员承担职责过多, 无法有效履行质量保证和质量控制工作职责。三是质量控制与质量保证岗位人员履职不力, 不能有效完成岗位工作, 如质量保证方面常见的问题:QA人员在现场监控时未按文件要求取样, 存在选择性取样现象, 导致成品检验不合格; QA取样人员对取样方法不了解; QA人员对生产过程的监控不规范, 未按文件要求定时取样监测。质量控制方面常见的问题:检验操作不规范, 如供试品峰面积超出标准曲线范围、理论塔板数不符合药典规定; 检验数据无法溯源, 如检验数据的保存或备份不规范, 无法提供高效液相电子图谱; 检验记录填写或存档不规范, 缺少检验及复核人员签字, 或检验记录中未附相关检验图谱; 检验人员操作能力不足, 现场安排的动态检验不能按时正确完成, 大型检测设备如原子吸收分光光度计等不会操作。
2.2 "机"的问题
"机"的问题主要涉及质量保证和质量控制方面所需要的设施设备, 常见问题表现在两个方面:一是企业硬件投入不足, 不具备申报品种的检验条件, 如缺少所生产品种的检验检测仪器、色谱柱等, 或购置了检验仪器, 但未配置仪器的配套设备, 如生物显微镜无测量显微特征组织直径及长度的功能。二是管理方面的问题, 如老旧的色谱工作站无法配备审计追踪软件, 但企业缺少保证数据完整性措施; 检验仪器的维护保养不及时, 以致无法正常使用; 部分仪器在使用前未进行确认; 检验用容量瓶和移液管未校正等。
2.3 "料"的问题
"料"的问题主要涉及到质量控制实验室物料的管理, 从近两年的检查情况看, 常见的问题表现在四个方面:一是实验室相关物料管理混乱, 如菌种保存和使用存在问题, 前期已销毁的菌种, 在后期记录中发现有传代使用记录, 以致检验数据存在真实性问题; 实验室试剂管理不规范, 试剂无领用登记台账或相关记录, 试剂的领用记录中剩余量与现场复核剩余量不一致; 试剂配制及使用不符合相关规定, 如碘化钾试液、淀粉指示液、糊精溶液等, 不符合药典规定的临用新配的要求。二是缺少相关标准物质, 如缺少对照品和对照药材。三是物料供应商管理不完善, 如未收集相关物料的质量标准, 未与物料供应商签订质量保证协议, 对主要物料供应商审计与企业文件规定不符等。四是留样管理不规范, 部分原料和成品未留样。
2.4 "法"的问题
"法"的问题主要涉及执行国家相关法律法规情况, 如未按相关质量标准对成品进行全检, 具体有制远志未测黄曲霉毒素、川贝母未进行聚合酶链式反应-限制性内切酶长度多态性检测、黄芪未进行有机氯农药残留检验; 成品未经全检即放行, 如麸炒薏苡仁、罗汉果未进行含量测定、金银花未检测重金属及有害元素。检验方法未进行确认, 如微生物限度检查; 培养基适用性未进行确认; 未采用标准规定的方法进行含量测定的计算; 部分物料未制定质量标准, 未规定检测周期, 如压缩空气、纯蒸汽等; 微生物限度检查方法学未进行验证; 外购培养基未开展适用性试验; 检验仪器未开展确认, 已用该仪器进行检验; 杂质含量计算未采用质量标准规定的方法。
2.5 "环"的问题
"环"的问题主要涉及质量控制实验室工作环境问题, 是否满足质量保证尤其是质量控制工作环境需要, 常见的问题:质量控制实验室空调系统设置不能满足要求, 如微生物实验室阳性对照间与缓冲间呈现正压, 不符合微生物实验室要求; 实验室缺少必要的硬件条件, 如化验室的阳性室未配备生物安全柜; 企业不同生产厂区共用质量控制实验室时, 未对原辅材料、中间品、成品的取样样品的运输转移过程的风险进行评价, 也未对质量控制、运输条件进行确认等。
3 意见和建议
3.1 强化风险管理意识, 确保质量管理体系有效运行
新修订《药品管理法》中明确规定, 药品上市许可持有人(MAH)对药品的生产经营、上市后研究、不良反应监测及报告与处理等承担责任。其他从事药品生产、经营、储存、运输等活动的单位和个人依法承担相应责任。药品上市许可持有人是药品质量的责任主体, 应树立全员质量管理意识, 不断提升质量控制与质量保证工作水平。药品上市许可持有人及药品生产企业应结合自身情况, 在药品生产和检验过程中秉持风险管理思想, 加强资源的合理配置, 确保质量管理体系有效运行。
3.2 加强培训工作的针对性, 提高人员履职能力
部分药品上市许可持有人或药品生产企业的培训工作缺乏针对性和有效性, 培训多以文件、规范学习为主, 实操培训较少, 且对培训效果缺乏有效的评价手段, 培训效果不佳。部分药品上市许可持有人或药品生产企业应基于生产品种的特点, 以存在的问题为导向, 可将相关人员送出去培训, 也可将相关专业的专家请进来授课, 丰富教育培训方式, 突出培训实效, 切实提高质量控制和质量保证环节岗位人员的履职能力。
3.3 细化药品GMP条款, 增强GMP实施效果
新版GMP部分条款在实践当中难以把握, 如第217条规定质量控制实验室的人员、设施、设备应当与产品性质和生产规模相适应。就人员来分析, 如何与产品性质和生产规模相适应很难把握, 有些药品上市许可持有人或药品生产企业从成本上考虑希望聘用尽可能少的人去完成质量控制与质量保证工作, 检查人员也没有可参照的标准去判断人员是否满足生产和质量管理需要。还有部分药品上市许可持有人或药品生产企业由于薪资和地域分布等因素, 时常聘用一些实习期的学生从事质量控制工作, 这部分人员流动性很大, 对药品的质量控制带来一定的风险, 建议监管部门在充分调研基础上, 结合产品热点和生产规模, 对药品GMP检查条款进行细化, 制定QA和QC人员低限, 在药品安全监管和药品上市许可持有人或药品生产企业自身发展之间找到平衡点。
3.4 放宽委托生产许可条件, 释放药品生产潜能
新修订《药品管理法》第三十二条规定, 药品上市许可持有人可以自行生产药品, 也可以委托药品生产企业生产, 但与《药品管理法》相适应的药品委托生产相关规定等尚未准备就绪, 如现行《药品委托生产监督管理规定》(2014年10月实施), 对药品委托生产有诸多限定, 甚至与新修订《药品管理法》规定不相符, 如委托方和受托方均是持有与委托生产药品相适应的GMP认证证书的药品生产企业; 委托方应当取得委托生产药品的批准文号等。以及大多数中药饮片无批准文号, 客观上也限制了药品上市许可持有人之间的委托生产, 尤其是小品种产品。如能放宽药品委托生产相关制约因素, 药品上市许可持有人可将生产批次少的产品委托给其他药品企业生产, 以有效减轻企业的检验工作任务, 降低企业生产成本。
4 结论
质量控制与质量保证是企业生产确保药品符合预定用途的关键环节, 对药品生产质量有着至关重要的作用, 企业在实施药品GMP过程中需重视质量控制与质量保证方面的工作。从目前安徽省药品GMP现场检查缺陷看, 药品上市许可持有人或药品生产企业基本上建立了质量控制和质量保证方面的管理框架, 但在具体实施过程中还存在很多不规范的地方, 尤其是质量控制与质量保证岗位人员的质量风险意识还有待提高, 药品上市许可持有人是药品质量的责任主体, 应规范药品生产管理及检验活动, 持续改进药品质量控制及质量保证工作。监管部门应根据药品监管形势的变化, 适时调整监管政策, 提高监管效率, 更好地做好药品监管工作。
参考文献
[1] 国家食品药品监督管理总局食品药品审核查验中心. 2017年度药品检查报告[R].北京: 中国医药科技出版社, 2018.
[2] 全国人大常委会.中华人民共和国药品管理法(2019年修订)[EB/OL].(2019-08-26)[2019-11-05]. http://www.npc.gov.cn/npc/c30834/201908/26a6b28dd83546d79 d17f90 c62e59461.shtml.
[3] 国务院办公厅.国办发〔2019〕36号国务院办公厅关于建立职业化专业化药品检查员队伍的意见[S]. 2019.
[4] 曾初秋, 李衡. 浅析药品生产企业实施新版药品GMP存在的主要问题[J]. 中国药事, 2014, 28(1): 74-76.
[5] 胡士高, 窦颖辉, 罗京京, 等. 安徽省新修订药品GMP认证检查缺陷项目分析[J]. 安徽医药, 2013, 17(9): 1643-1644. DOI:10.3969/j.issn.1009-6469.2013.09.082
[6] 罗京京, 胡士高, 陈菡, 等. 2012年安徽省药品生产企业GMP跟踪检查及飞行检查缺陷项目分析[J]. 安徽医药, 2014, 18(3): 585-588. DOI:10.3969/j.issn.1009-6469.2014.03.068
[7] 汤为.基于4M1E方法的大批量生产型企业生产管理体系改进研究[D].兰州大学, 2010. http://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CMFD&filename=2010131149.nh

来源:xml-data


