您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-12-12 11:00
金属腐蚀的定义:金属受外部环境介质(气态或液态)的作用(化学的或电化学的)在其表面所起的异相反应,而变成氧化物、硫化物、氯化物等化合物的现象。
一、腐蚀介质的分类
1、基体金属镀层的大气腐蚀
当引脚基体镀层金属与气体介质(O2、S)接触时,首先气体分子被吸附在镀层金属的表面上,然后与表层金属作用并在其表层生成化合物,如表1所示。
表1 基体金属镀层的大气腐蚀
在工业大气中,除含有O2外,还含有少量的CO2、CO、H2S、SO2等。空气中正常的CO2是无害的,它既不会引起腐蚀,也不会加速腐蚀。空气中很少量的H2S,可引起Ag、Cu的爬行腐蚀而使Ag、Cu变色,Ag的变色是形成了Ag2S+Ag2O+CuCl膜,而Cu的变色是形成了Cu2S+CuS+Cu2O的混合膜。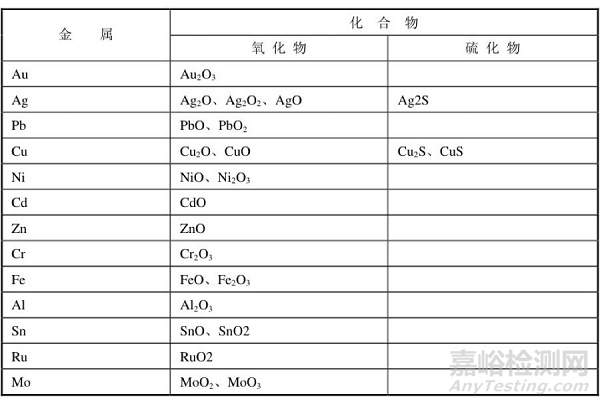
在工业大气中最具腐蚀性的气体是SO2,它主要来源于煤、石油、汽油的燃烧。
Sn在城市大气中的腐蚀速度是比较小的,所以选择Sn基合金作为可焊性镀层在抗大气腐蚀这一点上是合适的。
2、基体金属镀层的有机物腐蚀
元器件要经历涂漆、绝缘、烘烤、封装等处理,在这些工序中,金属往往要置于有机气氛之中而引起镀层金属的腐蚀。例如,Zn、Cd镀层在甲酸、乙酸等有机气氛之中,会形成“白霜”状的疏松金属有机酸盐的腐蚀产物。
微生物中的霉菌、真菌和细菌在其代谢过程中也会产生有机酸,人的手汗中含有多种无机物和有机物。
它们都很容易使金属镀层发生化学或电化学腐蚀,其中大多数的腐蚀产物均难以与助焊剂形成熔融性化合物,所以它们都将降低镀层的可焊性。因此,一种优良的可焊性镀层,不仅要具有优良的可焊性,而且还要具有良好的抗腐蚀性,这样才能保证基体金属长期储存后的可焊性。
二、引脚基体金属和镀层间的电化学腐蚀现象
焊接接头部的化学性质最关注的是腐蚀性,它可区分为由于钎料和基体金属等接触而引发的电化学腐蚀,以及基体金属和钎料自身的腐蚀两大类型。
1、金属的电化学腐蚀
1)金属电化学腐蚀反应
金属的电化学腐蚀反应通常分成以下两类。
(1)反应中有电子的得失:这类反应称为氧化-还原反应,失去电子的反应称为氧化反应,失去电子的物质称为还原剂;得到电子的反应称为还原反应,得到电子的物质称为氧化剂。
金属的原子容易失去电子变成正离子,因此,金属是还原剂。金属越容易失去电子,就越活泼,还原能力就越强。例如,Zn从Cu盐溶液中取代出Cu的反应为
Zn+Cu++=Cu+Zn++
该反应的本质是Zn原子将自己的电子转移给予了Cu++离子,使Zn原子变成了Zn++离子,而Cu++离子获得了电子变成了Cu原子。Zn失去电子的过程称为氧化反应,Zn是还原剂;而Cu++离子获得电子的过程称为还原反应,Cu是氧化剂。氧化作用和还原作用总是同时发生的。
(2)反应中无电子的得失
2)金属电化学腐蚀机理
相接触的不同金属或合金之间,由于其电极电位的差异而引起的腐蚀现象称为电化学腐蚀,也称为接触腐蚀或伽伐尼腐蚀。
金属和液体介质,如与水溶液接触时发生的腐蚀比较复杂,其腐蚀作用常常深入到金属内部。由于溶液通常是电解质,金属和这样的水溶液相接触时,就产生了原电池作用,即电化学作用。
纯金属在空气中几乎是不腐蚀的,甚至像Fe这样的金属在纯净状态下也不生锈。然而工业用金属常含有各种各样的杂质,杂质的存在是引起金属腐蚀的原因之一。
例如,在Cu板上铆一个Fe钉,如图1所示。这样的异种金属在空气中接触后,因空气中经常含有水蒸气、CO2等,而所有的固体表面都会从空气中吸附水分,所以在相接触的两金属的表面上也将覆盖着一层极薄的水膜。水的电离程度虽小,但仍能电离成H+和OH-。H+离子的数量由于水中溶解了CO2而增加:
CO2+H2O⇆H2CO2⇆H++HCO2-
因而Fe和Cu就好像放在含有H+、OH-和HCO2-离子溶液中一样,形成了一个原电池,Fe为负极,Cu为正极。由于它们是紧密接触的,作用便不断进行。Fe将离子不断投入溶液,同时多余的电子移向Cu,在Cu上H+和电子结合变成H2放出,溶液中的Fe++和OH-结合,生成铁锈(Fe(OH)2)附着在Fe的表面上。
图1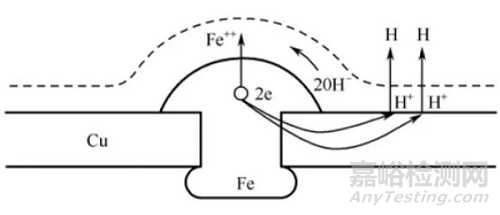
2、金属的化学腐蚀
1)金属化学腐蚀的特征与典型案例
与电化学腐蚀的机理不同,化学腐蚀的特征是腐蚀反应的产物直接生成于发生反应的表面区域。例如,焊接后助焊剂清除不净,在潮湿环境中基体金属和钎料间发生的直接腐蚀。诸如:
●Cu基体上出现铜绿(CuCO2•Cu(OH)2):
2Cu+CO2+3H2O→CuCO2•Cu(OH)2+2H2
●钎料表面上生成碳酸铅(PbCO2):
SnPb系钎料的腐蚀主要是由含有Cl的助焊剂残留物在湿热环境中而激发的,如图2所示,它是一种Pb的选择性腐蚀。被腐蚀了的Pb变成了多孔而脆弱的碳酸铅(PbCO3),导致钎料崩裂,焊点破坏。
图2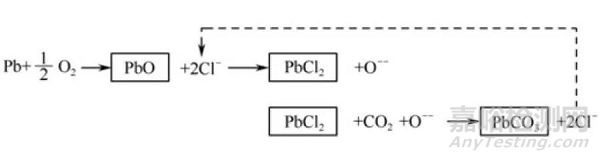
2)金属化学腐蚀(氧化)的离子-电子机理
金属上的氧化膜和盐类膜是离子的晶体结构,显然穿过膜而扩散的并非直接是金属原子而是金属离子和自由电子。当然,也可认为是氧离子从相反方向的扩散。在这种情况下,氧在膜的外表面接受了穿过膜出来的电子而变成氧离子,如图3所示。
假如设想膜的生长是由于某种原电池工作的结果:金属与膜的界面是这个电池的阳镀(放出阳离子和电子),膜与腐蚀介质的界面是阴极(氧在此接受电子),那么根据膜物质的电化学常数及氧化时自由能的降低,就可定量地计算某些金属的氧化速度。
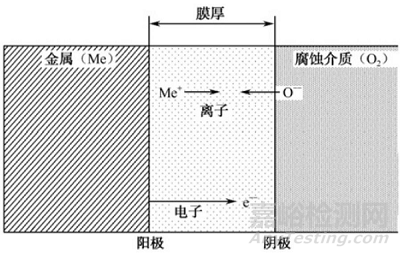
图3
膜既然传导电子和离子,就同时起着电池的外部通路和内部通路的作用。因此,使离子移动的不仅是因为有浓度梯度而产生扩散,更主要的是由于在氧化膜的外表面和内表面之间的电位差所形成的电场中,离子受到了该电场的作用而移动。
对大多数金属而言,膜的成长是金属原子通过膜向外扩散,同时金属原子把电子传递给O、S等原子。例如,由于空气中氧化剂的存在,镀Ag层极易受硫化物影响而形成有色的AgS薄膜:
2Ag+(1/2)O2+H2S→Ag2S+H2O
Ag层在S的作用下,Ag原子不断向外扩散,从而使表面Ag2S层不断增厚。
只有形成的表面膜是完整和致密的,而不是疏松和多孔的,这种膜才具有保护性,能防止金属的进一步氧化。通常金属表面形成的氧化膜分为两层,一层是紧贴在金属表面的内层,一层是较厚的外层。金属的氧化速度主要取决于外层膜是否具有保护作用。碱金属和碱土金属的氧化物膜一般是多孔性的,所以它的氧化速度较快;铝、不锈钢形成的氧化膜具有很好的保护性,不容易进一步氧化;而Cu、Fe、Zn、Sn、Pb、Cd、Ni等金属是介于上述二者之间的。一般金属的氧化速度是随温度的上升而加快的,但不同的金属的氧化速度随温度的变化规律是不同的,主要取决于氧化膜的致密性、挥发性和保护能力。
三、非金属及金属的接触偶电极电位对可靠性的潜在影响
1、非金属的电极电位
非金属在25℃时的电极电位如表2所示。
表2
2、金属的电极电位

根据热力学观点,在大气中大多数工业用金属状态是不稳定的,有氧存在时,只有电极电位最正性的金属(Au、Pt)是完全稳定的,其余整个都有转变成氧化状态的趋势。
焊接连接部是母材和钎料的异种金属的接合点,在腐蚀性环境中均可能发生伽伐尼腐蚀。电极电位因金属的种类和腐蚀环境的不同而不同。
如果将金属(包括氢)按照它们的标准电极电位递升的顺序排列起来,就得到了金属电动顺序,简称电动序,如表3所示。金属的电动序和金属的取代顺序基本上是一致的。金属失去电子的能力或还原能力自下而上依次增强。
表3
标准电极电位的负值越大,表示金属把它的离子投入到溶液中去的能力越大,金属也越活泼;正值越大,金属把它的离子投入到溶液中去的能力越小,金属也越不活泼。
在电动序中越在前面的金属越容易遭受腐蚀,电子总是从电极电位较低的金属(负极)流向电极电位较高的金属(正极)。
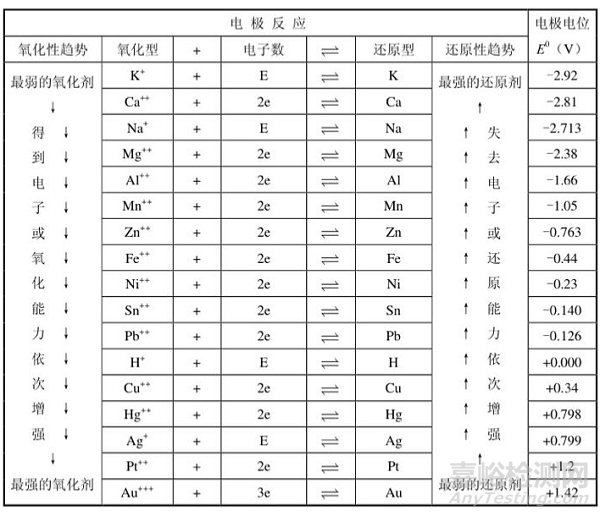
电极电位(E0)应用广泛,利用它可以判断氧化-还原反应进行的方向和程度。E0越大的金属获得电子和氧化能力越强;越小则其失去电子和还原能力越强。
3、电化学腐蚀的典型案件
1)焊接连接部的腐蚀
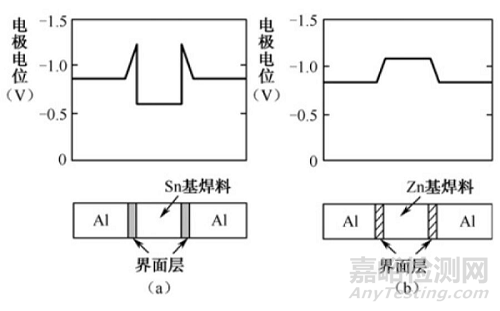
焊接连接部母材和钎料的异种金属直接接触,因此很容易引起电化学腐蚀,特别是在湿热环境中尤其如此。而且还要关注焊接接头界面上所形成的合金层,当该合金层的电极电位比钎料和母材都要明显变低时,在此场合下合金层变成了阴极,在合金层上便会出现选择性腐蚀现象,即使外观看似完好,然而其接头强度和导电性都将显著变差。例如,用Sn基和Zn基钎料焊接Al母材时,在其接触界面上便会出现类似的情况。
用Sn基钎料焊接Al母材时,焊接界面电极电位的变化如图4(a)所示。合金层的电极电位显著变低而出现选择性腐蚀现象,因而接头部的耐腐蚀性变差。而用Zn基钎料焊接Al母材时,由于在界面上没有形成合金层,如图4(b)所示,此时,钎料自身变成了阴极,钎料整体被均匀腐蚀,因而与Sn基钎料相比,其耐腐蚀性变大。
图4
2)典型案例(镀Sn钢板和镀Zn钢板的腐蚀)
作为镀Sn钢板和镀Zn钢板,当镀层完整无缺时,则被它保护的金属便可整体都得到很好的保护。然而当镀层出现擦伤和裂缝等时,就暴露了被保护的金属面,在这些地方就存在引发腐蚀的条件。不过腐蚀的过程将随这两种金属在电动序中的相对排列位置的不同而不同。例如:
●Fe上镀Sn
当Fe上的镀Sn层受到破坏,而暴露出来的地方又和空气(含有水蒸气、CO2等)相接触时,就形成了微电池。其中Sn是正极,Fe是负极,Fe因而受到破坏,Fe++不断地被投入溶液中,如图5(a)所示。这样镀Sn的Fe在损坏的地方就比没有镀Sn的Fe锈得更快。
●铁上镀Zn
由于作为保护金属的Zn的电动序是在被保护金属的前面,这时在保护层损坏的地方也产生了微电池,不过这时Zn是负极,Fe是正极,电子从Zn移到Fe,因此Zn被破坏,而Fe仍然被保护着,如图5(b)所示。保护作用一直进行到整个Zn层被腐蚀完为止。
图5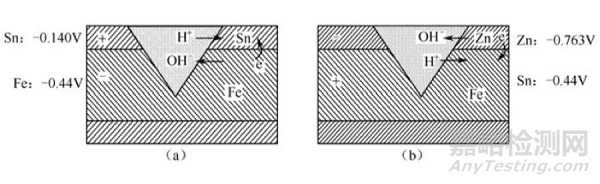
因此,要防止腐蚀,在基体金属面上镀一层较活泼的金属更合适。
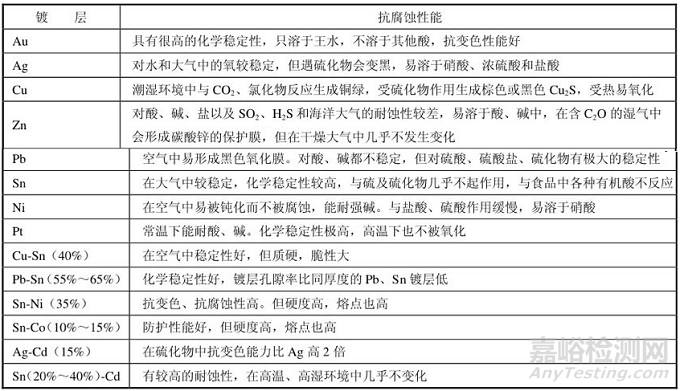
4、各种金属镀层的抗腐蚀性比较
引脚基体金属各种可焊性镀层的抗腐蚀性比较如表4所示。
表4

来源:Internet


