您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2019-10-18 10:22
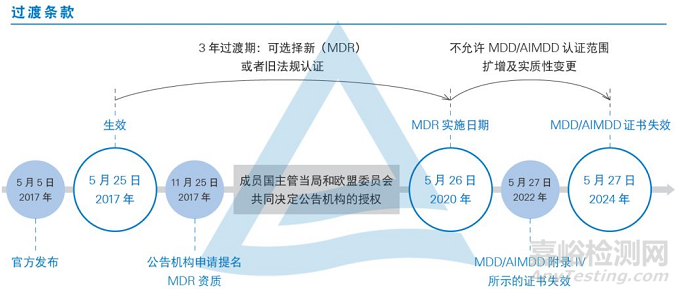
欧盟医疗器械法规(MDR) [REGULATION (EU) 2017/745](以下简称“MDR”)于2017年5月25日生效,并将于2020年5月26日取代医疗器械指令(MDD,93/42 / EEC)和有源可植入医疗器械指令(AIMDD,90/385 / EEC)。
MDR的法规过渡期为三年。这意味着所有新器械的制造商及其利益相关者必须在2020年5月26日之后需符合MDR新的相关要求,制造商应在过渡期内更新技术文件和流程以满足法规要求。之前获得MDD/AIMD证书的CE认证产品,最晚在2020年5月26日后,就无法在欧盟市场贩卖或安装。我们简单地梳理了MDD到MDR过渡期的时间轴,具体如下:
依据Article 120 clause2的规定,过渡期内公告机构签发的CE证书继续有效,但是从其交付日期起至有效期不超过5年,并且于2024年5月27日失效。
主要变更

MDR新规的法律框架较完整,各项规定比之前的指令更全面详细,对相关企业及从业人员提出更严格的要求。其主要变更如下:
更广泛的应用领域(包含非医疗区域)
UDI:每台医疗设备的唯一之识别码
更严格的技术文挡(TD)要求
更严格的负责人要求:医疗器械的专业知试
高风险医疗机械的新审查程序
更严格的临床评估和测试要求:临床数据的收集持续到产品上市后
更严格的公告机构监督:新公告机构的选择与检查
欧洲医疗器械数据库:更加透明且便于信息流通的数据库
此外,公告机构应至少每5年对证书持有者(医疗器械制造商)进行一次飞行检查,目的在于保证医疗器械产品质量的确定性和稳定性,让制造商始终在遵守MDR法规的情况下生产医疗器械。

来源:TUV


