您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-08-19 09:41
「本文共:15条资讯,阅读时长约:3分钟 」
今日头条
润都制药布洛芬胶囊首家通过一致性评价。润都制药布洛芬缓释胶囊通过一致性评价并获药品补充批件。布洛芬缓释胶囊适用于缓解轻中度疼痛如头痛、关节痛、偏头痛、牙痛、肌肉痛、神经痛、痛经;也用于普通感冒或流行性感冒引起的发热等。润都制药为该产品首家通过一致性评价的企业。据米内网数据显示,2018年中国公立医疗机构终端布洛芬胶囊剂销售额近4亿,同比增长20.30%。
国内药讯
1.正大天晴有望拿下抗呕吐药首仿。正大天晴3.1类化学药福沙吡坦双葡甲胺的上市申请审批状态更新为"在审批"。该仿制药有望成为该品种的首访药。该药原研药由默沙东研发,已在美国、欧盟和澳大利亚获批与其他止吐剂联用,预防首次或持续性重度致吐性化疗(HEC)包括高剂量顺铂化疗引起的急性和迟发性恶心呕吐;预防首次或持续性中度致吐性化疗(MEC)所引起的迟发性恶心呕吐。该药位列《第一批鼓励仿制药品目录建议清单》中,此前已被国家药监局纳入优先审评程序。目前,还有江苏豪森和齐鲁制药提交了该品种的上市申请。
2.勃格林殷格翰PDE9抑制剂中国获批临床。勃林格殷格翰PDE9抑制剂BI 409306获国家药监局临床试验默示许可,适应症为:在轻微精神病综合征的患者中进行早期干预治疗,以达到从轻微精神病症状中缓解、最终能够延缓并潜在地预防精神病首次发作的目标。根据ClinicalTrials.gov数据,目前BI 409306的一项Ⅱ期临床(NCT03351244)正在进行中,该研究将在387例精神分裂症患者中评估口服BI 409306在28周治疗期间作为辅助治疗的疗效、安全性和耐受性。
3.和记黄埔医药IDH1/2抑制剂获批临床。和记黄埔医药开发的新型小分子IDH1/2抑制剂HMPL-306片获国家药监局临床试验默示许可,适应症为伴有易感异柠檬酸脱氢酶- 1/2(IDH1/2)突变的血液肿瘤和实体肿瘤。IDH是人体内参与细胞能量代谢的限速酶,IDH突变是一些组织癌变的原因之一,而IDH抑制剂则能够通过作用于肿瘤细胞中的IDH突变位点,诱导组蛋白去甲基化,达到抑制肿瘤发展的效果。此前FDA已相继批准了首款IDH2抑制剂enasidenib和首款IDH1抑制剂ivosidenib用于白血病的治疗。目前国内尚无该靶点药物获批上市。
4.石药集团脊髓损伤治疗药物在澳大利亚申请临床。石药集团自主研发的first-in-class抗Cx43半通道膜蛋白人源化单克隆抗体Connexin43(ALMB-0166)已在澳大利亚提交首次人体临床试验申请。ALMB-0166拟用于治疗急性脊髓损伤,缺血性中风及其它多种临床急需的神经性疾病。该新药2018年11月已获FDA颁发的用于治疗急性脊髓损伤的孤儿药资格认定。据悉,ALMB-0166将在中国及美国等国家开展相关临床研究,并预计于2019年第四季向FDA提交新药临床试验(IND)申请。
5.君实PD-1联合疗法Ⅰb期临床获新突破。君实生物自主研发的抗PD-1单抗特瑞普利单抗(拓益)与抗血管生成药物阿昔替尼联用一线治疗恶性黑色素瘤的Ⅰb期临床结果积极。结果显示:该组合疗法可获48.3%的客观缓解率(irRECIST标准:ORR为51.7%),86.2%的疾病控制率。中位无进展生存期达7.5个月,中位总生存期未成熟。研究成果发表在《临床肿瘤学杂志》(Journal of Clinical Oncology)上。拓益2018年12月已获国家药监局批准用于治疗既往标准治疗失败后的局部进展或转移性黑色素瘤。
国际药讯
1.DA加速批准第三款“不限癌种”疗法。FDA加速批准罗氏开发的特异性酪氨酸激酶抑制剂Rozlytrek(entrectinib)上市,治疗携带NTRK基因融合的成年和青少年癌症患者(这些患者没有其它有效治疗方法)。这是FDA批准的第三款“不限癌种”的抗癌疗法。FDA同时批准Rozlytrek治疗携带ROS1基因突变的非小细胞肺癌患者(NSCLC)。临床汇总分析表明,Rozlytrek使NTRK融合阳性实体瘤患者的客观缓解率达57.4%,中位缓解持续时间达10.4个月;使ROS1阳性NSCLC患者的总缓解率达78%,完全缓解率达5.9%,在肿瘤缩小的40例患者中,55%患者的缓解持续时间超过12个月。
2. Harmony公司过度嗜睡治疗药物Wakix获FDA批准。Harmony公司的“first-in-class”选择性组胺3(h3)受体拮抗剂/反向激动剂Wakix (pitolisant)获FDA批准用于治疗成年发作性睡病(narcolepsy)患者的白日过度嗜睡 (EDS) 。Wakix也是唯一一个获FDA批准且未被列为管制药物的发作性睡病新药。在2项对照研究(HARMONY 1和 HARMONY 1bis)中,261例患者接受Wakix、安慰剂或阳性对照药物治疗,通过爱华睡眠量表(ESS)测量的结果显示,Wakix在 EDS方面具统计学意义的显著改善。Wakix是由Bioprojet公司研发,2016年在欧洲获批上市。Harmony通过授权获得该新药在美国开发、生产和商业化的权益。
3.新基骨髓纤维化新药Inrebic 获FDA批准上市。新基(Celgene)口服JAK2/FLT3双效抑制剂Inrebic(fedratinib)获FDA批准用于治疗中危-2和高危(intermediate-2/high-risk)原发性或继发性骨髓纤维化患者。这是FDA批准的第2款骨髓纤维化药物。这一批准是基于II期试验JAKARTA2和Ⅲ期试验JAKARTA的结果。608例患者接受Inrebic的治疗,JAKARTA结果表明,在未接受过JAK抑制剂治疗的患者中,37%接受Inrebic治疗的患者脾脏体积缩小>35%,而且40%的患者骨髓纤维化综合评分改善超过50%,这两项指标均显著优于安慰剂组。而且,JAKARTA2结果表明,在对ruxolitinib产生耐药性或不耐受的患者中,55%的患者出现脾脏体积缩小。
4.吉利德JAK抑制剂Filgotinib上市申请获EMA受理。吉利德与Galapagos公司联合开发的口服选择性JAK1抑制剂filgotinib的上市申请欧洲药管局(EMA)受理。该药拟用于治疗成人类风湿关节炎(RA)。一项III期临床24周的结果显示,在既往未接受甲氨蝶呤(MTX)治疗的RA患者中,与MTX组相比,100mg /200mg剂量filgotinib + MTX治疗组达ACR20、ACR50和ACR70缓解的患者比例显著更高;接受filgotinib治疗的患者的健康评估问卷残疾指数(HAQ-DI)评分下降幅度也更大;200mg剂量filgotinib单药疗法抑制了结构损伤的进展;安全性与之前研究一致。
5.阿斯利康创新DNA修复抑制剂临床结果积极。阿斯利康靶向DNA损伤修复机制的在研疗法AZD1775与化疗和放疗联用,在治疗新确诊的局部晚期胰腺癌患者的Ⅰ期临床中获积极结果。34例患者接受不同剂量的AZD1775以及放疗和化疗(吉他西滨)治疗,该研究除了确定组合疗法中AZD1775的最大耐受剂量外,结果还显示出该组合疗法延长了患者的总生存期(OS)。所有患者在该临床试验的中位OS为22个月,而单独使用吉他西滨治疗的患者OS为12-14个月。研究成果发表在Journal of Clinical Oncology上。
6.Ultragenyx公司与GeneTx公司合作开发反义寡核苷酸疗法。罕见病创新药研发公司Ultragenyx 和GeneTx公司将合作开发一款反义寡核苷酸(ASO)疗法GTX-102。该疗法拟用于治疗安格曼综合征,目前处于临床前阶段后期,预计2020年上半年向FDA递交IND申请。根据协议,Ultragenyx公司将支付2000万美元预付款,并获得在FDA接受GTX-102的IND后30天内收购GeneTx的独家选择权;在Ultragenyx作出选择之前,GeneTx公司将负责GTX-102的研发工作;双方将合作递交IND并共同管理安格曼综合征患者的Ⅰ/Ⅱ期临床研究;如果Ultragenyx收购GeneTx,Ultragenyx公司将负责所有开发和商业活动。
医药热点
1.华西医院荣登国内医疗机构“自然指数”排名榜首。施普林格·自然出版集团(Springer Nature)旗下自然指数网站更新了2019年最新的“自然指数”(Nature Index)排名(2018.3.1~2019.2.28),四川大学华西医院荣登国内医疗机构排名榜首,位列全球第36位。中山大学肿瘤防治中心、仁济医院居国内医疗机构第2、3位。在全球医疗机构排名中,美国的医疗机构处于领先地位,其中德克萨斯大学西南医学中心居榜首,哥伦比亚大学欧文医学中心、杜克大学医学中心紧随其后,仅有意大利科学健康研究所(IRCCS)一所非美医疗机构跻身前二十五位。
2.国际老牌期刊撤回9篇中国医学论文。SCI期刊《BIOCHEMICAL AND BIOPHYSICAL RESEARCH COMMUNICATIONS》撤回了9篇中国论文。除了同济大学的一篇论文是由于学生背着导师偷偷发表,缺少原始数据外,其余8篇来自不同科研机构的论文(都是介绍miRNA类的相关文章)存在相互引用、抄袭和捏造数据等恶意造假现象。这些文章的通讯单位多是高校(其中不少为高校的附属医院),其中郑州大学被撤稿3篇、同济大学1篇、江苏大学1篇、常州第七人民医院1篇、苏州大学1篇、山东大学1篇、威海市妇女儿童医院1篇。
3.康美药业财务造假处罚结果公布。证监会官网发布《对康美药业等作出处罚及禁入告知》。2016年至2018年期间,康美药业系统实施财务造假(虚增营业收入、货币资金等)以及未按规定披露控股股东及其关联方非经营性占用资金的关联交易情况,致使披露的相关年度报告存在虚假记载和重大遗漏。根据《证券法》相关规定,证监会拟对康美药业及马兴田等22名当事人作出处罚并对6名当事人采取证券市场禁入措施。其中,对康美药业责令改正,给予警告,并处以60万元的罚款;对马兴田、许冬瑾、邱锡伟给予警告、罚款并采取终身证券市场禁入措施等。
股市资讯
.
上个交易日 A 股医药板块 +0.77%
涨幅前三 跌幅前三
人民同泰+10.03% 亚太药业 -10.01%
中牧股份 +9.99% *ST鹏起 -5.22%
九洲药业 +9.49% *ST瑞德 -4.96%
【景峰医药】全资子公司上海景峰制药有限公司收到上海市药监局核准签发的中华人民共和国《药品GMP证书》,认证范围:原料药(玻璃酸钠)(鸡冠提取法)。
【莎普爱思】实现营业收入2.64亿元(-19.45%);归母净利润2,569.75万元(-49.50%);扣非归母净利润1,283.44万元(-72.06%)。
【健友股份】董事、自然人股东谢菊华(持股28.25%)拟通过大宗交易减持公司无限售条件流通股不超过284.22万股(总股本0.3956%)。
审评动向
1. CDE最新受理情况(08月18日)
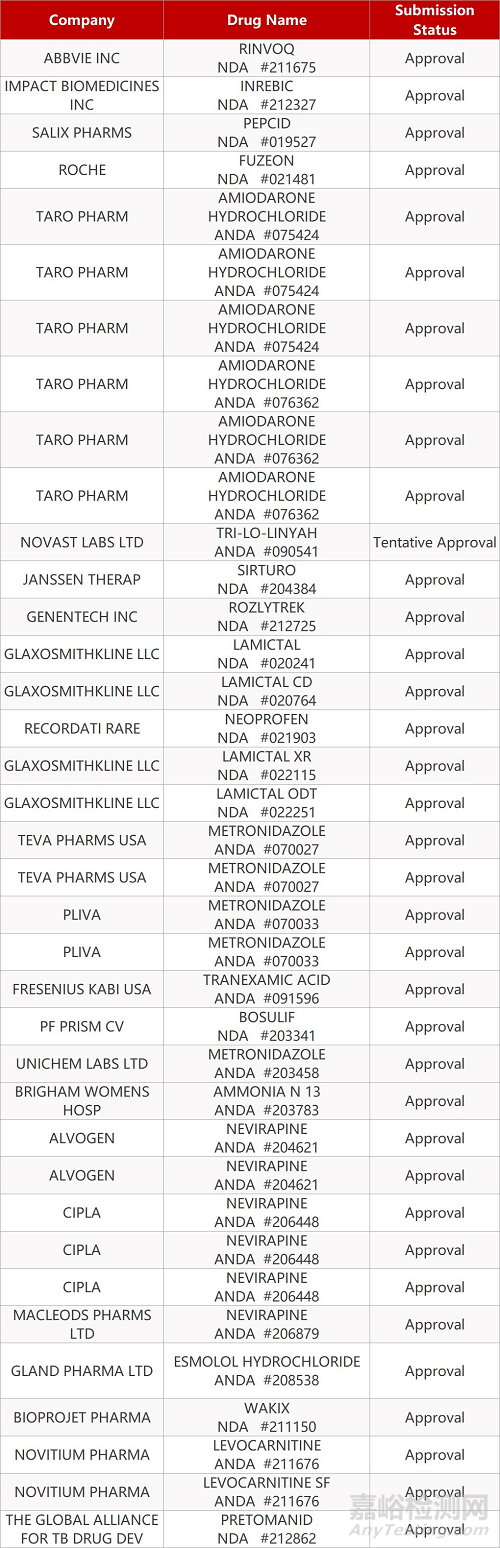
2. FDA最新获批情况(北美08月17日)


来源:药研发


