您当前的位置:检测资讯 > 行业研究
嘉峪检测网 2019-07-29 18:39

作者:郝擎1, 张欣涛1, 李晓1, 石现1, 朱炯1, 朱宁 2
1. 中国食品药品检定研究院
2. 国家药品监督管理局
摘要:
目的:从国家医疗器械抽检结果出发,总结抽检品种质量状况特点,探讨如何进一步加强医疗器械监督管理。
方法:通过对监督抽检发现的医疗器械质量状况存在的问题进行分析研究,提出相应的措施和意见建议。
结果:有源医疗器械不合格检出率较高,无源医疗器械的原料选购和工艺存在一定问题,医疗器械领域贯彻执行国家标准、行业标准存在隐忧及一些问题企业。
结论:应从落实企业主体责任并强化质量体系建设、严格处理问题产品和企业、提高审核查验针对性和力度、加大审评指导、加强国家标准和行业标准宣贯等角度入手,加强医疗器械监管。
引言
质量监督抽查检验(以下简称抽检)是加强医疗器械产品质量监管、保障公众用械安全的重要手段[1]。国家医疗器械抽检(以下简称国抽)能够在全国范围内针对抽检品种开展多维度、多环节、多方法、较大批量的检验对比、评价分析,是监管的重要举措。同时,借助这一平台,监管部门还获得了很多对于医疗器械研发、注册、生产、经营、使用等方面水平提升有较大意义的发现,促进了行业的健康发展和监管水平的整体提高。2013年以来,伴随着抽检品种和批数的扩大,处于监管末端的国抽成为前端监管环节“集大成”的综合反映[2]。在2013至2016年国抽结果深入分析[3]的基础上,本研究围绕2017和2018年国抽,分析抽检产品质量状况,归纳出当前我国医疗器械质量安全方面具有一定系统性的特点,并向行业和监管部门提出相应建议。
1 2017-2018年国抽基本情况
1.1 主要数字
2017年国家医疗器械抽检共对63种医疗器械开展了监督抽检[4],抽到样品3505批次(此外还对2种医疗器械开展了风险监测,由于风险监测不出具检验结论,本研究不予统计,下同),检出不合格样品302批次,不合格检出率8.6%。其中重点监管品种[5]不合格检出率3.0%,三类医疗器械不合格检出率5.7%,二类医疗器械不合格检出率10.8%。有源产品不合格检出率27.9%,无源产品不合格检出率3.1%,体外诊断试剂不合格检出率0.5%。
2018年国家医疗器械抽检则对62种医疗器械开展了监督抽检[6],抽到样品3158批次,检出不合格样品256批次,不合格检出率8.1%。其中重点监管品种不合格检出率5.8%,三类医疗器械不合格检出率5.9%,二类医疗器械不合格检出率9.1%。有源产品不合格检出率17.9%,无源产品不合格检出率6.9%,体外诊断试剂不合格检出率4.5%。
两年国抽主要统计数据详见表 1。
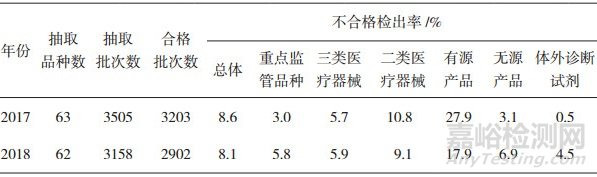
表 1 2017-2018年国家医疗器械抽检情况
1.2 整体质量状况
从表 1可以看出:1)2017-2018年国家医疗器械抽检品种的整体质量状况比较稳定,不合格检出率在8%~9%之间。2)由于抽检品种选择的差异,重点监管品种的不合格检出率出现一定变化,但均小于整体不合格检出率。3)三类、二类医疗器械的不合格检出率总体稳定,其中三类医疗器械不合格检出率在5%~6%之间,二类医疗器械不合格检出率则在10%上下。4)受到类别间的配比变化影响,有源产品、无源产品、体外诊断试剂的不合格检出率存在一定波动,但仍然呈现出“有源产品>无源产品>体外诊断试剂”的特点。
1.3 不合格品种分析
2017年国抽不合格的302批次样品共涉及43个品种,以品种计不合格发生率为68%。其中不合格检出率高于总体不合格检出率8.6%的品种共27个,合计243批次,占全部不合格批数的80%。不合格数量最集中的品种有11个,共计194批次,占全部不合格数量的64%,见表 2。不合格数量最集中品种有电动病床、半导体激光治疗机、电动轮椅车、光治疗设备、一次性使用无菌阴道扩张器、无创自动测量血压计(电子血压计)、二氧化碳激光治疗机、呼吸道用吸引导管(吸痰管)等。
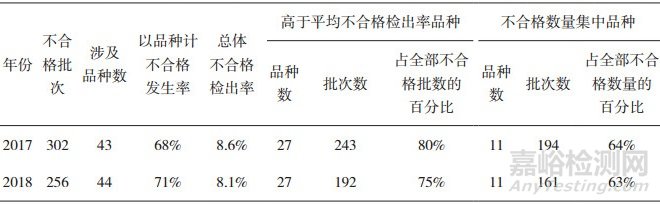
表 2 2017-2018年国抽不合格品种分析
2018年国抽不合格的256批次样品则涉及44个品种,以品种计不合格发生率为71%。其中不合格检出率高于总体不合格检出率8.1%的品种共27个,合计192批次,占全部不合格批数的75%。不合格数量最集中的品种有11个,共计161批次,占全部不合格数量的63%,见表 2。不合格数量最集中的品种有一次性使用医用口罩、无创自动测量血压计(电子血压计)、腹部穿刺器、一次性使用无菌阴道扩张器、天然胶乳橡胶避孕套、手术衣、医用外科口罩、外科缝线(针)、牙科光固化机等。
2 发现问题
2.1 质量安全风险点
为了充分发挥抽检工作的成效,国家医疗器械抽检充分整理各品种法定检验情况、探索性研究情况,收集概括了检验时所能发现的可能影响产品安全性、有效性的风险点。2017年发现风险点1600余个,2018年则发现风险点2000余个。这些风险点与医疗器械标准、注册、生产等密切相关。而通过对风险点进一步的归纳整理,我们又提炼出一些全局性、系统性问题。根据2017-2018年国抽情况,有这样几个问题值得重点关注:1)有源医疗器械不合格检出率偏高。2)部分无源医疗器械原料管理和工艺控制存在问题。3)国家标准、行业标准(以下统称国行标)执行有隐忧。4)存在一些问题企业。
2.2 有源医疗器械不合格检出率偏高
2017年国抽有源医疗器械的不合格检出率为27.9%,2018年则为17.9%,均明显高于无源医疗器械和体外诊断试剂。造成这一情况的原因是多方面的,首先是有源医疗器械对于有关标识、标签、说明书的法规和标准的执行情况远不如另外两类产品。2017年,有源产品不合格项次为402项次,其中仅标识、标签、说明书不合格就达到145项次,占比36.1%。
有源产品标识、标签、说明书大量不合格的原因,根源是企业的不重视,一些企业对标准存在错误理解[7]。
其次,有源医疗器械的电气安全项目同样存在问题。以2018年国抽为例,在去除仅标识、标签、说明书不合格的批次后,有源医疗器械不合格检出率仍然可以达到13.2%(仅降低4.7个百分点)。电气安全不合格项次占到有源不合格总项次的30%(2018年)。
电气安全是有源医疗器械的重要指标,直接关系到患者和使用者的安全[8-9]。抽检发现,特定电磁波治疗仪、微波治疗设备、超声洁牙设备等产品的不合格批次中,电气安全项不合格多发,应予以重点关注。
2.3 无源医疗器械不合格分析
2018年国家医疗器械抽检共对29种无源医疗器械开展监督抽检,涵盖了一次性无菌医疗用品、敷料、介入器械和植入器械等,其中12种二类医疗器械,17种三类医疗器械,17个品种为国家重点监管品种。经检验其中26个品种检出了不合格,不合格检出率为6.9%。
对无源医疗器械的不合格产品进行原因分析,发现其中高达56%的不合格原因可能是原材料问题[10]。典型品种和不合格项目包括:一次性使用医用口罩的细菌过滤效率、医用外科口罩的压力差(Δp)、手术衣的胀破强度、一次性使用便携式输注泵的紫外吸光度、天然胶乳橡胶避孕套未经老化爆破体积和爆破压力、骨科植入物的显微组织等。此外,风险监测也发现一些聚氯乙烯输液输血器具的原料中含有荧光物质。
无源医疗器械抽检不合格另一个主要原因则是工艺问题,主要表现为外观、配合性、尺寸、装量、准确度(流量)、表面粗糙度等的不合格。2018年抽检发现尺寸、装量、外观等生产过程容易控制的项目不合格占比接近20%,说明我国无源医疗器械加工工艺水平提高依然任重道远[11]。
2.4 国行标执行有隐忧
2018年国抽对62个品种的产品技术要求开展了抽检项目贯彻执行国行标(含强制性和推荐性国行标)情况的统计与分析。发现总体贯标率(总体贯标率=所有考察项目均执行了相应国行标的产品技术要求数量÷该品种抽到样品总数量×100%)超过90%的有13个品种,贯标率低于60%的有16个品种(表 3)。其中,中医诊断设备、Nd:YAG激光治疗机、血液冷藏箱、载脂蛋白A-I测定试剂(盒)、丙氨酸氨基转移酶测定试剂盒、γ-谷氨酰基转移酶测定试剂(盒)等6个品种的总体贯标率为0%,这些品种抽到样品的每一份产品技术要求均存在不同程度的缺项或低于国行标的情况[12]。
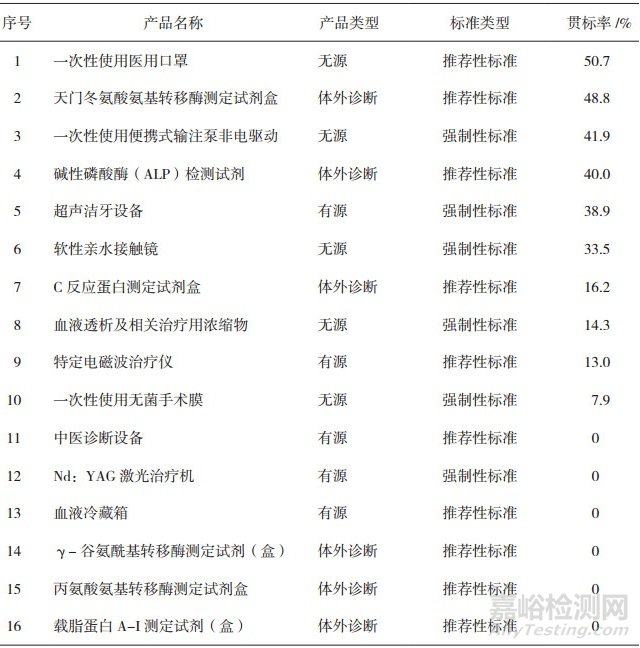
表 3 贯彻执行国行标情况不佳品种
尽管产品技术要求贯彻执行国行标不够乐观,但按照强制性国行标和产品技术要求两种标准同时开展检验的结果,又与贯标情况呈现出一定的不同。2018年国抽共有44个品种2500多批涉及强制性国行标(以下简称强标)与产品技术要求双重判定(强标或产品技术中出现其中一项不合格即综合结论不合格),实际判定结果不一致的有16批,仅占比0.7%。
造成这种对比的原因:一是双标检验仅针对须执行强标的品种,推荐性标准不开展双标检验;二是存在一批按强标和产品技术要求检验都不合格的产品;三是暴露出一些医疗器械生产企业“注册生产两张皮”的现象。这些企业的产品技术要求仅为通过注册审评用,并不拿来开展质控。甚至,一些产品技术要求“模板”在业内传抄,低级错误以讹传讹[13]。
2.5 存在一些问题企业
一是当年多品种不合格的生产企业。2017年发现此类企业6家,其中河南2家、江苏2家、上海1家、湖北1家。2018年发现此类企业7家,其中河南4家,江苏1家,河北1家,江西1家。
二是多年同品种不合格的生产企业。2017年发现此类企业1家,属于河南企业。2018年则发现此类企业20家,其中河南5家,江苏5家,江西3家,上海2家,浙江1家,山东1家,山西1家,广东1家。
三是多年不同品种不合格的生产企业。2017年发现此类企业1家,属于江苏企业。2018年则发现此类企业6家,其中河南4家,江苏1家,江西1家。
2.6 其他
除了以上一些系统性问题,国抽还发现我国医疗器械行业由于所处阶段而存在的一些可以通过发展来解决的问题,如手术衣、手术单的关键区域划分规则不明确[14]、医用壳聚糖产品的管理类别界定不够清晰[15]、二氧化碳激光治疗机的注册单元划分和注册样品代表性问题[16]、有粉的一次性使用医用橡胶检查手套应当淘汰[17]等。
3 意见建议
3.1 建议医疗器械生产企业加强自身体系建设
一是加强标识、标签、说明书的内审自查,发现问题迅速整改。二是加强有源产品的零配件设计和采购、无源医疗器械原材料选择和验收,咨询权威,吃透标准,舍得投入。三是做好工艺控制,将更多的资金投入研发和制造,采购更高精度和可靠性的制造装备,提升设计和工艺水平。
3.2 建议加强对问题产品、问题企业的处理
一是建议各省市药品监督管理部门以抽检不合格产品召回为抓手,敦促企业调查不合格原因、提出整改措施并实施整改,将抽检发现的问题化整为零、逐一解决。二是建议对多年或多品种被发现不合格的问题企业开展飞行检查,用最严格的监管压缩不法企业的生存空间。
3.3 建议加大对医疗器械生产企业的审核查验力度
一是建议出台有源医疗器械生产企业质量管理规范检查指南细则。二是重点关注有源医疗器械零配件和无源医疗器械原材料供应商选择与评价、采购控制、进货检验、出厂放行等环节的检查。
3.4 建议国家审评中心、标准管理中心加强对地方的审评指导
一是建议对需要厘清的概念、管理类别界定、技术要求中应包含的主要指标等给出指导意见。二是建议对于注册单元划分和注册样品的代表性问题进行研究,组织对一些典型品种的审评质量检查。三是建议在审评时限定一些已逐渐被淘汰的原材料使用范围,引导产业向更好方向发展。四是建议加大注册体系考核力度。
3.5 建议进一步做好国行标的宣贯
一是建议相关医疗器械标准化技术委员会继续组织开展针对企业和审评人员的培训。二是建议各地医疗器械技术审评部门也能加强对标准的学习,将标准条款和精神应用到产品技术要求的审评中去。
4 结语
医疗器械技术的进步、行业的规范、产业的持续稳定健康发展,离不开每一个从业者的共同努力。随着国家和社会对医疗产品的愈发重视,作为衔接标准、研发、注册、生产、检查、检验的特殊平台,医疗器械抽检承载了很多。对于其中的一些承载,或许抽检只能发现端倪、提供线索、合理推测、侧面验证,但也期望能够竭尽所能做好这些,为医疗器械的全生命周期质量监管做出一定贡献。
参考文献
[1] 国务院.国务院关于修改《医疗器械监督管理条例》的决定[EB/OL].(2017-05-19)[2019-01-25]. http://www.gov.cn/zhengce/content/2017-05/19/content_5195283.htm.
[2] 张欣涛, 朱炯, 郝擎, 等. 国家医疗器械质量监督抽验管理工作回顾及展望[J]. 中国药事, 2017, 31(3): 242-246.
[3] 张欣涛, 郝擎, 石现, 等. 2013-2016年国家医疗器械监督抽验产品质量状况分析[J]. 中国医疗器械杂志, 2017, 41(3): 216-219. DOI:10.3969/j.issn.1671-7104.2017.03.016
[4] 原国家食品药品监督管理总局.食药监办械监[2017] 67号关于印发2017年国家医疗器械抽检产品检验方案的通知[S]. 2017.
[5] CFDA.关于印发国家重点监管医疗器械目录(2009年版)的通知[EB/OL].[2019-01-25]. http://www.sda.gov.cn/WS01/CL0845/40674.html,2009-08-14/2016-11-23.
[6] 国家药品监督管理局.药监办[2018] 14号关于印发2018年国家医疗器械抽检产品检验方案的通知[S]. 2018.
[7] 吕宏光. 质量体系对医疗器械标签、说明书和包装的要求探究[J]. 中国医疗器械信息, 2014(2): 41-45.
[8] 钱晓阳. 医用电气系统安全的讨论[J]. 中国医疗器械杂志, 2005, 29(1): 29-33, 22. DOI:10.3969/j.issn.1671-7104.2005.01.010
[9] 孙绚. 医疗设备的电气安全性问题以及对策分析[J]. 中国高新技术企业(中旬刊), 2016(2): 137-138.
[10] 刘歆, 徐凤玲. 无源医疗器械采购控制监管方式探索[J]. 中国医疗器械信息, 2012, 18(5): 9-14. DOI:10.3969/j.issn.1006-6586.2012.05.003
[11] 马俊.一次性无菌医疗器械质量若干问题调查与研究[D].天津医科大学, 2010. DOI: 10.7666/d.y1749505.
[12] 杜晓丹, 陈鸿波, 杨昭鹏. 我国医疗器械检验机构产品技术要求预评价工作现状、问题和建议[J]. 中国药事, 2017, 31(9): 1085-1089.
[13] 李非, 陈敏. 医疗器械注册核心概念及其关联的研究[J]. 中国医疗器械信息, 2018, 24(19): 8-11, 16. DOI:10.3969/j.issn.1006-6586.2018.19.003
[14] 邓敏, 张萃逸, 姚敏. 国内外医用手术衣的使用现状、发展趋势及技术标准[J]. 中国感染控制杂志, 2015(7): 499-504. DOI:10.3969/j.issn.1671-9638.2015.07.019
[15] 柯林楠, 冯晓明, 王春仁. 医用敷料研究的现状与进展[J]. 中国组织工程研究与临床康复, 2010, 14(3): 521-524. DOI:10.3969/j.issn.1673-8225.2010.03.034
[16] 原国家食品药品监督管理总局.关于发布医疗器械注册单元划分指导原则的通告(2017年第187号)[EB/OL]. (2017-11-03)[2019-01-25]. http://www.nmpa.gov.cn/WS04/CL2183/322165.html.
[17] 原国家食品药品监督管理总局.医疗器械不良事件信息通报(2018年第2期)[EB/OL].(2018-01-18)[2019-01-25]. http://www.nmpa.gov.cn/WS04/CL2157/319111.html.

来源:xml-data


