摘要:
目的:通过开展金银花配方颗粒评价性抽验,比较分析不同厂家金银花配方颗粒的质量情况,并提出监管建议。
方法:收集各企业金银花配方颗粒质量标准,依据企业标准进行法定检验。结果:共抽验117批金银花配方颗粒,涉及9家生产企业。按各自企业标准进行检验,总体合格率为100%。但是各企业之间金银花配方颗粒含量差异较大且每克颗粒相当的药材(饮片)量不同,转移率不同。
结论:通过本次抽验发现金银花配方颗粒的整体质量较高,但是不同厂家之间所用原料药材及生产工艺存在一定差异,导致最终产品质量参差不齐。因此,有必要规范中药配方颗粒生产工艺,尽快统一标准,加强监管。
中药配方颗粒是由单味中药饮片经水提、浓缩、干燥、制粒而成, 在中医临床配方后, 供患者冲服使用, 是对传统中药饮片的补充[1]。因其具有携带、使用方便的优点, 同时保持了一定中医药临床应用的特色, 已被很多患者和中医接受, 在国际上也较传统中药饮片受欢迎, 市场前景较好[2-4]。而且由于现阶段中药配方颗粒是按照中药饮片管理, 有些地方已将其纳入医保, 作为基本药物管理使用, 不受"药占比"规定的限制, 所以市场用量较大, 占有率较高[5-6]。但是, 中药配方颗粒也存在一些争议, 例如价格比普通饮片高, 临床疗效尤其是合煎和共煎的等效性等有待验证; 另外, 我国仍未建立统一的中药配方颗粒国家标准[6-9]。自2001年原国家药品监督管理局正式命名中药配方颗粒至今, 中药配方颗粒仍然处在试点阶段, 配方颗粒市场处于不公平的竞争状态[6, 10]。
金银花是我国常用中药材, 药用历史悠久, 有"中药中的抗生素"之称, 在我国资源分布广泛, 其药材及饮片标准已收载于《中华人民共和国药典》(以下简称《中国药典》)2015年版, 而且具有一定的研究基础。金银花配方颗粒为金银花药材干燥加工成饮片后, 以水为溶剂, 经减压浓缩、喷雾干燥及制粒等现代工艺制成, 具有清热解毒、疏散风热的功效。可用于痈肿疔疮、喉痹、丹毒、热毒血痢、风热感冒、温病发热等病症[11]。目前, 在中药配方颗粒试点企业内均有生产, 便于进行质量比较分析。为此, 2018年全国中药材及饮片评价性抽验选择金银花配方颗粒为其中一个品种, 依据相应的企业标准进行法定检验, 以初步了解中药配方颗粒质量情况, 为监管提供参考。
1 标准收集情况
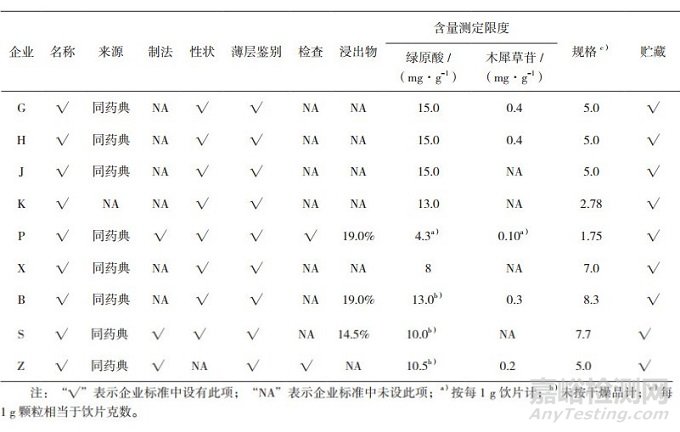
目前, 已批准的国家级配方颗粒试点生产企业有6家:华润三九医药股份有限公司、广东一方制药有限公司、江阴天江药业有限公司、北京康仁堂药业有限公司、培力(南宁)药业有限公司、四川新绿色药业科技发展有限公司。有配方颗粒销售上市的省级试点3家:江西百神药业股份有限公司、神威药业集团有限公司、浙江景岳堂药业有限公司。因此, 收集上述9家试点企业金银花配方颗粒质量标准, 按照中药配方颗粒质量控制与标准制定技术要求(以下简称技术要求)中相关规定[12], 将9家企业质量标准对比情况列表, 详见表 1(按照国家药品抽验管理规定, 厂家名称以代码表示)。
表 1 9家企业质量标准情况对比一
1.1 技术要求规定标准项目
技术要求中规定, 中药配方颗粒的质量标准主要包括:名称、来源、制法、性状、鉴别、检查、浸出物、指纹图谱或特征图谱、含量测定、规格、贮藏等。对比9家企业质量标准可以看出:部分厂家【制法】【检查】【浸出物】项缺失, 9家企业标准均未建立【指纹图谱】或【特征图谱】, 企业Z质量标准中缺少【性状】项, 企业K质量标准项下缺少【来源】项; 另外, 《中国药典》2015年版含量测定包含绿原酸和木犀草苷2个指标, 然而对比标准发现, 企业J、K、X、S均未进行木犀草苷的含量测定, 且各厂家含量测定限量要求差异大, 每1 g颗粒相当的药材(饮片)量不统一。
1.2 其他项
除技术要求中相关规定外, 各厂家均参考《中国药典》2015年版四部0104颗粒剂项下有关规定制定了相关检查项及限度。企业K金银花配方颗粒标准中还建立了【红外指纹图谱】检测方法。另外, 根据中药配方颗粒质量标准研究的技术要求[13], 中药配方颗粒标准中, 【功能与主治】【注意】应与《中国药典》2015年版一部一致; 【用法与用量】供配方用, 遵医嘱; 【贮藏】根据各品种的情况酌定; 【有效期】根据稳定性试验确定。9家企业中, 企业K和企业P缺少【功能与主治】 【性味与归经】【用法与用量】项, 具体情况见表 2。
表 2 9家企业质量标准情况对比二
2 样品来源
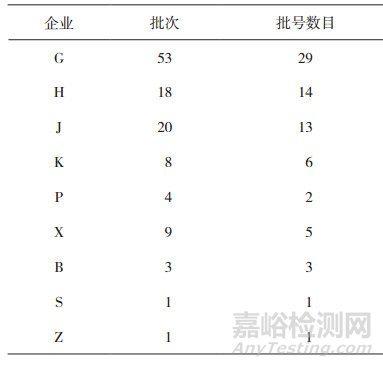
本次抽样共抽取金银花配方颗粒样品117批次, 抽样地域覆盖了全国23个省级行政区, 涉及9个生产企业, 结果见表 3。
表 3 9家企业抽样批次表
3 检验方法与结果分析
按照企业标准检验, 9家企业金银花配方颗粒抽验总体合格率100%, 但是不同检验项目仍存在一些问题。
3.1 性状检查
中药配方颗粒已失去饮片原有性状特征。在性状上主要体现为颗粒化, 企业标准中所规定的性状检查仅是对气味和颜色的判断。
9家企业中除企业Z质量标准中缺少【性状】项外, 其余8家企业均对金银花配方颗粒性状做了规定, 但是对颜色、气味和味道的描述稍有差异。检查结果显示, 所有抽验样品均符合规定, 但是从颜色比较可以看出企业X的产品不同批次间颜色有差异, 其他各企业产品之间颜色深浅也有差异, 提示可能与各企业的生产工艺、添加辅料不同等有关。
3.2 薄层鉴别
《中国药典》2015年版一部金银花【鉴别】项, 以绿原酸对照品为对照, 薄层色谱法进行鉴别。9家企业的金银花配方颗粒标准中均规定了薄层鉴别项, 且都增加了金银花对照药材对照, 虽然样品处理浓度、薄层板的选择稍有差异, 但基本为药典方法转化而来。按照企业标准对117批样品进行薄层鉴别项检验, 结果显示所有样品均符合规定。
3.3 检查项
9家企业中, 仅企业P【检查】项下规定了山银花、重金属及有害元素、农药残留限量要求, 企业Z【检查】项下有重金属及有害元素检查, 其余厂家并未规定相关检查项。
关于山银花检查项, 自《中国药典》2005年版一部按照"一物一名"的原则将金银花和山银花分列后, 山银花和金银花就明确区分为两个品种, 而且近些年关于两种药材的争议不断。目前, 市场上这两种药材混用严重, 因此建议将山银花检查项列入金银花配方颗粒质量标准。本次抽验的117批样品中, 仅企业P金银花配方颗粒质量标准项下规定了【山银花检查】项, 经检验, 4批抽验样品均未检出灰毡毛忍冬皂苷乙; 但企业P制定的检验方法操作繁琐、灵敏度不高, 需要进一步研究改进方法。
企业P和企业Z规定了重金属及有害元素、农药残留限量检查项, 方法基本同《中国药典》2015年版相关规定一致, 结果两企业的抽验样品均符合规定。
3.4 颗粒剂有关检查项
9家企业金银花配方颗粒标准中均对颗粒剂项下粒度、水分、溶化性、装量差异/最低装量、微生物限度做出了相关规定, 除企业K限度更加严格外(粒度能通过一号筛和能通过五号筛的总和不得过13%;水分不得过6.0%), 其余厂家均采用《中国药典》2015年版颗粒剂项下相关规定。结果显示, 抽验样品水分、粒度、装量差异/最低装量、溶化性、微生物限度检查均符合规定。
3.5 浸出物的测定
根据技术要求规定, 对难以进行含量测定或所测成分含量低于千分之一的配方颗粒品种, 应建立【浸出物】测定项。9家企业中仅企业P、B和企业S的金银花配方颗粒标准中有【浸出物】项。考虑到各企业绿原酸含量测定都高于千分之一, 因此建议【浸出物】项可不予收入标准。结果企业P、B、S抽验样品的浸出物均符合规定。
3.6 含量测定
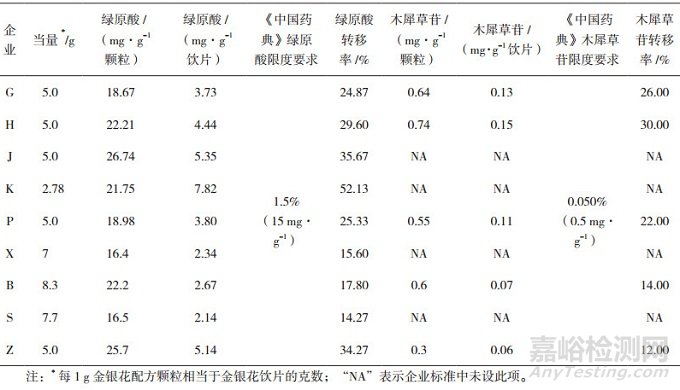
《中国药典》2015年版"金银花"含量测定项下规定"本品按干燥品计算, 含绿原酸不得少于1.5%, 含木犀草苷不得少于0.050%"。金银花配方颗粒企业标准基本均为药典方法转化而来, 只是限度有所不同。另外, 企业J、K、X、S未规定木犀草苷的含量测定项。
统计含量测定结果发现, 本次抽验金银花配方颗粒同一厂家不同批次间绿原酸含量差异较小, 计算各厂家所有样品含量测定平均值(mg·g-1饮片), RSD值均小于20%, 样品含量平均值结果见表 4。由于每个厂家每克配方颗粒相当的药材(饮片)量不同, 不便进行含量比较, 因此按照各企业相应当量转换为每1 g饮片含绿原酸或木犀草苷的含量(mg·g-1颗粒), 结果显示9个厂家含量差异比较大。以绿原酸为例, 绿原酸含量最高的厂家是企业K, 绿原酸含量为7.82 mg·g-1饮片; 含量最低的厂家是企业S, 含量为2.14 mg·g-1饮片, 相差3.65倍。而且将9个厂家绿原酸和木犀草苷含量折算成每克饮片计算后, 含量都较低, 全部低于药典限度, 提示各厂家生产的金银花配方颗粒转移率较低。即使药材含量按药典限度计算, 金银花配方颗粒中绿原酸的转移率仅为14.27%~52.13%, 木犀草苷转移率为12%~30%, 且不同厂家之间转移率差距比较大。这可能与各厂家的提取工艺和原料药材不同有关。
表 4 9家企业金银花配方颗粒绿原酸、木犀草苷平均含量及转移率结果
4 讨论
4.1 标准和检验方法存在的问题
从前期标准收集情况看, 所有试点企业均通过对金银花配方颗粒进行研究, 制定了各自的企业标准。但是还存在一些问题, 例如部分企业【制法】项缺失, 缺乏指纹图谱或特征图谱, 山银花检查项重视度不够, 【含量测定】限量要求差异较大等。而且企业标准存在语言表达不规范, 甚至描述错误、矛盾等问题。从标准项目设置来看, 目前企业标准并不能完全控制金银花配方颗粒的质量, 建议尽快完善质量评价指标, 建立统一的中药配方颗粒质量标。
4.2 关于金银花配方颗粒转移率问题
由于无法得知金银花配方颗粒生产企业实际所用金银花原料药材中绿原酸和木犀草苷的含量, 所以计算各厂家转移率时, 金银花药材含量暂且按药典限度(药材合格的最低要求)进行估算, 9家企业中企业K绿原酸转移率最高, 可达52.13%。通过课题组前期调研了解到, 企业K金银花配方颗粒大生产中绿原酸的实际转移率为40%左右, 与估算值较为接近, 说明此种估算方式有意义, 某些厂家绿原酸转移率确实偏低。但是文献表明[14], 金银花标准汤剂绿原酸转移率可达78.6%, 且12批样品RSD值为10.7%, 稳定性良好。说明目前企业大生产和科研之间存在较大差距。
5 结论
通过本次抽验发现金银花配方颗粒的整体质量较高, 9家试点企业均能按照各自企业制定的标准严格执行金银花配方颗粒的生产, 市场抽验样品中未出现不合格情况。但是, 不同厂家之间所用原料药材及生产工艺不同, 导致最终产品质量参差不齐。并且中药配方颗粒每1 g颗粒相当的药材(饮片)量不同, 转移率不同, 必然会造成临床疗效的差异, 使得中医调配也不易掌握[15]。所以, 建议制定中药配方颗粒生产工艺指导原则, 加强原料药材的控制, 以中医药理论为指导, 统一优化提取、分离、浓缩、干燥制粒、包装工艺等技术环节, 保证不同厂家和批次间的稳定性、均一性[16]。另外, 陈士林教授等提出的中药标准汤剂[17]为解决中药配方颗粒存在的质量不均一、质量标准不明确等问题提供了新的思路。但是, 标准汤剂属于一种标准范畴, 在操作层面缺乏实质性研究成果。所以建议研究发布中药对照标准汤剂, 为中药配方颗粒的生产及质量控制提供实物参照物。此外, 更要加强临床监管和用药追踪[18-21], 保证中药配方颗粒的有效性。