您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-05-20 17:21
前言
《中国药典》2020年版(ChP2020)编制大纲化学药部分提出“加强国家药品标准的科研工作,结合我国制药工业生产实际,制定具有我国特色并具有科学性和适用性的标准”。在“涉及增强质量可控性的方法学研究”方面,要求“加强方法中系统适用性试验研究并在标准中予以体现,提高方法的重现性和准确性”。

ChP2020编制大纲既然明确提出了“系统适用性试验研究”工作,说明这个试验有着很重要的作用,特别是在提高方法的重现性和准确性方面。目前,在中国药典有些品种的质量标准中,特别是有关物质项下,有的系统适用性试验缺乏针对性,仅规定了主峰的理论板数或者与相邻杂质的分离度,在使用这个方法进行样品检测的时候重现性和准确性不够好。此外,在ChP2015通则9101《药品质量标准分析方法验证指导原则》中也没有明确规定需要进行系统适用性试验研究和验证,仅在耐用性项下规定:测定条件小的变动应能满足系统适用性试验要求,以确保方法的可靠性。因此在方法开发与验证的过程中,存在着对系统适用性试验认识和研究不足、缺少重视的情况。
本文结合案例,对“系统适用性试验研究”进行一些思考,以供广大研发人员在研究时借鉴。
一、主要国内外药典对系统适用性的一般要求
1、中国药典四部通则中的规定
以常见的液相色谱法为例,在ChP2020第一次征求意见稿0512高效液相色谱法中规定:色谱系统的适用性试验通常包括色谱柱的理论板数(n)、分离度(R)、灵敏度、拖尾因子(T)、重复性共5个参数。要求按各品种项下要求对色谱系统进行适用性试验,即用规定的对照品溶液或系统适用性试验溶液在规定的色谱系统下进行试验,如果不满足要求,可对色谱系统进行适当调整,以符合要求。
(1)色谱柱的理论板数(n)。理论板数可以评价色谱柱的性能,测定时应指明测定物质,一般为待测物质或内标物的理论板数。
(2)分离度(R)。分离度用于评价待测物与被分离物之间的分离程度,是衡量色谱系统分离效能的关键指标。除另有规定外,待测物色谱峰与相邻色谱峰之间的分离度应大于1.5。
(3)灵敏度。用于评价色谱系统检测微量杂质的能力,通常以信噪比(S/N)表示。系统适用性可以设置灵敏度溶液来评价色谱系统的检测能力。定量测定时要求信噪比应不小于10。
(4)拖尾因子(T)。用于评价色谱系统的对称性。以峰面积作定量参数时,一般的峰拖尾或前伸不会影响峰面积积分,但严重会影响基线和色谱峰起止的判断和峰面积积分的准确性,此时应在品种正文项下对其做出规定。
(5)重复性。用于评价色谱系统连续进样时响应值的重复性能。采用外标法时,通常取对照品溶液连续进样5次,RSD应不大于2.0%。采用内标法时,通常配制相当于80%、100%、120%的对照品溶液,加入规定量的内标溶液,配成3种不同浓度的溶液,分别至少进样2次,计算平均校正因子,其RSD应不大于2.0%。当待测成分是微量或痕量时,进样量少或色谱峰响应值较小时,对RSD的要求可以适当放宽。
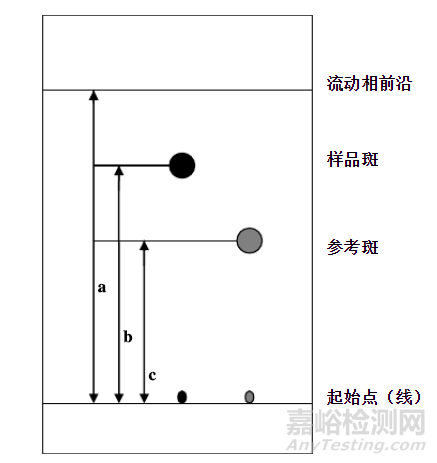
在ChP2015通则0502薄层色谱法中系统适用性项下规定了比移值(Rf)、检出限、分离度、相对标准偏差。其中比移值系指从基线至展开斑点中心的距离与从基线至展开剂前沿的距离的比值。除另有规定外,杂质检査时,各杂质斑点的比移值R以在0 .2〜0 .8之间为宜。

在ChP2015通则0513离子色谱法、0521气相色谱法、0531超临界流体色谱法、0532临界点色谱法、0542毛细管电泳法中关于系统适用性的规定为:除另有规定外,应照高效液相色谱法通则0512项下的规定。
在ChP2015通则0514分子排阻色谱法系统适用性项下规定,系统适用性试验中色谱柱的理论板数(n )、分离度、重复性、拖尾因子的测定方法,在一般情况下,同高效液相色谱法(通则0512)项下方法,但在高分子杂质检査时,某些药物分子的单体与其二聚体不能达到基线分离时,其分离度公式如下,除另有规定外,分离度应大于2 .0。

中国药典中常用色谱方法中的系统适用性试验参数
|
通则 |
系统适用性试验参数 |
|
0512高效液相色谱法 |
理论板数(n)、分离度(R)、灵敏度、拖尾因子、重复性(RSD%) |
|
0502薄层色谱法 |
比移值(Rf)、检出限、分离度、RSD% |
|
0513离子色谱法 |
同高效液相色谱法 |
|
0514分子排阻色谱法 |
同高效液相色谱法,特殊情况可以用分离度表示(同峰谷比) |
|
0521气相色谱法 |
同高效液相色谱法 |
|
0531超临界流体色谱法 |
同高效液相色谱法 |
|
0532临界点色谱法 |
同高效液相色谱法 |
2、USP 621色谱法中的规定
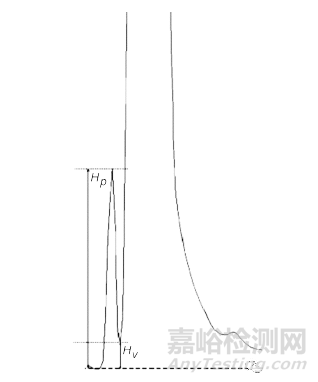
USP 621色谱法中规定的系统适用性评价参数包括:分离度、对称因子、重复性、信噪比、理论板数,还有Peak-to-Valley Ratio (p/v)峰谷比(计算公式为p/v = Hp/Hv)。
3、EP 2.2.46色谱分离技术中的规定
EP 2.2.46色谱分离技术中规定的系统适用性评价参数与USP基本一致,包括:分离度、对称因子、重复性、信噪比、理论板数、Peak-to-Valley Ratio (p/v)峰谷比(计算公式为p/v = Hp/Hv)。
通过比较可见,USP、EP中规定的系统适用性参数与ChP基本一致,但USP、EP中有峰谷比,ChP仅在分子排阻色谱法中提到了一个与峰谷比相同的分离度,在其他色谱法中没有这个规定。总体来看,欧美药典的规定要比中国药典细致,在具体品种的标准中,欧美药典也很重视系统适用性试验。
系统适用性试验是为了保证方法重现性和准确度,一个方法中的系统适用性溶液如何配制、如何规定,都与具体的检测方法、检测目的、检测样品有关。不同方法和不同的目的会有不同的系统适用性要求,例如梯度、等度、含量测定、有关物质等,对应系统适用性试验一般就不同;不同来源的样品,由于其处方和生产工艺、杂质谱分布可能不同,系统适用性试验的设计也可能完全不同。
对于有关物质方法而言,如果缺少系统适用性要求,就很难保证方法的重现性,特别是在色谱柱等重要信息未在标准中明确规定的情况下就更难重现了,即使重现了,也可能出现样品中个别杂质顺序出现不同的情况。系统适用性试验不是一个孤立的试验,受很多参数的影响,虽然ChP2020通则9101没有说明系统适用性试验该如何研究和验证,但在方法开发、优化、方法学验证、方法转移、方法使用的过程中都应该去结合具体品种和具体方法去设计。目前系统适用性试验该如何规定、如何进样,还未见有官方的规定。
二、系统适用性试验的设计
尽管没有官方规定,但是我们可以参考欧美药典中的一些设计做一些分析和思考,以常用的HPLC法、GC法为例:
1、含量测定
采用外标法时,通常取对照品溶液连续进样5次,RSD应不大于2.0%。ChP规定采用内标法时,通常配制相当于80%、100%、120%的对照品溶液,加入规定量的内标溶液,配成3种不同浓度的溶液,分别至少进样2次,计算平均校正因子,其RSD应不大于2.0%。但有些USP品种(如奥美沙坦酯),采用内标法时,系统适用性评价采用对照品溶液(含内标),评价指标为主成分与内标物的分离度,以及二者峰面积比值的RSD,小于0.5%。说明内标法测定含量时也可以采用外标法的思路进行,研究中可以与药典中配制高中低三份溶液的规定对比,如果经过研究和验证二者都可以保证结果的准确度与精密度,是可以考虑突破药典规定的。通过多个品种的比较发现,USP含量测定中RSD几乎是都有的,而理论板数则使用的较少,而中国药典中有些品种项下只规定了一个理论板数应大于XXX,而这可能仅仅是一个虚的指标,应该提高标准。
2、残留溶剂
对于气相色谱法测定残留溶剂,USP标准中采用内标法测定,其系统适用性评价指标为待测物与内标物的分离度,以及二者峰面积比值的RSD,例如小于5.0%。这说明,当待测成分是微量或痕量时,进样量少或色谱峰响应值较小时,对RSD的要求可以适当放宽。
3、有关物质
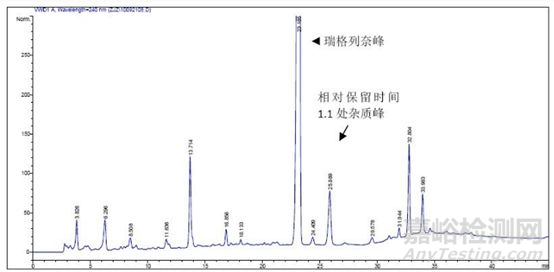
USP中采用主成分外标法测定杂质的比较多,即配制一定浓度的主成分对照品溶液,以此计算每一个杂质的含量,有时也包括加相对响应因子的主成分外标法。此时系统适用性要求一般考察对照品溶液峰面积的RSD,如不得过2.0%,也有的规定不得过10%(如USP瑞格列奈),这些限度都是经过大量研究和验证的,目的是保证进样的精密度和准确度。
以阿奇霉素为例,ChP2010有关物质中没有系统适用性溶液,只有灵敏度溶液,但是ChP2015中增加了系统适用性溶液,规定灵敏度溶液主峰信噪比应大于10,系统适用性溶液色谱图中各峰之间的分离度均应大于1.2,阿奇霉素峰的保留时间应在30~40min之间。系统适用性溶液不但起到了保证杂质分离度的作用,而且在后期归属的时候也能够准确对杂质进行归属。可是,阿奇霉素系统适用性对照品在中检院国家药品标准物质查询与订购平台却查不到、买不到,说明对照品对质量标准之间还存在很多问题。
没有混合对照品怎么办?目前,含多个杂质的系统适用性溶液配制方法有很多种,例如分别用杂质对照品配制、一部分用杂质对照品一部分用主成分降解、将多个杂质与主成分混合均匀配成均一的混合物、将多个杂质与主成分溶解后蒸干制成混合物、使用经过定性研究过的代表性的粗品、购买EP、BP、USP的混合对照品/峰鉴别对照品等,研究中可以根据方法和品种特点进行选择。
例如瑞格列奈有关物质检查项下就规定:取供试品溶液,置 90℃水浴加热24小时,放冷,取20µl注入液相色谱仪,记录色谱图,瑞格列奈峰保留时间约为22min,在相对瑞格列奈峰保留时间约为 1.1处应出现杂质峰,该杂质峰与瑞格列奈峰的分离度应符合要求。
如果主峰前后存在一个难分离的杂质,那么在有关物质系统适用性设计时应采用外标法或降解法配制系统适用性溶液,例如浓度可以为供试品浓度+杂质限度浓度或几倍杂质限度浓度的溶液,来考察保证重现性和准确性。
4、溶出度
USP盐酸二甲双胍片溶出度方法3中的系统适用性规定对照品溶液的拖尾因子不得过2.0、理论板数不低于1500,RSD不得过2.0。这个例子说明在如此大浓度的样品检测时,容易出现较大的拖尾,甚至理论板数下降的情况,但是即使拖尾因子不在常规的0.95~1.05或0.8~1.5范围内,理论板数不在常规的2000以上,只要结果准确度和精密度不受影响,也能够满足检测要求。所以系统适用性是与检测目的和检测样品有关的,不能千篇一律。
5、异构体
如果采用外标法测定,USP标准(如瑞格列奈)采用与供试品溶液相同浓度以及10倍异构体限度浓度配制了系统适用性溶液(混合溶液),同时配制了限度浓度的对照品溶液。系统适用性试验中规定异构体对主峰的相对保留时间约为1.5、分离度应不低于1.5、以及对照品溶液的RSD不得过5.0%。说明采用外标法定量时对照品溶液的RSD是重点考察指标,分离度是专属性的保证,而且加上相对保留时间作为对比,进一步提高了方法的重现性。通常我们可能认为既然已经规定了4.0mm×100cm,5µm的L41色谱柱,就没有必要增加1.5的相对保留时间了,但是USP还是增加了这一条,说明在提高方法重现性和准确性方面我们还需要向USP学习这种理念。
三、总结
USP对分析方法系统适用性的重视已经引起了行业内人员的关注,对分析方法而言,系统适用性试验非常重要。在一个分析方法建立后,以后会在不同人员、不同仪器、不同时间、不同实验室、各种不同情况下被使用,可能会出现各种异常或者偏差。那么如何减少这种情况呢?在方法研究的过程中开展系统适用性试验研究,我想是可能一种有效的方法。
一旦方法中包括了系统适用性试验,就一定要在样品检测时进行这个试验,不能忽视,认为可有可无。例如,在2019年国家局飞检中就常见“检测前未进行色谱条件与系统适用性试验”的缺陷。系统适用性试验已经是GMP检查的一部分。
如果系统适用性试验按照方法中规定的参数去做达不到要求时该如何进行色谱参数的调整呢?
ChP2020版药典(征求意见稿)0512高效液相色谱法中首次公开了具体色谱参数允许调整范围,这些参数参考了EP 2.2.46和USP 621,是一个很大的进步。相信随着这些通则内容的不断完善,关于系统适用性试验中相关的参数调整内容会更有依据。



在参考EP、USP标准进行方法研究时,注意不能脱离其他色谱参数而去考察系统适用性,例如首先要关注色谱柱使用是否正确,如果不正确,系统适用性是很难满足要求的。在EP、USP标准中往往都规定了色谱柱的规格,在使用标准可以先通过EDQM中的Knowledge Database以及USP色谱柱数据库进行色谱柱的检索。
如果在方法学验证中发现不同仪器、不同试剂、不同流速、不同pH、不同柱温、不同离子对试剂、不同衍生化试剂等这些参数对方法的系统适用性有影响,那么应在方法中进行规定或说明,以保证以后方法使用时的重现性和准确性。
EP和USP杂质检查方法中,常见采用峰谷比进行系统适用性描述的,峰谷比通常在质量标准的有关物质检查中当两个峰(例如主峰与相邻杂质峰)基线无法分离时使用,限度目前没有统一规定。根据ChP2015通则0514分子排阻色谱法中的系统适用性项下的分离度公式可知,这里的分离度(R)相当于欧美药典中的峰谷比Peak-to-Valley Ratio (p/v),只是中国药典中尚没有峰谷比的概念,作者认为在ChP2020版可以考虑加入这个概念。如果在系统适用性试验中规定峰谷比,应进行详细的描述,目前还不宜直接说峰谷比。例如:杂质X的峰高(Hp,从基线至杂质X峰的最高点)与杂质X和XXX两峰之间的峰谷(Hv,从基线至两峰之间的最低点)之比(Hp/Hv)不得低于XX。
EP、USP在质量标准撰写形式、细节规定、系统适用性试验方面值得我们学习和借鉴,相信随着ChP2020等技术指导性文件的不断完善,分析方法一定能够越来越严谨、越来越科学、越来越能有好的重现性和准确性。

来源:药事纵横


