您当前的位置:检测资讯 > 监管召回
嘉峪检测网 2019-04-17 17:12
一、飞行检查的目的
《药品医疗器械飞行检查办法》自2015年9月1日起施行。原国家食品药品监督管理总局自2016年一季度实际开展医疗器械飞行检查工作。
医疗器械飞行检查,是指监管部门针对医疗器械研制、生产、经营、使用等环节开展的不预先告知的监督检查。
飞检工作围绕产品安全风险防控开展,检查组可以根据风险研判,提出风险管控预案,由实施飞检的监管部门决定具体的风险控制措施。
风险控制措施包括产品召回或者暂停研制、生产、销售、使用等。
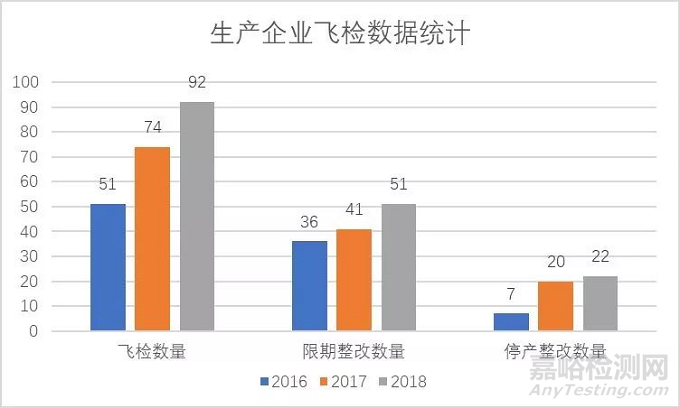
二、国家局飞行检查概况
2018年度国家药监局组织飞行检查92宗。相较于2017年度,飞检及处罚力度持续高压,22家生产企业责令停产整改,51家生产企业限期整改。
生产企业停产整改原因汇总表
|
缺陷环节 |
问题企业数量 |
|
人员管理 |
1 |
|
厂房设施 |
6 |
|
仓储管理 |
2 |
|
生产检验设备 |
5 |
|
质控文件 |
1 |
|
设计开发 |
2 |
|
采购管理 |
9 |
|
生产管理 |
10 |
|
产品检验 |
9 |
|
销售管理 |
2 |
|
不合格品控制 |
3 |
|
不良事件处理 |
1 |
三、质量管理缺陷高发环节
生产企业较易发生质量管理严重缺陷的5大环节分别是:(一)生产管理;(二)采购管理;(三)产品检验;(四)厂房设施;(五)生产检验设备。
生产管理环节常见质量管理缺陷包括:生产记录、批生产记录的真实性、完整性不能满足追溯要求;关键工序控制。
采购管理环节常见质量管理缺陷包括:质量协议、原料采购记录。
产品检验环节常见质量管理缺陷包括:检验记录真实性、完整性不能满足追溯要求;未按照产品标准检验。
洁净车间布局不合理是企业厂房设施管理中常见质量管理缺陷。
未配备必要检验设备是生产检验设备环节常见质量管理缺陷。
近年的飞检情况表明,整个行业的质量管理意识及管理水平较低。2017年以来,监管部门监管手段日益丰富,执法力度持续高压。企业应当顺应形势,强化内部管理,建立健全质量管理体系,积极防范产品安全风险。

来源:文定律师


