您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-08-07 11:51
在医疗器械研发的征程中,产品的可靠性与安全性宛如两座坚实的基石,其重要性不言而喻,因为它们直接维系着患者的生命健康,并深刻影响着治疗效果的达成。除了常规的临床使用环境外,医疗器械在高海拔地区的部署以及航空运输过程中的特殊环境亦是其生命周期中无法规避的重要场景。在此背景下,低气压试验作为环境可靠性测试体系中的关键一环,其地位凸显,作用无可替代。该试验通过科学手段精准复现高海拔地区的自然气压环境或航空运输过程中的气压变化条件,从而能够全面、系统地验证医疗器械在这类极端气压环境下,其性能参数的稳定性是否依旧卓越,功能模块的完整性是否得以保持,以及最重要的——产品整体的安全性是否仍能得到坚实保障。
进一步而言,在医疗器械走向市场的关键审评环节,低气压试验所获取的数据和结果扮演着至关重要的角色,是技术审评专家进行科学决策时的核心考量依据之一。具体来说,当医疗器械的预期使用场景明确包含高海拔地区,或者其产品特性决定了在流通环节中必须采用航空运输方式时,监管机构在技术审评过程中,通常会明确要求研发方提交该器械在低气压环境条件下进行充分性能验证的详细数据。这些数据不仅是对产品设计和制造工艺的有效检验,更是确保产品在特殊环境下安全有效应用的科学凭证,为医疗器械的安全上市和广泛应用筑起了一道坚实的技术屏障。
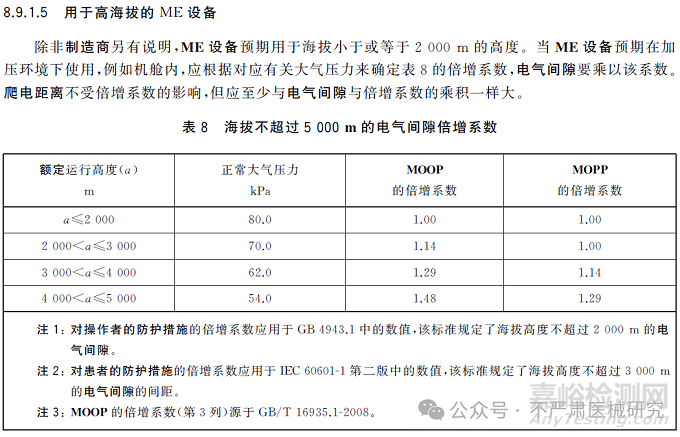
一般意义上讲,高海拔通常是指海拔2500米以上的地区。然而,在医疗器械测试中,高海拔的定义更多是基于气压条件,而非具体的海拔高度。医疗器械测试中常见的高海拔模拟范围包括海拔2500米、3000米、4000米甚至更高,以验证设备在这些极端条件下的性能。
但是需要注意一种特殊情况,对于在飞机等航空设备上使用的医疗器械,为保障乘客和机组人员的舒适与安全,民航客机会通过增压系统将座舱内气压维持在接近低海拔的水平,约为80kpa,虽然其海拔高度可能超过了4000米,但根据其实际的大气压力,其实际约等于海拔2000米左右。
在产品的研发、注册和生产环节可能都不太会注意到这么一个不起眼的条件。可能接触比较多的就是以下2种情况:

高海拔对医疗器械的影响主要体现在物理、化学及电气性能的协同变化上。这些影响可能导致医疗器械在高海拔地区无法正常工作,甚至对患者的安全和健康造成威胁。医疗器械在高海拔地区可能面临以下挑战:
对于高海拔可能带来的影响,各国的审评机构也开始针对此进行一系列的要求。FDA早在1997年发布的《医疗器械制造商设计控制指南DESIGN CONTROL GUIDANCE FOR MEDICAL DEVICE MANUFACTURERS》中就明确提出了相关要求:
“Altitudes may exceed 3,000 m, and the resultant low atmospheric pressure may adversely affect some kinds of medical equipment. If environmental conditions are fully specified, a qualified reviewer can make a determination of whether the specified conditions are representative of the intended use.”“海拔高度可能超过3000米,由此产生的低气压可能会对某些医疗设备造成不利影响。如果环境条件已完整规定,合格的审核人员可以判断规定的条件是否代表预期用途。”
NMPA审评也在最近的审评发补意见中多次提出产品在高海拔使用时需要提供的相关验证资料以及相应的风险分析。

这对于国内外制造商也敲响了警钟,之前不重视的地方现在需要重新做相应的验证。如果申报的产品预期在高原等高海拔环境下使用,那么除了要满足常规的电气安全性能测试标准之外,还必须充分考量高海拔因素对产品多方面可能产生的影响。这些影响涉及产品性能(如性能参数是否会因高海拔改变)、使用期限(是否因环境因素缩短或延长)、包装(包装在高海拔下的防护性能等是否会受影响)以及运输(运输过程中产品在高海拔环境下的稳定性等)。同时在风险管理文档中,针对产品在高海拔使用的情况,要进行细致、全面的分析。分析内容不仅仅局限于上述提到的几个方面,只要是与高海拔使用相关的潜在影响都应涵盖。并且,如果经分析发现高海拔因素确实会对产品产生影响,那么就需要提供与之对应的研究资料,用以支撑相关分析和结论。
那针对审评机构的这些要求,制造商应该采取哪些措施来应对呢?
|
|
|
|
|---|---|---|
|
|
- 操作简单:避免复杂流程,减少潜在风险。 |
- 占有率下降:可能丢失市场份额,影响销售潜力。 |
|
|
- 全面验证:便于观察实际使用性能,如设备响应和用户操作。 |
- 资源密集:需要协调时间和人力,效率较低。 |
|
|
- 灵活操作:环境参数(如气压)可部分调整,便于重复测试。 |
- 操作局限:设备体积受限,设置和即时观察不便;性能验证可能失真。 |
具体步骤和建议:
通过以上系统性的分析和验证,并提供详实的研究资料,方能有效说服审评机构对高海拔使用安全性和有效性的关切,满足合规要求。

来源:不严肃医械研究


