在2022年11月,由RDPAC 的药学团队对中美欧药学技术指导原则和指南进行了调研与对比,总结分析了中美欧指南的标准差异及实施情况差异,采用了主题词及分类方式、深度对比、报告撰写和定稿流程,最后呈现研究报告,给到药审中心参考。
随着全球同步研发理念的推进,创新药的全球申报也逐渐变得同步,符合我国新注册管理 办法全球新注册分类的申报也逐渐增多。同时,工艺验证是产品工艺生命周期中的重要环节, 充分全面的工艺验证对保障产品安全有效质量可控必不可少。我国药品相关管理法规、GMP 中产品生产工艺验证的要求,与 ICH 主要国家监管趋同。
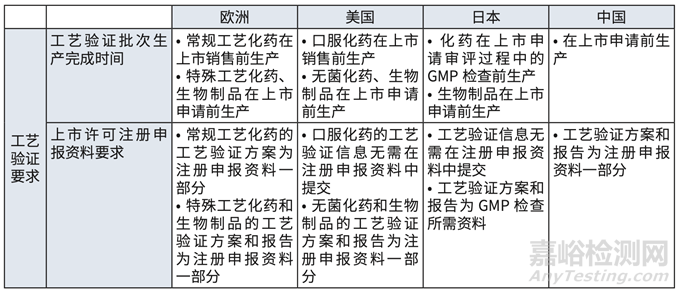
但是对比欧美日等国家及我国对工艺验证批次生产完成时间、上市许可申报资料要求等可 见,我国要求工艺验证批次的生产发生在上市申请前,工艺验证方案及报告,两者均作为注册 申报资料的一部分。工艺验证完成时间点,何时递交及递交内容等,影响了全球同步研发。
为保证境外生产药品在境内外的同步亦或首先申报和获批,建议在相关指南中,或在问与 答(Q&A)等,或在相关培训中,对在上市申请中,适当减免对于部分区域性文件(例如验证报告, 批记录等)的要求,在批准后随年报递交或在检查时重点确认。或者发布工艺验证相关管理文 件,统一不同法规中对工艺验证的要求,应用 ICHQ8-11 主要概念和引入“连续工艺验证确认” 的概念,并相应的调整递交文件的要求。
中国及欧美现行法规文件对比:
对比欧美日等国家及我国对工艺验证批次生产完成时间、上市许可申报资料要求等,我国要求工艺验证批次的生产发生在上市申请前,工艺验证方案及报告,两者均作为注册申报资料的一部分。
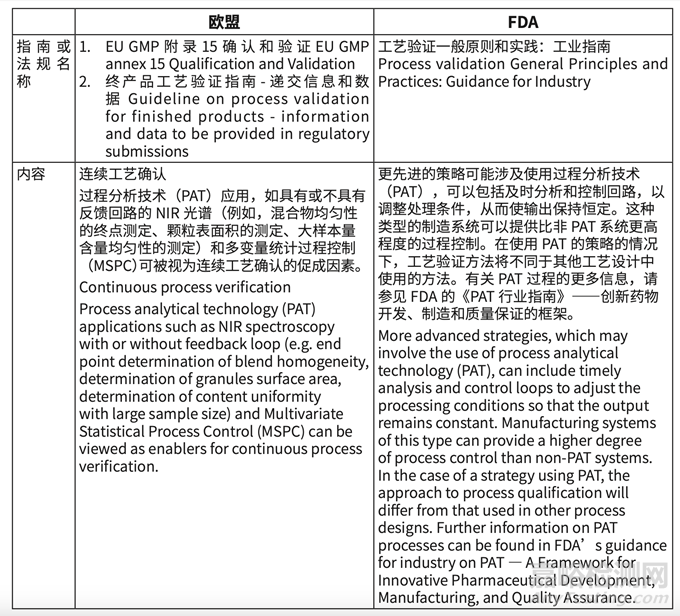
如表格 3 的指南比对的结果,中国缺少 EMA 的成品工艺验证指南 - 监管文件中提供的信 息和数据(Guideline on process validation for finished products-information and data to be provided in regulatory submissions)和生产生物技术活性物质的工艺验证和监管提交文 件 中 提 供 数 据 的 指 南(Process validation for the manufacture of biotechnology-derived active substances and data to be provided in the regulatory),所以验证信息的递交期待和原液的验证具体要求不清晰。
根据《生物制品注册受理审查指南》法规,产品上市申报时,被要求提供如工艺验证方案和报告,批记录 / 检验记录,分析方法验证报告,稳定性图谱等。但参考境外的要求,对某些产品上述部分研究并未要求开展且对审评的参考价值有限,尤其工艺验证报告。而且根据 ICH 的协调结果,目前提供的 CTD 资料,以及在模块一中递交的“生产工艺信息表”及“药 品注册标准”,已基本包含国际公认的产品上市审评所需信息。
比如,欧洲指南指出小规模研究可用于工艺验证的不同研究,并说明可以考虑小规模研究的情况(例如沥滤物和下游工艺研究等等),同时,明确提出多场地生产(Multifacility production)必须注意的原则与要求。
1. 基本概念和术语比对:
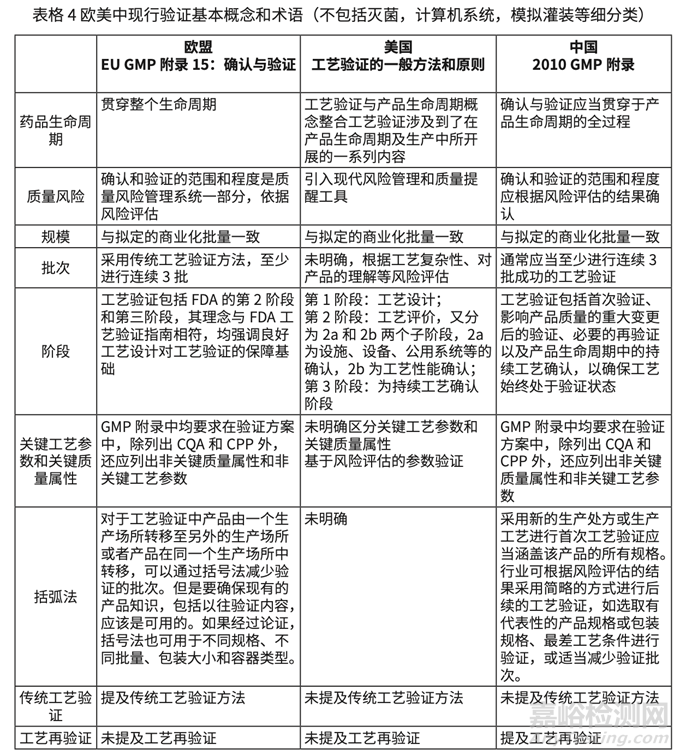
1)美国术语不同,将 Process Design 也包括在 Process validation 下,并在内容和理念上强调了各个阶段的相互关系。欧洲和中国基本理念相同,虽然都有研发设计理念(ICH Q8), 但是都没放在确认和验证概念下。在实践层面,可能欧美在研发阶段工作更全面,而我国对工艺验证(FDA 第二阶段)相对监管期待更高。
在药品全生命周期的理念及我国倡导创新的需求下,FDA 对验证三阶段的明确描述,更加值得借鉴。
2)欧洲明确提出工艺验证有传统工艺验证,连续工艺确认(Continuous process verification)和混合方式,美国没有明确提出概念以区分不同的验证方式(注美国术语 continuous process verification 与欧洲的内涵不同,是第三阶段,详见下表,但是文字描述 上也有提出了工艺验证(FDA 术语 PPQ)的不同方式,比如 PAT 的验证不同。
鉴于连续工艺确认和持续深入的研发(Q8)以及连续生产(Q13)等存在内在联系,欧洲方式更加值得借鉴。
3)欧美都明确提出了验证和 ICH Q8, 9, 10, 11 概念的一致。
2. 其他
通过比对发现我国的 GMP 附录确认和验证与 EU GMP Annex 15 高度协调但是有一些基本原则(principle 和 general 部分)没有明确表述。比如对于验证批次的问题,中欧都是基于风险至少三批,但是欧洲在工艺验证的一般原则部分明确提出可以使用括号法,并说明可以考虑 括号法的情况。具体各个部分的详细内容,见表格 4。
中国现存在的问题:
1. 尽管 NMPA 已公告推荐适用 ICH Q8~11 ,但其概念和原则尚未在验证领域中得以良好实施。比如:
1)Q8, 11 基于质量源于设计(QbD),研发阶段工作的监管期待需明确,要求需强化。
2)Q10 基于全生命周期的理念,明确研发对验证的影响以及两者之间的衔接。
3)Q9 明确基于风险的验证工作。
2. 潜在由于以上理念的实施和监管期待不明确,我国对于验证的要求倾向于一刀切,而无法基于产品和工艺的风险来进行,可能无法具有监管的灵活性。比如:
1)验证都要在注册递交前完成,而欧美低风险产品和工艺可在上市前完成。(详见表格 5)

2)批次数量基于风险可以使用括号法等(详见表格 6)
3. 我国对传统工艺验证的要求较为充分,但是替代方式(连续工艺确认,EU 概念 continuous process verification)没有描述。传统工艺验证的替代方式,主要应用于连续生产包括相关的 PAT(Process Analytical Technology)和 RTRT(Real Time Release Test)。缺乏相关指南,对我国未来新技术的应用可能产生一定影响。国外要求描述(详见表格 7)。
表格 7 连续工艺确认的概念和描述
• 制定新指南可以给工业界和监管机构带来的益处
第一、全面深入落实 ICH 的基本概念,强化产品开发阶段,强化 QbD 理念,将基于风险和全生命周期的理念真正贯穿于产品开发到验证,到验证状态的维护(FDA 的阶段一、二、三)。 从而从根本上保证了产品质量,提高了行业的质量管理水平。
第二、在此基础上,监管基于风险而具有一定灵活性成为了可能。在灵活的监管下,产业发展得到了促进,产品更快上市,利于患者及时快速稳定获得高质量的产品。依据产品类别和 生产工艺的风险情况,对工艺验证的完成时间点和递交信息,进行差异化管理,也成为了可能, 更加快速的让产品惠及患者也成为了可能。
第三、国际协调有利于产品的同步研发,同步在中国上市。同时也有利于中国行业进一步 加入国际供应链,参与国际竞争。
• 相关的国内监管法规 :
《注册管理办法》第三十四条申请人在完成支持药品上市注册的药学、药理毒理学和药物 临床试验等研究,确定质量标准,完成商业规模生产工艺验证,并做好接受药品注册核查检验 的准备后,提出药品上市许可申请,按照申报资料要求提交相关研究资料。
建议:
如果我国的工艺验证要求和监管期待与国际普遍实践存在差异,比如,全球工艺验证尚未完成,欧美已接受递交而我国递交要等到工艺验证之后,那么这将潜在影响创新药的全球同步研发,并造成全球新的创新药在我国同步上市的可能性降低,影响全球新的创新药在中国上市,惠及中国患者。所以建议出台相关文件细化以下要求:
1. 检查部门针对 ICH Q8、9、10、11 原则在工艺验证领域的落实应用,强化的研发方式 (Enhanced approach)验证的替代方法等,给与明确指导。
2. 细化监管要求。建议内容包括,基于产品类别和工艺判定风险的基本原则;依据风险 确定工艺验证完成时间和递交信息的具体要求;括号法的应用等。
3. 为保证及时将药品惠及中国患者,建议在产品上市申报及某些变更申请时,免除或优化工艺验证相关资料的申报要求。可根据需要在年报或药品现场检查时提供。或者在上市申报时要 求递交工艺验证方案,批准后按年报或按承诺时间递交报告。