今日头条
越康口服EGFR抑制剂启动III期临床。越康生物针对表皮生长因子受体外显子20插入突变(EGFR exon 20)的口服EGFR抑制剂YK-029A在clinicaltrials.gov网站上登记注册一项III期临床,计划在中国开展评估用于一线治疗晚期或转移性非小细胞肺癌(NSCLC)患者的有效性和安全性。去年9月,该新药已获得国家药监局纳入突破性治疗品种,用于治疗未经系统治疗的EGFR 20外显子插入突变晚期NSCLC患者。
国内药讯
1.拜耳口服AR抑制剂新适应症在华获批。拜耳口服雄激素受体(AR)抑制剂达罗他胺片获国家药监局批准新适应症,用于治疗转移性激素敏感性前列腺癌(mHSPC)。在关键Ⅲ期ARASENS研究中,与安慰剂联合ADT和多西他赛相比,达罗他胺联合ADT与多西他赛治疗可使mHSPC患者的死亡风险显著降低32.5%。2021年2月,该药已在中国获批用于治疗非转移性去势抵抗性前列腺癌(nmCRPC)患者,商品名为诺倍戈。
2.迈博太科EGFR单抗报产。泰州迈博太科药业西妥昔单抗生物类似药CMAB009的上市申请获国家药监局受理,与标准治疗联用一线治疗转移性结直肠癌(mCRC)患者。CMAB009是一款重组抗表皮生长因子受体(EGFR)嵌合单克隆抗体,原研产品为西妥昔单抗(礼来/默克/BMS)。原研产品使用的是小鼠骨髓瘤细胞SP2/0表达系统,而CMAB009是利用中国仓鼠卵巢细胞(CHO)表达系统。
3.和誉CSF-1R抑制剂在美获批III期临床。和誉医药创新CSF-1R抑制剂Pimicotinib(ABSK021)获FDA批准开展III期临床,评估用于治疗腱鞘巨细胞瘤(TGCT)患者的有效性和安全性。去年10月,该新药相同方案的III期临床申请已获CDE默示许可。在临床试验中,pimicotinib的总缓解率(ORR)达到68.0%。此前,该新药已获得FDA和CDE授予突破性疗法认定。
4.恒瑞ADC新药拟纳入突破性治疗品种。恒瑞医药HER2-ADC新药注射用SHR-A1811获CDE拟纳入突破性治疗品种,用于单药治疗HER2突变的晚期非小细胞肺癌(NSCLC)患者。SHR-A1811可通过与HER2表达的肿瘤细胞结合并内吞,在肿瘤细胞溶酶体内通过蛋白酶剪切释放毒素,诱导细胞周期阻滞从而诱导肿瘤细胞凋亡。此前,该新药另外两项适应症已被CDE纳入突破性治疗品种,分别用于:HER2低表达的复发或转移性乳腺癌,以及HER2阳性的复发或转移性乳腺癌。
5.北京立康mRNA肿瘤疫苗获批临床。北京立康自研1类生物制品“LK101注射液”获国家药监局临床试验默示许可,拟开发用于晚期实体瘤的治疗。LK101是一款基于新生抗原的个性化治疗性肿瘤疫苗,覆盖数十个新生抗原靶点。该疫苗利用编码肿瘤新生抗原的mRNA体外转染树突细胞(DC)疫苗,兼具mRNA疫苗和DC疫苗的优势,可以根据患者的肿瘤新生抗原信息设计个性化mRNA序列并实现快速制备。
6.闻泰GLP-1R激动剂获批I期临床。闻泰医药1类化药VCT220获国家药监局批准开展I期临床,临床适应症为成人超重/肥胖患者的体重管理。VCT220是一款口服小分子GLP-1R激动剂,已在I期健康受试者研究中显示出优良的药物性质和良好的安全耐受性。闻泰医药计划开发VCT220用于治疗2型糖尿病、肥胖或超重、非酒精性脂肪肝炎等疾病。
7.海思科EGFR靶向PROTAC获批临床。海思科1类化药HSK40118片获国家药监局批准开展临床试验,拟用于治疗不可手术的、携带表皮生长因子受体(EGFR)突变的晚期非小细胞肺癌(NSCLC)患者。这是全球首款申报临床的EGFR靶向PROTAC药物,也是海思科开发的第二个PROTAC抗肿瘤药物,临床前研究显示,HSK40118在体外对突变型EGFR蛋白具有良好的抑制以及降解活性,对EGFR L858R-T790M双突变、ex19del(或L858R)-T790M-C797S三突变体内移植瘤的生长具有显著的抑制效果。
8.先声TNFR2单抗联合K药开展临床。先声药业旗下先声再明TNFR2单抗SIM0235拟联合默沙东PD-1抗体KEYTRUDA®(帕博利珠单抗)开展I期临床(SIM1811-03-TNFR2-102)研究,评估联合用药治疗晚期实体瘤及皮肤T细胞淋巴瘤(CTCL)的安全性、疗效、药代动力学/药效学特征以及免疫原性。在临床前研究中,SIM0235与KEYTRUDA联用已显示出协同抗肿瘤的治疗潜力,有望为肿瘤患者带来临床获益。
国际药讯
1.抗炎疗法特应性皮炎Ⅲ期试验成功。Dermavant公司芳香烃受体调节剂Vtama(tapinarof,1%)乳膏治疗两岁以上孩童与成人特应性皮炎患者的Ⅲ期试验(ADORING 2)达到主要终点和关键次要终点。与安慰剂相比,Vtama治疗第8周时显著改善患者vIGA-AD评分,达成“清除”(分数=0)或“几乎清除”(分数=1),且较基线至少有2个级别改善(P<0.0001)的患者比例更多;湿疹面积和严重程度指数改善75%的患者比例也更多(P<0.0001)。
2.Mediar公司融资推进FIC抗纤维化疗法开发。Mediar公司宣布完成1.05亿美元融资,其中包含来自诺华、辉瑞、百时美施贵宝和礼来等多家药企支持的8500万美元A轮融资。Mediar致力于开发靶向驱动疾病进展的纤维化介质的创新抗体,其主导项目是靶向WNT1诱导信号通道蛋白1(WISP-1)的抗体。此轮融资将用于推进其WISP-1抗体以及另一项尚未公布靶点的潜在“first-in-class”项目于2024年进入临床。
3.小核酸药物公司完成A轮融资。小核酸药物公司Switch Therapeutics获得5200万美元的A轮融资。本轮融资由Insight Partners和UCB Ventures共同领投,现有投资者提供额外资金,包括新投资者礼来、Ono Venture Investment、Digitalis Ventures等。所获资金将用于推进Switch治疗CNS疾病的先导项目开发,以及其CASi平台扩展到新的领域。CASi平台在单个分子中结合单链和双链RNA的优势特性,允许细胞选择性RNAi激活,以及高效的自我递送和吸收,起效和持久的基因消除。
4.FDA要求ED处方药提供非临床数据。Futura Medical公司硝酸甘油透皮凝胶制剂MED3000用于治疗勃起功能障碍(ED)的De Novo申请(医疗器械申请途径)收到FDA审查意见,FDA要求其提交MED3000的非临床试验数据。在III期临床(FM71)中,MED3000可在10分钟起效,并在治疗24周时,显著改善患者的勃起功能(p<0.001),其IIEF-EF评分平均提高5.73个单位。如果获批,MED3000将成为首个且主要用于治疗ED的非处方药(OTC)。
5.诺华拟削减眼科业务。彭博社14日发布的一份报告显示,诺华正在削减其眼科业务,并出售部分资产,以专注于增长领域。待售资产包括滴眼液Xiidra (lifitegrast眼科溶液),这是一种用于干眼病的淋巴细胞功能相关抗原-1拮抗剂。2019年5月,诺华以34亿美元的预付款和19亿美元的里程碑付款从武田买下Xiidra。诺华将保留Lucentis (ranibizumab),这是诺华从罗氏/基因泰克获得的治疗湿性AMD的药物。Lucentis的总销售额在2022年超过18亿美元。
6.诺和诺德胰岛素类药物降价75%。3月14日,诺和诺德宣布将在美国大幅降低胰岛素类药物的价格,其中NovoLog和NovoLog Mix 70/30产品价格下调75%,Novolin和Levemir的价格则将下调65%。诺和诺德还表示,将会降低预充填胰岛素笔、长效和短效胰岛素瓶以及混合胰岛素产品的价格,以使其与各自的胰岛素产品价格相匹配。降价计划将于2024年1月1日生效。
医药热点
1.日本团队开始构建新冠后遗症数据库。日本国立精神・神经医疗研究中心等的研究团队近日开始构建新冠病毒感染症后遗症管理信息数据库。研究团队关注抑郁、不安、失眠、注意力减弱等精神性症状。力争收集约1000名患者的数据,包括没有后遗症的人在内。该团队将分析血液检测、脑部影像、病情发展等的数据,探索发病原因和治疗方法。
2.西安多个核酸亭新增甲乙流检测服务。近日,西安多个核酸检测亭新增甲乙流检测服务。近期做检测的人较多,大多为儿童、青少年,甲乙流检测为单管检测,一般12个小时内会出检测报告,可在小程序内直接查看。除了人工检测亭,还有甲流检测测试剂自助售卖机,价格为59元,自行检测后需将样本归还至自助机内,12至24个小时出结果。
3.北京协和医院建立儿童肥胖管理新模式。近日,北京协和医院内分泌科黎明教授团队项目“儿童青少年肥胖不同代谢类型的精准识别和预警新体系的建立及应用”荣获2021年度北京市科技进步二等奖。十五年来,项目团队建立了国际珍稀的儿童肥胖代谢异常队列,首次在中国肥胖儿童中开展不同代谢类型的精准识别和预警研究并形成系列研究成果,参与国内外指南共识制定,积极探索创新成果转化和应用,为推动中国儿童肥胖的精准管理新模式作出了积极贡献。
评审动态
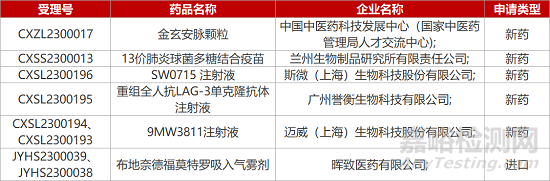
1. CDE新药受理情况(03月16日)
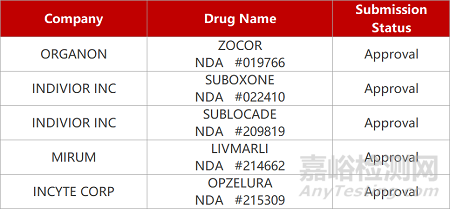
2. FDA新药获批情况(北美03月14日)