今日头条
信立泰ETA受体拮抗剂获批临床。信立泰自主研发的小分子ETA受体拮抗剂SAL0120片的临床试验申请获CDE受理,拟开发适应症包括轻、中度原发性高血压。SAL0120是通过选择性拮抗ETA受体,在现有用药基础上达到进一步降低血压的目的。目前,国内外尚无以原发性高血压为适应症的ETA受体拮抗剂上市销售。SAL0120有望为原发性高血压患者提供全新机制的降压药物。
国内药讯
1.国产带状疱疹减毒活疫苗获批上市。百克生物的带状疱疹减毒活疫苗获国家药监局批准上市,这是国内首款获批的带状疱疹减毒活疫苗,适用于40岁及以上成人预防带状疱疹及其并发症疱疹后神经痛。据估计,2030年中国带状疱疹疫苗市场规模将达到560亿元,临床需求巨大;百克带状疱疹疫苗将与葛兰素史克重组带状疱疹疫苗Shingrix进一步争夺国内市场。
2.恒瑞干眼症1类新药报产。恒瑞医药从Novaliq GmbH公司引进的SHR8058滴眼液上市申请获国家药监局受理,用于治疗睑板腺功能障碍相关干眼病。SHR8058由100%全氟己基辛烷组成,能迅速扩散至整个眼表,并与泪膜的亲脂部分相互作用,覆盖在泪膜水液层表面,稳定泪膜、防止泪液过度蒸发。在Ⅲ期临床(SHR8058-301)中,与安慰剂相比,SHR8058显著改善患者的干眼病症状和体征;且该滴眼液安全可靠,局部耐受性好。
3.罗氏CD20/CD3双抗在华报产。罗氏格罗菲妥单抗(Glofitamab)的上市申请获NMPA受理。Glofitamab是一款2:1型CD20/CD3靶向的T细胞双特异性抗体,旨在引导T细胞参与并消除恶性B细胞。在II期NP30179扩展研究中,Glofitamab用于弥漫性大B细胞淋巴瘤(DLBCL)的治疗达到完全缓解(CR)率为39.4%,总体缓解率ORR为51.6%。此前,Glofitamab已被CDE纳入优先审评,拟用于治疗复发或难治性DLBCL和原发性纵隔大B细胞淋巴瘤患者。
4.海创口服AR PROTAC在美获批临床。海创药业自主研发的PROTAC药物HP518获FDA批准,即将在美国开展用于治疗转移性去势抵抗性前列腺癌(mCRPC)的临床试验。HP518对野生型AR和恩扎卢胺耐药的变异AR具有高降解活性,并对AR依赖的前列腺癌的细胞系具有优异的抑癌活性。目前,该新药正在澳大利亚开展一项I期临床,评估在mCRPC患者中的安全性与有效性。
5.君实降血脂siRNA疗法报IND。君实生物1类化药JS401注射液的临床试验申请获CDE受理,拟用于治疗混合型高脂血症。JS401是该公司专有siRNA技术平台开发的首个siRNA药物,可长期有效针对混合型高脂血症(具体未披露),有效降低靶点表达,抑制靶标蛋白。今年1月,君实生物公开了PCSK9 siRNA、ANGPTL3 siRNA专利。根据公开资料,推测JS401为ANGPTL3 siRNA。
国际药讯
1.伊立替康脂质体联合用药Ⅲ期临床积极。益普生在ASCO-GI2023会议上公布伊立替康脂质体注射剂Onivyde联合NALIRIFOX化疗方案(包含5-氟尿嘧啶/亚叶酸钙、奥沙利铂)一线治疗转移性胰腺导管腺癌(mPDAC)的Ⅲ期临床(NAPOLI 3)积极结果。在中位随访16.1个月时,NALIRIFOX化疗方案与活性对照组(吉西他滨与白蛋白紫杉醇组合疗法)相比,患者的总生存期显著提高(11.1个月vs9.2个月,p=0.04),无进展生存期达到7.4个月(vs5.6个月,p=0.0001),而且NALIRIFOX方案的安全性可控。
2.心脏病基因疗法早期临床积极。XyloCor公司基因疗法XC001治疗顽固性心绞痛的Ⅰ/Ⅱ期临床结果积极。XC001旨在在心脏中特异性表达能够促进血管增生的血管内皮生长因子(VEGF),从而促进心脏的血管生成。6个月的治疗数据显示,患者的缺血性症状显著降低,几乎半数受试者能够在不产生心绞痛的情形下进行日常运动,没有发现任何与药物相关的安全性问题。
3.UniQure引进一款渐冻症基因疗法。UniQure公司与Apic Bio公司就后者临床早期肌萎缩侧索硬化(ALS)基因疗法APB-102达成合作许可协议。APB-102是由重组腺相关病毒载体AAVrh10表达能对SOD1进行基因敲低的微RNA(miRNA)所组成,已获得FDA批准可开展I/II期临床试验。根据协议,UniQure将获得APB-102的全球开发与商业化权益;Apic Bio将获得1000万美元的预付款,最多达4500万美元的潜在里程碑付款。
4.DLL3靶向CAR-T临床前研究积极。Allogene Therapeutics公司基于单链可变片段(scFv)开发的靶向DLL3的同种异体CAR-T疗法ALLO-213在针对小细胞肺癌(SCLC)的临床前研究中获积极结果。DLL3在肿瘤上高表达、在正常组织中表达有限,是SCLC和其他潜在实体瘤的有希望的靶标。临床前研究结果显示,ALLO-213能控制小鼠模型体内DLL3+肿瘤的生长,并且没有正常组织毒性。
5.礼来Aβ单抗被FDA拒批。礼来制药Aβ单抗Donanemab注射液用于治疗早期症状性阿尔茨海默病(包括阿尔茨海默病所致的轻度认知障碍以及轻度阿尔茨海默病)的加速上市的申请收到FDA发送的完整回复函(CRL)。FDA表示:递交上市申请所基于的临床试验中,接受至少12个月药物治疗的患者数量有限(至少为100名)。除此之外,FDA在完整回复函中未提及其它缺陷。
6.辉瑞2022年总收入1003亿美元。辉瑞公布2022年财务报表,全年总营收创历史新高,达到1003.3亿美元,同比增长23%,成为全球首个年收入超千亿美元的制药企业。其中新冠疫苗Comirnaty和口服新冠药物Paxlovid在2022年实现了567.39亿美元的销售收入,其他产品包括Eliquis(阿哌沙班,64.80亿美元,+9%)、Prevnar family(63.37亿美元,+20%)、Vyndaqel/Vyndamax(24.47亿美元,+21%)、Inlyta(阿昔替尼,10.03亿美元)、Xtandi(恩扎卢胺,11.98亿美元,+1%)等业绩也耀眼。
医药热点
1.WHO宣布维持新冠全球紧急状态。世卫组织30日发表声明,宣布尽管新冠大流行可能正接近转折点,但目前仍构成“国际关注的突发公共卫生事件”。因为与其他呼吸道传染病相比,新冠导致的死亡人数仍然很高,且中低收入国家以及全球高风险群体的疫苗覆盖率仍显不足,在是否会出现新变种病毒方面仍有不确定性。世卫组织紧急委员会呼吁采取长期公共卫生行动,优先降低新冠发病率和死亡率。
2.国家骨科医学中心在积水潭医院挂牌成立。1月28日,国家骨科医学中心在北京积水潭医院挂牌成立,将建设成为国际一流骨科临床诊疗中心和世界前沿的科技创新中心。国家骨科医学中心以北京积水潭医院、上海市第六人民医院为主体,形成南北协同、优势互补的模式,建立多中心协同工作机制,带动全国骨科领域的建设与高质量发展。
3.先声药业新冠药750元/盒。1月30日,北京市医保局发布《新冠治疗药品先诺特韦片/利托那韦片组合包装首发报价公示》,显示海南先声药业新冠口服药先诺特韦(20 片 *375 mg)/利托那韦(10 片 *100 mg)组合包装(商品名为先诺欣®)的首发报价为 750元,计价单位为盒/疗程。附件显示,首发报价对照药品主要为奈玛特韦片/利托那韦片(Paxlovid)、莫诺拉韦胶囊(利卓瑞)和阿兹夫定片。在「疗程费用比」信息栏中显示,奈玛特韦片/利托那韦片价格为1890元/疗程,莫诺拉韦胶囊(利卓瑞)价格为1500元/疗程,阿兹夫定片平均445元/疗程,其中医保纳入后为350元/疗程。
评审动态
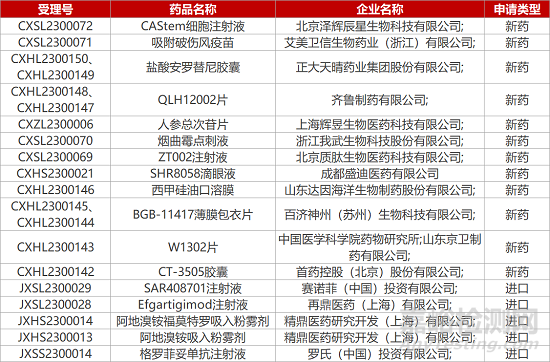
1. CDE新药受理情况(02月01日)
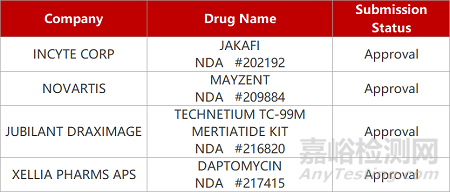
2. FDA新药获批情况(北美01月31日)