您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-11-24 10:47
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
亚盛EED抑制剂贫血适应症报IND。亚盛医药1类化药胚胎外胚层发育蛋白(EED)抑制剂APG-5918的临床试验申请获CDE受理,拟用于非肿瘤领域治疗贫血相关疾病。APG-5918可与H3K27me3竞争结合EED蛋白,抑制PRC2复合物的甲基转移酶活性,解除对血红蛋白基因的转录抑制,从而对贫血疾病产生疗效。APG-5918也是首个进入临床阶段的中国原研EED抑制剂,正在中美同步开展用于治疗晚期实体瘤或血液系统恶性肿瘤的临床研究。
国内药讯
1.罗氏改良型玛巴洛沙韦在华报产。罗氏与盐野义制药开发的单剂流感口服药玛巴洛沙韦干混悬剂的上市申请获CDE受理。玛巴洛沙韦是一款具有创新作用机制的帽状结构依赖性核酸内切酶抑制剂,通过抑制流感病毒中的cap依赖型核酸内切酶,来起到抑制病毒复制的作用。2021年4月,玛巴洛沙韦片在中国获批上市,用于治疗12周岁及以上急性无并发症的流感患者。此次该产品干混悬剂在中国申报上市,意味着它有望为患者带来更多治疗选择。
2.武汉滨会HSV2溶瘤病毒获批临床。滨会生物溶瘤病毒BS006注射液获FDA临床许可。BS006是一款表达双特异性抗体的新型溶瘤病毒,重组后的Ⅱ型单纯疱疹病毒(HSV2)表达PD-L1/CD3-BsAb分子。临床前研究显示,溶瘤病毒可将淋巴细胞募集到肿瘤微环境中,为PD-L1/CD3-BsAb提供更多的靶细胞;同时,PD-L1/CD3-BsAb可结合到旁观者T细胞上,使其成为杀伤肿瘤的T细胞。
3.嘉晨西海又一款mRNA疫苗获批临床。嘉晨西海新型mRNA疫苗JCXH-221获FDA临床许可。JCXH-221是一种脂质纳米颗粒(LNP)复合的广泛保护性mRNA疫苗,可对抗SARS-CoV-2感染和疾病。嘉晨西海将在健康成人受试者中开展评估JCXH-221的安全性和免疫原性的Ⅰ/Ⅱ期临床。今年3月及本月初,嘉晨西海1类新药自复制mRNA癌症药物JCXH-211已分别获得FDA及NMPA的临床批件。
4.奥赛康PD-1/IL-15双功能融合蛋白报IND。奥赛康子公司AskGene申报的注射用ASKG915的临床试验申请获FDA受理。ASKG915是奥赛康具有自主知识产权的一款PD-1/IL-15双功能融合蛋白,可通过PD-1抗体实现肿瘤靶向性,并在肿瘤部位被局部激活。临床前数据显示,ASKG915具有良好的抗肿瘤活性,疗效显著优于PD-1单药疗法,同时安全性良好,治疗窗显著优于传统细胞因子类药物。
5.捷思英达在波士顿成立合资公司。捷思英达与美国Strategia Holdings LLC签署协议,在美国波士顿创建JSI Ventures Inc.(JSV),全面整合捷思英达和Strategia公司管理团队和新药研发项目。Strategia公司创始人Keizo Koya博士出任新公司JSV的总经理,并加入捷思英达董事会。此次交易全面提升捷思英达在美国临床开发、转化医学研究和国际商务拓展的能力。
6.瑞科9价HPV疫苗年产能扩至2000万剂。瑞科生物宣布,经产业化升级和验证,该公司HPV疫苗产业化基地首期峰值产能将提高至年产重组九价HPV疫苗2000万剂。该产业化基地建设得到了世卫组织专家的技术指导,建成后将满足中国药品GMP和世卫组织预认证体系要求,有望为全球提供九价HPV疫苗。目前,瑞科生物九价HPV疫苗REC603正处于III期临床开发阶段。国内尚无国产九价HPV疫苗获批上市。
国际药讯
医药热点
1.第三批抗癌和罕见病药品可享增值税优惠。为鼓励制药产业发展,财政部、海关总署、国家税务总局、国家药品监督管理局日前发布公告,发布第三批适用增值税政策的抗癌药品和罕见病药品清单。第三批清单包括51个抗癌药品制剂和原料药、20个罕见病药品制剂和原料药。根据公告,自2022年12月1日起,对清单中的药品,国内环节可选择按3%简易办法计征增值税,进口环节减按3%征收增值税。
2.山东患者安全管理协会成立。近日,由山东第一医科大学附属省立医院等医疗机构共同发起的山东省患者安全管理协会正式成立。这是全国首家以维护患者安全为宗旨的社团组织,旨在进一步探索完善术前司法见证、中立评估和诉前调解等工作模式,通过诉前调解有效降低医疗领域的诉讼增量,通过引入慈善救助拓宽救济渠道,从而实现“让患者就医不再无助,让医生执业更有尊严,让医疗风险总体可控,让医患关系更加和谐”的美好愿景目标。
3.上海市加强来沪返沪人员健康管理。上海市疫情防控工作领导小组办公室发布进一步加强来沪返沪人员健康管理的工作措施,自2022年11月24日零时起实施。其中明确来沪返沪人员抵沪不满5天者,不得进入餐饮服务(含酒吧)、购物中心(含百货店)、超市卖场、菜市场、美容美发、洗(足)浴、室内健身、歌舞娱乐、游艺厅、网吧、密室剧本杀、棋牌室等公共场所。所有抵沪人员在落实现有“落地检”“三天三检”等要求的基础上,第5天进行1次核酸检测,核酸检测结果为阴性的,“随申码”“场所码”展示页面取消标记提示。
评审动态
1. CDE新药受理情况(11月23日)

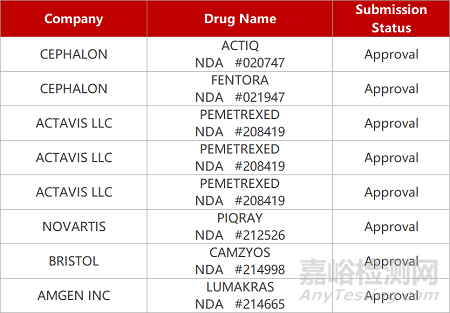

来源:药研发


