您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-09-14 16:37
溶出试验是药物开发和常规制剂质量控制中应用最为广泛的体外性能试验之一,它可以监测药物制剂体外释放的速率与程度(批溶出试验),确保药物体内外释放性能一致[1,2]。20世纪70年代美国药典对标准溶出仪的描述和90年代末FDA颁布的指导原则,进一步推动了溶出试验在药物开发各个阶段的广泛应用[3]。1995年生物药剂学分类系统(BCS)[4]的引入提供了一种简单但可靠的方法来机械地描述药物的生物药剂学行为,在这一体系下,药物根据其溶解度和通透性进行分类。这些参数可以用来预测吸收剂量的比例,从而预测其成为药品的可能性。当USP仪器1和2被引入药典和FDA指南时,大多数正在开发的分子呈现良好的水溶解度(BCS I类和III类),固体剂型(胶囊和片剂)是最常见的[5]。因此,建立具有体内相关性的体外溶出条件相当简单。但如今药物开发方案已经深入到分子实体,越来越多的低水溶性(BCS II和IV类)的药物被开发。尽管这些药物通过作用于新的分子靶点增强了许多治疗方案,但它们也提出了新的处方和工艺开发挑战,特别是关于以前传统的体外性能测试方法的生物检测能力[6]。另外,近年来政府监管政策发生变化,引入质量源于设计(QBD)概念,促进了溶出方法学的进步,将制剂的质量标准与其在患者使用中的性能以及最终的治疗结果联系在一起。所以,需要在溶出度测试领域取得进展(例如,开发生物相关和生理相关的溶出介质和溶出仪),以解决传统方法的不足,本文将着重介绍生物相关性溶出介质的应用情况[7–10]。
物理化学特征
生物相关性溶出介质,是指具有与人体内同样生理条件的溶出介质,包括模拟胃肠环境,流体动力学特征和药物的物理化学参数,预测血药浓度和开发体内外相关性[11]。胃肠环境的模拟是充分预测药物制剂体内行为的必要条件。体外溶出实验预筛选制剂有利于减少评价药物在空腹、餐后BE试验所需的受试者例数。在药代动力学研究中,选择体外测试的合适介质,对于正确预测食物效应是至关重要的。
表1和表2分别展示了空腹和餐后状态下人体胃肠道(胃、十二指肠、空肠)的理化特征参数范围,其中n代表了研究数目,根据每个研究中发现的理化特征平均值的标准偏差,计算了每个物理化学特征的规定范围。
表1:人体空腹状态下胃肠道的物理化学特征
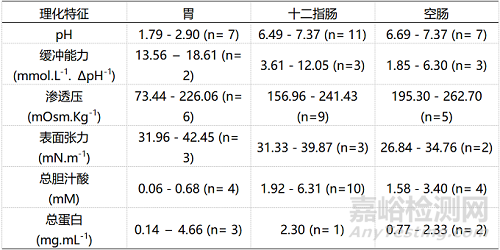
表2:人体餐后状态下胃肠道的物理化学特征
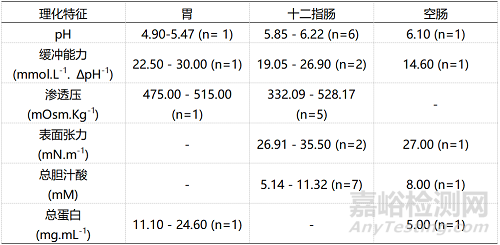
在溶出实验中,药典记录的模拟胃肠道的溶出介质最为常用,主要是模拟空腹状态的胃部模拟液(pH1.2盐酸溶液)和肠道模拟液(pH6.8磷酸盐溶液)。表3和表4分别展示了空腹状态下人体胃肠道溶液、生物相关性溶出介质和药典记录介质的理化特征对比情况,表5和表6则展示出餐后状态生物相关性溶出介质和真实胃肠液的理化特征对比情况。
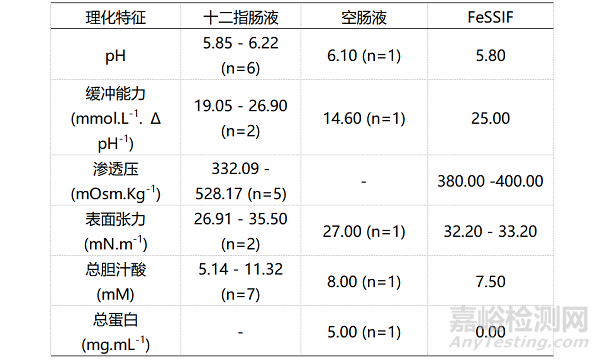
表3:空腹状态下人体胃液、胃部模拟液FaSSGF(空腹胃液)和药典记录介质物理化学特征的对比
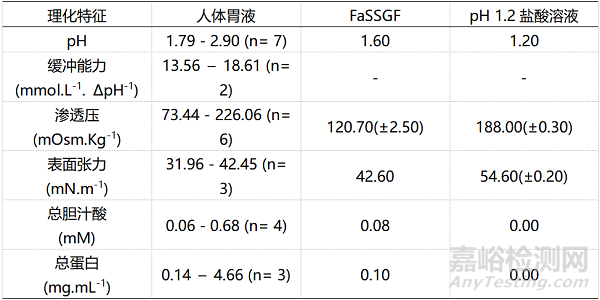
表4:空腹状态下人体十二指肠液、空肠液、肠道模拟液FaSSIF(空腹小肠液)和药典规定介质物理化学特征的对比
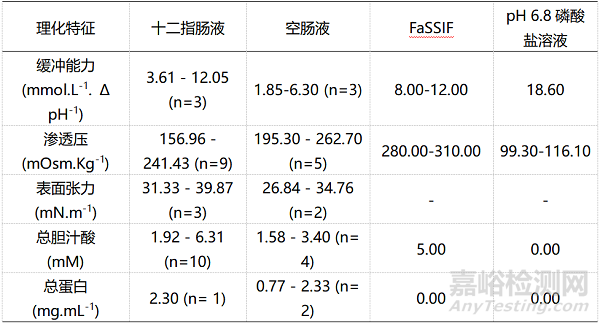
表5:餐后状态下人体胃液和胃部模拟液FeSSGF(餐后胃液)物理化学特征的对比
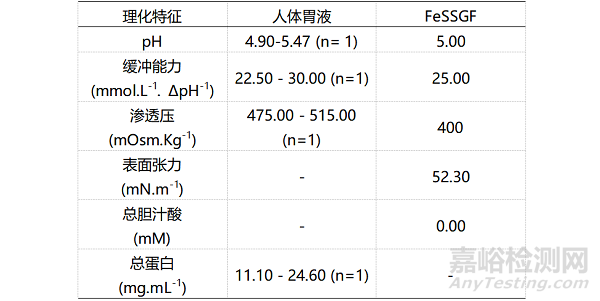
表6:餐后状态下人体十二指肠液、空肠液、肠道模拟液FeSSIF(餐后小肠液)和药典规定介质物理化学特征的对比
通过对比不同情况(空腹、餐后)下不同类型(真实溶液、模拟液:生物相关性溶出介质和药典介质)溶液的物理化学特征,可以看到生物相关性溶出介质在模拟胃肠道溶液中的巨大优势。
实际应用
预测药物的体内释放行为
药典中规定的盐酸和磷酸盐等模拟体内胃肠道的溶液只是提高了与胃肠道相关的pH条件,因为不含人体肠道中的胆酸盐、卵磷脂等成分,所以药物在此介质条件下的释放并不具备体内相关性。药典除了对胃肠道模拟溶液进行规定之外,还针对绝大部分固体药物的溶出条件提供了建议。对于溶解性较低的药物,药典规定下的溶出介质会添加一定的表面活性剂,但也正是因为表面活性剂的存在,药物制剂在该溶出条件会快速释放,溶出曲线大多数情况下都是没有体内预测力的,这时就需要生物相关性溶出介质来模拟体内情况,预测药物体内真实的释放曲线。
因为BCS II类药物的溶解/溶出是吸收的限制步骤,因此可以使用生物相关溶出实验来预测不同制剂和给药条件之间的生物利用度差异。以Danazol(达那唑)胶囊剂(BCS Ⅱ类)为例,研究者对其进行了体外溶出研究,使用的介质分为别纯水、FaSSIF(餐前小肠液)、FeSSIF(餐后小肠液)、磷酸盐溶液(pH6.5)。Danazol(达那唑)在该四种介质中的溶出速度结果为FeSSIF>FaSSIF >磷酸盐溶液=纯水,因为在磷酸盐溶液和纯水中不含胆酸盐,所以药物无释放。而药物在餐后模拟液中由于其更高的胆酸盐浓度,所以其溶出较高,提示我们该药物餐后的吸收会增加,生物利用度提高[11],与其人体研究结果一致[12]。因此,FeSSIF(餐后小肠液)可能是对Danazol药物溶出评估的替代方法,因为体外结果有着很好的预测能力。
类似的药物还有Ketoconazole酮康唑,Atovaquone阿托伐醌,Troglitazone曲格列酮和Nifedipine硝苯地平等BCS Ⅱ类药物[13,14],使用生物相关性溶出介质可以很好的预测它们的体内情况和食物影响。
帮助开发满足生物等效性的体外安全溶出区间
体内外相关性是指将药物制剂的体外测量结果与其体内响应建立联系,主要是将制剂的物理化学测定行为(体外溶出)与其产生的生物学特性(Cmax、AUC)关联。如果可以建立很好的体内外相关性(Level-A),则可以免除特定药物的生物等效性研究。因为BCS Ⅱ类和Ⅳ类低溶解性的特点,构建体内外相关性(in vitro-in vivo correlation,IVIVC)的可能性较大(但A级相关较难构建),但对于BCS Ⅰ类和Ⅲ类药物的肠道通透性影响使其建立IVIVC的可能性较小。所以尽管该方法可以通过药物的体外溶出结果对体内行为进行预测,但仍需考虑到大部分情况下都没有办法建立有效的IVIVC进行生物豁免,这时可以使用生物相关性溶出介质和适当的溶出设备来模拟药物在体内可能的释放情况。一方面,结合生理药动学模型和药物的体外溶出,构建一个与临床相关的体外溶出安全区间;另一方面,为药物的生物豁免提供基础。
案例:Ribociclib[15]瑞博西尼
Ribociclib瑞博西尼,一种弱碱性口服片剂,由于较低的溶解性(药典介质中)和生物利用度,被划分为BCS Ⅳ类药物(低溶解性、低通透性)。但该药物在生物相关性溶出介质中的溶解性均>2.4mg/mL(pH2,2.4mg/mL;pH6.5,2.4mg/mL,单次使用最高剂量为600mg,所以推测其在人体胃肠道中的溶解性较高,根据PBPK模型(见后注释1)参数敏感性分析(图1),其在体内的吸收主要受药物通透性的影响,所以其属于通透性限速药物。
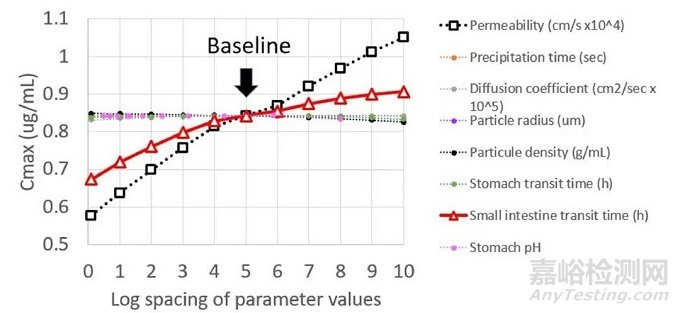
图1:多种生理参数变化对Ribociclib体内暴露量的影响
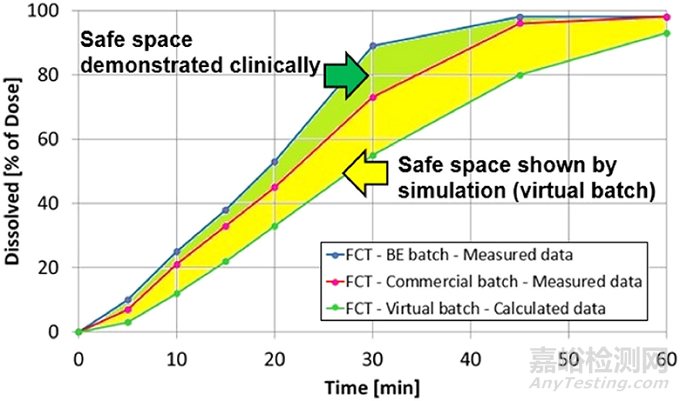
图2:Ribociclib体外溶出的等效区间
Caco-2细胞模型
Caco-2细胞模型是用于评价药物肠道通透性和吸收的重要手段,最常用的方法是使用类似Hanks平衡盐溶液(HBSS)的缓冲液来测量通过Caco-2细胞单层的化合物通量[16]。然而,亲脂性药物在这些类型的缓冲液中很难溶解或根本不溶,它们通常会吸附在Transwell板上。为了减少吸附和增加溶解度,需要在亲脂化合物的经典条件之外的条件下开发渗透性分析。所以,研究者使用生物相关性溶出介质开发新的方法。在Transwell小室的A端使用空腹状态肠道模拟液(FaSSIF),在B端采用添加1%牛血清白蛋白(BSA)的HBSS溶液,该方法是提高脂溶性化合物回收率的最佳模型。LinaFossati使用该模型选取了35个化合物进行通透性实验,在采用生物相关性溶出介质的Caco-2细胞模型分析中只观察到2个异常值。这两个异常值与经典的Caco-2方法观察到的异常值是相同的[17]。此外,该方法还可以考察分析药物的主动转运情况,因为所有被测试的活性转运化合物都给出了两种方法的通透性结果,这些化合物的通透性结果与人体吸收分数有着更好的相关性。
制剂质量标准的制定
近年来,美国FDA一直在强调以病人为中心的药品质量标准和临床相关的药品说明书使用,而建立体内外相关性是以病人为中心的质量标准的重要一步。PBBM模型由于近年来在支撑药品质量标准制定领域使用的增加[18-21],人们对这一PBPK模型分支的兴趣渐长。构建临床相关的溶出方法是构建PBBM模型的关键,这种体内-体外的联系有助于构建生物等效性的安全区间,并建立临床相关的药品产品规范,临床相关的溶出度规范是“考虑溶出度变化的临床效果,确保药物产品一致的安全性和有效性的规范”。
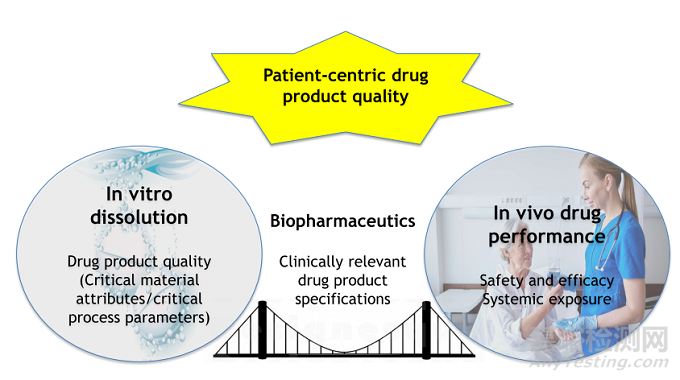
图3:PBBM模型构建的简单架构
建立体外-体内的联系有助于开发临床相关的药物产品说明书和建立以患者为中心的质量标准。传统上,这种联系是通过(IVIVC)或(IVIVR)方法建立的。该方法建立了一个数学模型,可以预测药物的体外特性(通常是药物的溶出或释放)与体内反应(如血浆药物浓度或药物吸收量)之间的关系,而不需要对药物的吸收或PK特性进行机械描述[22]。然而,由于知识和资源方面的障碍以及进行人体试验的伦理考虑,通常这种建立体外和体内之间联系的传统方法被认为是具有挑战性的。此外,据报告使用这种方法,监管机构对该模式的接受率很低(约40%)[23,24]。
PBBM最吸引人的用途之一是它可用于将体外药物产品属性(例如溶出度和/或粒径)与体内特性(例如PK性能)联系起来。为了实现这一目标,可能的途径之一是利用体外溶出数据作为输入来预测药物吸收动力学,建立生物相关性溶出方法。而近年来,生物相关性溶出介质在模拟体内情况的不断进步[25],对利用体外溶出数据来定量预测药物吸收提供了有力帮助。在PBBM方法中,机械性胃肠道吸收和处置动力学的理解和体内吸收暴露量的模拟被用来估计体内溶出。一旦可以确定体内溶出曲线,利用对原料药的生理特性和药物产品关键生物利用度属性的透彻理解,就可以制定适当的体外溶出条件,以便在体外溶出与体内溶出和吸收之间建立联系。
一旦建立了能够预测PK曲线的生理相关性溶出/释放的试验条件,那么体外试验的方法就可以用来预测给药后的体内吸收情况,并建立临床相关的溶出规范标准。如果用体外溶出/释放法建立体内外联系,那么溶出/释放法对关键生理利用度属性具有鉴别能力是很重要的;因此,可以从通过改变药物关键质量属性获得不同的溶出曲线,并可以建立临床相关的药品说明书。
如果使用生物相关性溶出介质开发的体内-体外联系的溶出方法已经确立,那么该方法就有望用于药品的质量控制。此前,FDA建议仅使用一种溶出方法用于药品质量控制和其他监管目的,例如生物豁免或人体桥接实验。然而,根据FDA的指导草案,如果生理相关性溶出方法过于复杂,不能用于常规质量控制的话,则使用常规质量控制溶出测试。这表明,美国FDA愿意接受一种药物产品的多种溶出方法。虽然在药物产品开发的过程中会伴随着简单的质量控制方法开发,但除了常规药典方法,在生理相关性溶出方法基础上构建的PBBM模型的模式,不仅可以帮助预测药品的体内吸收情况,还可以为生物豁免提供依据。
生物相关性溶出介质在药物产品开发、体内吸收预测和质量标准制定等方面的成功应用已经证明了其价值,现也获得了监管机构的重视,相信未来该产品的使用会越来越普及和规范化。
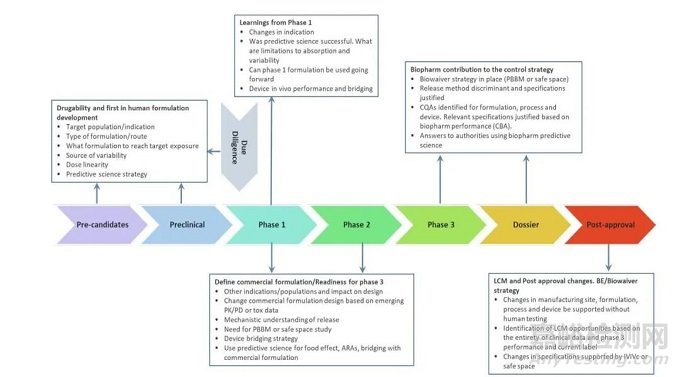
图4:PBBM模型在药品开发过程中的应用
【注释】
1,PBPK:Physiologicallybasedpharmacokinetic,生理药代动力学模型,涵盖基于生理模型的“所有”应用,建立各个器官与血浆药物浓度的定量关系,实现对全身各组织器官中药物浓度的动态描述。
2,PBBM:Physiologicallybased biopharmaceutics model,生物药剂学模型,为了区分描述药物组织器官分布与清除过程,理解制剂或工艺等因素对系统循环前的影响,以及建立体内外相关性等,主要用于考察制剂-生理参数相互作用,以预测制剂因素和某些特性变化对临床PK的影响。
3,反卷积:是一种不使用模型直接利用药代动力学数据得到药物体内动态信息的数学计算方法,尤其适用于房室模型模拟困难和缓控释制剂的体内外相关性研究,当已知药物的体内吸收的药时曲线数据时,反卷积的方法可以获得药物的在体内的吸收或释放曲线。
4,FaSSIF餐前小肠液/FeSSIF餐后小肠液/FaSSGF空腹胃部模拟液/FeSSGF餐后胃部模拟液/FaSSCoF空腹结肠模拟液/FeSSCoF餐后结肠模拟液 :为英国Biorelevant公司的生物相关溶出介质名称。如需了解详细信息,欢迎扫描二维码添加以下微信咨询。
【参考文献】
[1] ANAND O, YU L X, CONNER D P, 等.Dissolution Testing for Generic Drugs: An FDA Perspective[J/OL]. TheAAPS Journal, 2011, 13(3): 328.https://doi.org/10.1208/s12248-011-9272-y.
[2] GRADY H, ELDER D, WEBSTER G K, 等.Industry’s View on Using Quality Control, Biorelevant, andClinically Relevant Dissolution Tests for Pharmaceutical Development,Registration, and Commercialization[J/OL]. Journal of PharmaceuticalSciences, 2018, 107(1): 34-41.https://doi.org/10.1016/j.xphs.2017.10.019.
[3] MARROUM P J. History and Evolution of the Dissolution Test[J/OL].Dissolution Technologies, 2014, 21(3): 11-16.https://doi.org/10.14227/DT210314P11.
[4] AMIDON G L, LENNERNÄS H, SHAH V P, 等.A theoretical basis for a biopharmaceutic drug classification: thecorrelation of in vitro drug product dissolution and in vivobioavailability[J/OL]. Pharmaceutical Research, 1995, 12(3): 413-420.https://doi.org/10.1023/a:1016212804288.
[5] SHENG J J, MCNAMARA D P, AMIDON G L. Toward an in vivodissolution methodology: a comparison of phosphate and bicarbonatebuffers[J/OL]. Molecular Pharmaceutics, 2009, 6(1): 29-39.https://doi.org/10.1021/mp800148u.
[6] AMARAL SILVA D, DAVIES N M, BOU-CHACRA N, 等.Update on Gastrointestinal Biorelevant Media and PhysiologicallyRelevant Dissolution Conditions[J/OL]. Dissolution Technologies,2022, 29(2): 62-75. https://doi.org/10.14227/DT290222P62.
[7] DOROŻYŃSKI P P, KULINOWSKI P, MENDYK A, 等.Novel Application of MRI Technique Combined with Flow-Through CellDissolution Apparatus as Supportive Discriminatory Test forEvaluation of Controlled Release Formulations[J/OL]. AAPSPharmSciTech, 2010, 11(2): 588-597.https://doi.org/10.1208/s12249-010-9418-8.
[8] JANTRATID E, JANSSEN N, REPPAS C, 等.Dissolution Media Simulating Conditions in the Proximal HumanGastrointestinal Tract: An Update[J/OL]. Pharmaceutical Research,2008, 25(7): 1663-1676. https://doi.org/10.1007/s11095-008-9569-4.
[9] BOETKER J P, RANTANEN J, RADES T, 等.A New Approach to Dissolution Testing by UV Imaging and FiniteElement Simulations[J/OL]. Pharmaceutical Research, 2013, 30(5):1328-1337. https://doi.org/10.1007/s11095-013-0972-0.
[10] REPPAS C, FRIEDEL H D, BARKER A R, 等.Biorelevant In Vitro Performance Testing of Orally AdministeredDosage Forms—Workshop Report[J/OL]. Pharmaceutical Research, 2014,31(7): 1867-1876. https://doi.org/10.1007/s11095-014-1348-9.
[11] PEDERSEN B L, MÜLLERTZ A, BRØNDSTED H, 等.A comparison of the solubility of danazol in human and simulatedgastrointestinal fluids[J/OL]. Pharmaceutical Research, 2000, 17(7):891-894. https://doi.org/10.1023/A:1007576713216.
[12] Absorption of danazol after administration to different sites ofthe gastrointestinal tract and the relationship to single- anddouble-peak phenomena in the plasma profiles - PubMed[EB/OL].[2022-08-05]. https://pubmed.ncbi.nlm.nih.gov/8126256/.
[13] ANDREAS C J, TOMASZEWSKA I, MUENSTER U, 等.Can dosage form-dependent food effects be predicted using biorelevantdissolution tests? Case example extended release nifedipine[J/OL].European Journal of Pharmaceutics and Biopharmaceutics, 2016, 105:193-202. https://doi.org/10.1016/j.ejpb.2016.06.010.
[14] In vitro–in vivo correlations for lipophilic, poorlywater-soluble drugs[J].
[15] LAISNEY M, HEIMBACH T, MUELLER-ZSIGMONDY M, 等.Physiologically Based Biopharmaceutics Modeling to DemonstrateVirtual Bioequivalence and Bioequivalence Safe-space for Ribociclibwhich has Permeation Rate-controlled Absorption[J/OL]. Journal ofPharmaceutical Sciences, 2022, 111(1): 274-284.https://doi.org/10.1016/j.xphs.2021.10.017.
[16] VAN BREEMEN R B, LI Y. Caco-2 cell permeability assays tomeasure drug absorption[J/OL]. Expert Opinion on Drug Metabolism &Toxicology, 2005, 1(2): 175-185.https://doi.org/10.1517/17425255.1.2.175.
[17] FOSSATI L, DECHAUME R, HARDILLIER E, 等.Use of simulated intestinal fluid for Caco-2 permeability assay oflipophilic drugs[J/OL]. International Journal of Pharmaceutics, 2008,360(1-2): 148-155. https://doi.org/10.1016/j.ijpharm.2008.04.034.
[18] Application of Physiologically Based Biopharmaceutics Modelingin Support of Drug Product Quality[EB/OL]. [2022-08-04].https://pqri.org/wp-content/uploads/2019/04/2-Yang-Zhao-PQRI-meeting.pdf.
[19] Current State and Future Expectations of Translational ModelingStrategies to Support Drug Product Development, Manufacturing Changesand Controls[EB/OL]. [2022-08-05].https://www.fda.gov/media/128809/download.
[20] EMA expectations in building a safe space based on PBBM[EB/OL].[2022-08-04].https://cersi.umd.edu/sites/cersi.umd.edu/files/Day%203-2%20Evangelos%20Kotzagiorgis.pdf.
[21] The impact and future of physiological based PK inbiopharmaceutics modeling (PBBM) in support of drug productquality[EB/OL]. [2022-08-04].https://cersi.umd.edu/sites/cersi.umd.edu/files/Day%201-1%20Paul%20Seo%20Final.pdf.
[22] Guidance for Industry Extended Release Oral Dosage Forms:Development, Evaluation, and Application of In Vitro/In VivoCorrelations[EB/OL]. [2022-08-05].https://www.fda.gov/media/70939/download.
[23] WU F, SHAH H, LI M, 等.Biopharmaceutics Applications of Physiologically BasedPharmacokinetic Absorption Modeling and Simulation in RegulatorySubmissions to the U.S. Food and Drug Administration for NewDrugs[J/OL]. The AAPS Journal, 2021, 23(2): 31.https://doi.org/10.1208/s12248-021-00564-2.
[24] Challenges and Strategies in Establishing an In Vitro-In VivoLink[EB/OL]. [2022-08-05].https://www.pharmacy.umaryland.edu/media/SOP/wwwpharmacyumarylandedu/centers/cersievents/dissolution/day2_paul-seo.pdf.
[25] ANAND O. The Use of Physiologically Based PharmacokineticAnalyses—in Biopharmaceutics Applications -Regulatory and IndustryPerspectives[J]. Pharmaceutical Research, 2022: 20.

来源:璟熙医药


