您当前的位置:检测资讯 > 行业研究
嘉峪检测网 2022-07-21 15:24
[摘要] 2021年全球创新药物开发持续升温,药品审评审批步伐加快,各国上市新药收获颇丰。美国FDA 药品评估和研究中心( CDER) 在 2021 年共批准了 50 款新药,其中有 38 款为全球首批; 欧洲 EMA 全年共批准了 53 款创新药,其中 7 个为全球首次批准; 日本医药品和医疗器械局( PMDA) 全年共批准了 42 款创新药,其中有 7 款为全球首批; 国家药品监督管理局( NMPA) 全年共批准了 66 款新药,其中在全球首次批准上市的新药有 25 款。本文概括总结了 2021 年美国、欧洲、日本和中国获批上市的新药,并展望了 2022 年生物医药产业的发展态势,以期为新药研发工作者提供参考。
2021年是全球创新药成果丰硕的一年。药物研发靶点 CD-3,PD-1 的热度居高不下,行业赛道内竞争激烈,随着新药研发投入不断增加,全球多种疾病领域迎来了新靶点、新机制和新疗法。本文对2021 年美国、欧洲、日本、中国获批上市的原创新药信息进行梳理和介绍,包括新分子实体( NME) 和新的治疗用生物制品( BLA) ,并展望了 2022 年值得关注的重磅新药,旨在为从事新药研发工作者提供参考。2021 年之前就已获批上市药物的相关仿制药、复方药、新增适应证、新剂型以及血液制品、疫苗、中药等产品不在本文讨论范围。
12021年美国FDA 批准的全新药物
美国FDA药品评估和研究中心( Center of DrugEvaluation and Research,CDER) 2021 年共批准了 50款新药,其中全球首批的新药有 38 款( 见表 1) ,属于“同类第一( first in class) ”的药物有 27 款[1]。

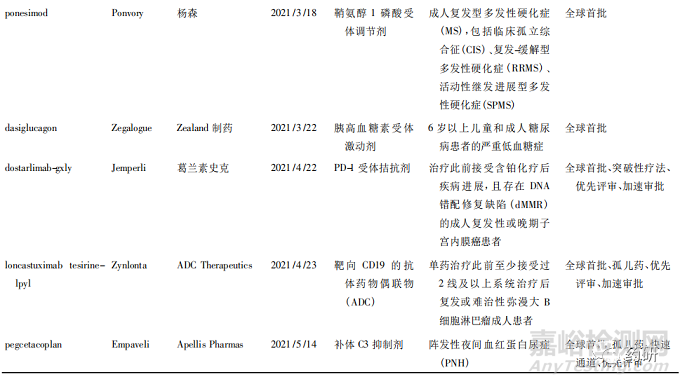
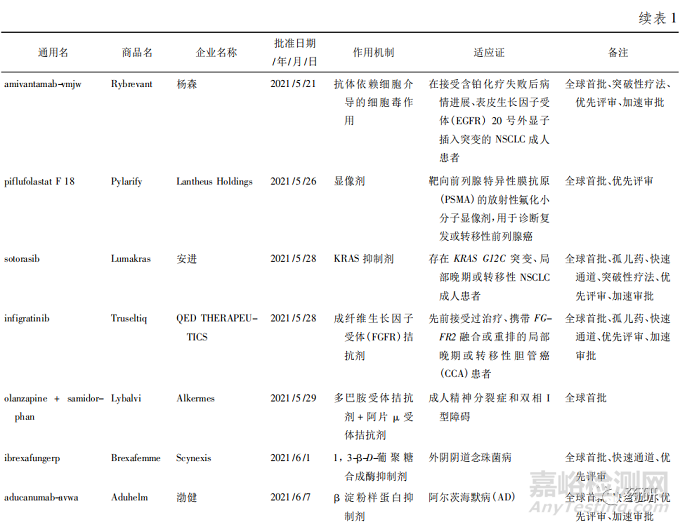

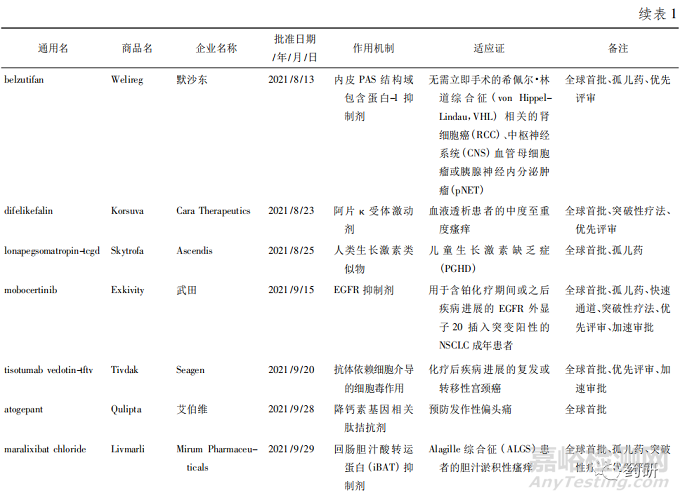
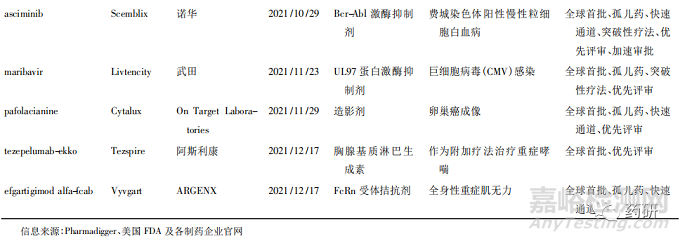
从疾病领域来看,抗肿瘤药获批数量最多( 15款) ,占获批新药总数的 30% ; 其次是神经科药物,有 5 个新药获批; 传染病和心血管疾病新药并列第3 位,各有 4 款获批准。2021 年获批新药的创新度也很高,从审评方式上看,共有 34 款新药以“优先审评”方式获得美国 FDA 批准上市、18 款被授予“快速通道”资格、26 款被授予孤儿药资格、14 款被授予“突破性疗法”认定。
此外,美国 FDA 的 CBER还批准了 2 款细胞疗法 Breyanzi 和 Abecma[2],分别被批准用于治疗大 B细胞淋巴瘤和多发性骨髓瘤。
为了应对新型冠状病毒肺炎( COVID-19) 疫情紧急 情 况,美 国 FDA 延续使用了紧急使用授权( EUA)[3]。在这种管理方式下,美国 FDA 陆续批准了 4 款抗体产品: LY-CoV555 + LY-CoV016 抗体组合( bamlanivimab + etesevimab) ,用于治疗 12 岁及以上具有进展至重度或住院高风险的轻、中度 COVID-19患者; Xevudy( sotovimab) 用于治疗轻度至中度的高危COVID-19 患者; Evusheld( tixagevimab + cilgavimab) 用于 SARS-CoV-2 接触前预防; 另外还有 1 款 IL-6R 单抗Actemra( tocilizumab) ,用 于 治 疗 重 度 COVID-19[4]。此外还批准了 2 款口服药 Paxlovid ( nirmatrelvir +ritonavir) 和 Lagevrio ( molnupiravir) ,用于治疗轻中度 COVID-19 成人患者。与瑞德西韦等注射类药物[5]不同,口服治疗药物意味着轻中度患者可以在家服药等待康复。
2021年 CDER 批准了许多针对不同类型肿瘤的疗法,覆盖了肺癌、乳腺癌、妇科肿瘤、血液肿瘤等多个癌种,其中包括治疗晚期子宫内膜癌的药物 Jemperli( dostarlimab-gxly) 、治疗非小细胞肺癌( NSCLC) 的 Cosela( trilaciclib) 、治疗复发或难治性多发 性 骨 髓 瘤 的 药 物 Pepaxto ( melphalan flufe-namide) 以及治疗转移性胆管癌的 Truseltiq( infig-ratinib) 。
获批产品中还有许多具有里程碑意义的新药,包括断裂点簇集区( breakpoint cluster region,BCR) -艾贝尔逊白血病病毒( Abelson leukemia virus,ABL)融合基因蛋白激酶抑制剂 Scemblix( asciminib) 、补体 C3 环肽抑制剂 Empaveli( pegcetacoplan) 、Kristen鼠肉瘤病毒致癌基因( Kristen rat sarcoma viral onco-gene,KRAS) 抑制剂 Lumakras( sotorasib) 等,值得关注是 KRAS 作为癌症中最频繁的突变基因之一,长期以来患病者被认为无药可治,Lumakras 是一款高选择性的、不可逆转的 KRAS G12C 突变抑制剂,获批成为 KRAS 突变人群中第一个靶向药物,颠覆了一直以来认为该靶点难以成药的想法。此外,渤健( Biogen) 公司备受争议的抗 β-淀粉样蛋白( Aβ) 抗体 Aduhelm( aducanumab-avwa) 获得了上市许可,这是近 20 年来美国 FDA 批准的首个 AD 新药。虽然对其质疑声不断,但可见美国 FDA 对攻克这一疾病的积极态度,至少目前来看,AD 领域的研发随着Aduhelm 获批而有所升温,卫材公司和渤健公司申请的 lecanemab 已获得突破性疗法认定,礼来公司的 Aβ 抗体药物 donanemab 也准备就绪。
22021年欧洲批准的全新药物
2.1 2021 年欧盟批准的全新药物
2021 年欧洲EMA 共批准了 53 款新药[6-7],大部分为小分子药物。所有产品中,属于全球首次批准上市的新药有7 款( 见表 2) 。在 COVID-19 流行期间,欧洲 EMA 启动了滚动审评( rolling review) ,对企业提交的针对COVID-19 的产品加速审评。此外,加速评估( AA) 、附条件上市许可( CMA) 、特例批准( AEC) 、优先药物( PRIME) 等政策的确立使药品监管审批更加灵活。2021 年获批新药中就有 10 款获得 CMA。值得一提的是,Albireo 公司开发的孤儿药 Bylvay( odevixibat)的上市受益于欧盟另一监管机制特例批准,给患有进行性家族性肝内胆汁淤积症( PFIC) 的患者带来希望。唯一全球首批的一次性基因疗法 Skysona( elivaldogene autotemcel) 能够稳定疾病进程,并保留运动功能和沟通能力等神经功能,结束了患者只能采用异基因造血干细胞移植治疗的局面,带来了新的治疗选择。
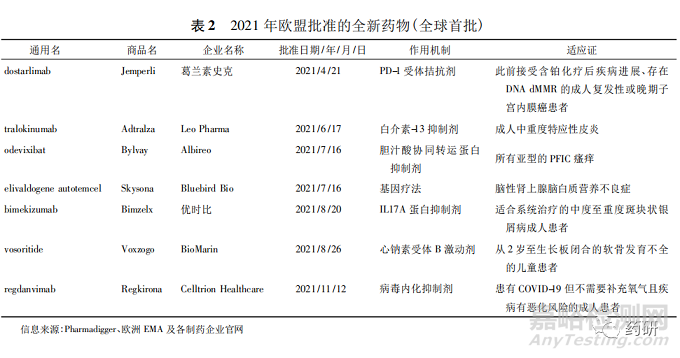
2.2 2021 年英国批准的全新药物
2020 年 1 月31 日,英国正式脱离欧盟,英国的药品医疗器械监管也脱离原有欧盟监管体系,其监管机制也随之发生了变化,英国药品和保健品管理局( MHRA) 负责监管英国境内所有药品、医疗器械和血液制品。2021 年 MHRA 在全球范围率先批准了 2 款新药,其中一款是辉瑞公司新一代口服 Janus 激酶( JAK) 抑制剂 Cibinqo( abrocitinib) ,于 2021 年 9 月 8 日获批。此前该药获得了 MHRA 的“有前途的创新药物”( PIM)资格认定以及药物早期获取计划( EAMS) 的积极科学意见,加快了批准速度,并获批用于治疗适合系统治疗、年龄在 12 岁及以上的中度至重度特应性皮炎青少年和成人患者。另一款新药是由默沙东公司开发的病毒复制抑制剂 Lagevrio ( molnupiravir) ,其于2021 年 11 月 4 日获批,用于治疗重症和住院风险较高的轻至中度 COVID-19 成人患者。
32021年日本批准的全新药物
2021 年日本医药品和医疗器械局( PMDA) 共批准了 42 款新药,包括 19 个小分子药物、9 个单克隆抗体药物( 简称单抗) 、5 款蛋白类药物及核素药物、多肽和 ADC 药物各 2 款,多肽偶联药物( PDC) 、多聚糖、siRNA 各 1 款,其中 7 款为全球首批( 见表3) 。最值得关注的是,由 JCR 制药公司开发的用于治疗亨特综合征的 Izcargo( pabinafusp alfa) 是世界上首款获批的能够穿越血脑屏障的重组艾杜糖醛酸硫酸酯酶( IDS) 替代疗法; 用于治疗癌症恶病质的新型口服药物 Adlumiz( anamorelin) 是一款选择性生长素释放肽受体激动剂,该药的获批是癌症恶病质患者生活质量提高的重要标志,也是肿瘤学领域重要的创新之一。
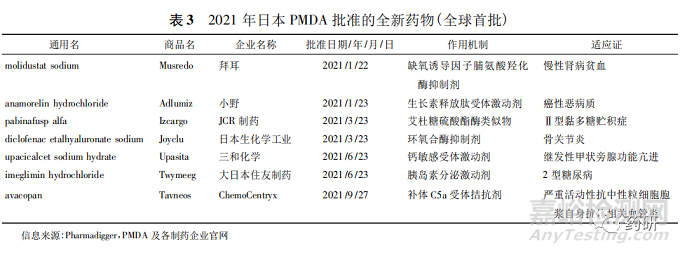
42021年中国批准的全新药物
从深化审评审批制度改革到创新药优先审评,从开展药品上市许可持有人制度( MAH) 到正式加入国际人用药品注册技术协调会( ICH)[8],从推进仿制药一致性评价到推进药品集中采购常态化等,近年来我国出台的一系列政策持续推动医药产业创新转型,为创新药提供了更大的发展空间。2021 年是国产新药收获的一年,国家药品监督管理局( NMPA) 共批准了 66 款新药[9],其中有 25 款为全球首批,包括 17 款化学药品和 8 款生物制品( 见表4) ,数量远远超过 2020 年的 9 款[10]。获批新药中抗肿瘤药居多。此外,国产新药也迎来了诸多“第一”———第一款国产 ADC 爱地希( 维迪西妥单抗) 、第一款间质-上皮细胞转化因子( MET) 靶向药物沃瑞沙( 赛 沃 替 尼 片) 、第一款受体酪氨酸激酶RET( rearranged during transfection) 抑制 剂 普 吉 华( 普拉替尼) 等。

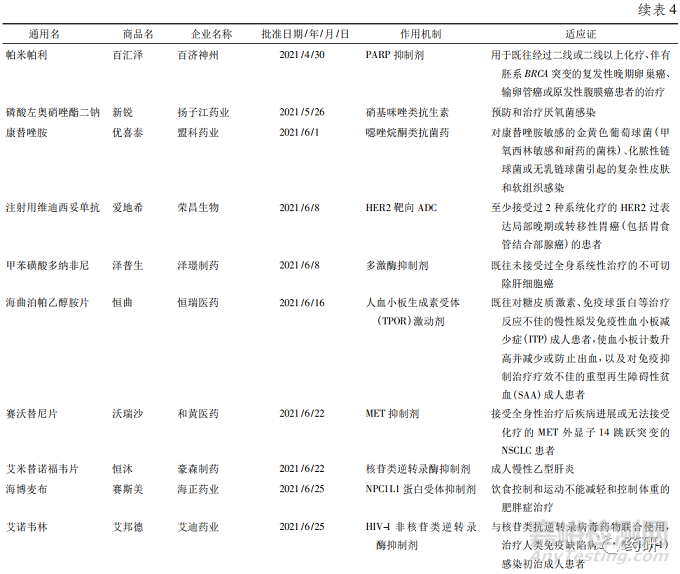
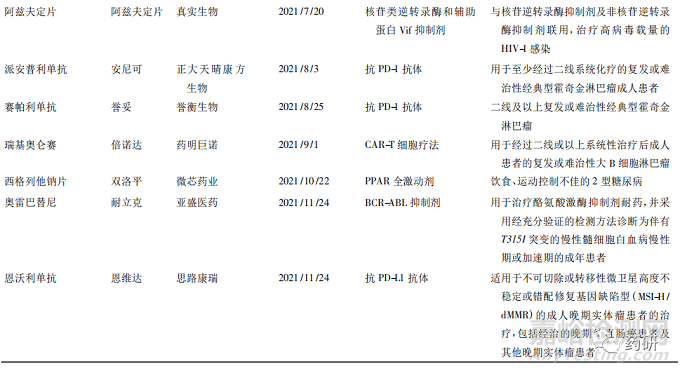
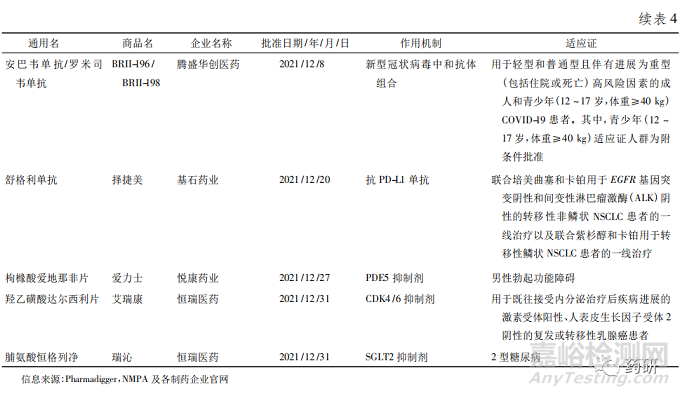
其中荣昌生物公司获批的 2 款新药都值得肯定。一款泰爱( 泰它西普) 开启了系统性红斑狼疮“双 靶 治 疗”的 新 时 代,该 药 同 时 抑 制 BLyS 和APRIL 这 2 个细胞因子,且突破性地应用了融合蛋白技术,使得药物与 2 个细胞因子的亲和力更强,实现更高效抑制,在保证安全性的同时疗效也非常出色。另一款爱地希( 注射用维迪西妥单抗) 在药物亲和力方面具有优势且不易产生抗药性,对低表达的肿瘤细胞效果较好,是目前全球第一个可以适合于 HER2 低表达的获批药物,也是胃癌新药研究的一个重大突破。
另外 从 表 中 可 以 看 出,2021 年 共 有 4 个 抗PD-1 /PD-L1 抗体在我国获批,均为我国企业自主研发产品。择捷美( 舒格利单抗) 已是国内第 12 款上市的 PD-1 /PD-L1 药物。事实上,这种激烈的同质化竞争也存在于 PD-1 /PD-L1 以外的其他领域。一方面,同质化竞争确实能降低患者和卫生保健系统的成本,提高用药可及性; 但另一方面,多家制药公司拥挤于同一个赛道,差异化不明显,存在一定程度的资源浪费,这也是需要引起关注和思考的问题。
52022年生物医药领域展望
近期,Evaluate Vantage 发布了“Evaluate Vantage2022 Preview”,指出 2022 年将有一批重磅药物值得期待[11]: Mirati Therapeutics 公司和再鼎医药公司共同开发的 adagrasib 有望成为治疗携带 KRAS G12C突变的结直肠癌患者的首款疗法,成为一项里程碑式的突破; 礼来公司的 donanemab 和罗 氏 公 司 的gantenerumab 如若成功上市,AD 新药市场的竞争将会加剧,预计 2026 年 2 家公司的收益将分别达到60 亿和 25 亿美元; Reata Pharmaceuticals 公司旗下的口服 Nrf2 激活剂 bardoxolone methyl 已被授予孤儿药资格,有望成为第一个治疗 Alport 综合征的药物; 传奇生物公司的靶向 B 细胞成熟抗原( BCMA)CAR-T 疗法 Carvykti( cilta-cel) 也一直备受关注,已在治疗多发性骨髓瘤的临床试验中表现出卓越的抗癌活性[12],cilta-cel 将有望成为国内第 3 款获批上市的 CAR-T 产品,也将是国内首个靶向 BCMA 的CAR-T 疗法。
除此之外,科睿唯安公司发布的《2022 年最值得关注的药物预测》指出,未来医药行业各种新技术将引领药物开发,如腺相关病毒( AAV) 递送技术、CRISPR、RNA 疗法、靶向蛋白降解嵌合体( PRO-TAC) 技术等[13 - 17],这些新技术未来将掀起医疗创新的新浪潮。
6结语
2021 年是全球新药产出丰厚的一年,经过前几年的厚积薄发,国内创新药企业陆续迎来了收获期,预计未来 2 年国内上市创新药数量将创下历史新高,ADC、双特异性抗体、CAR-T 疗法是新药研发的三大重要方向,特别是对于肿瘤的治疗,这三大方向非常有希望产生具有突破性疗效的产品[18 - 19]。
近年来,国产创新药正不断获得海外监管机构和大型跨国药企的认可,国产创新已不仅仅局限于做“me-too”,一批具有“fast-follow”、“first-in-class”潜力的品种将步入收获期。国内企业已经实现了第一个自主研发抗肿瘤新药泽布替尼在美国上市,近期也有企业向美国 FDA 提交了新药上市申请,国产创新药“扬帆出海”渐成趋势。今后全球创新药的追逐态势将更加激烈,必将发展成靶点选择、分子筛选、管线构建、临床试验和注册推进、市场销售等全方位的竞争。

来源:Internet


