您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-12-28 19:37
基质又称为基体或者介质,是指在分析样品中,除了目标物以外的其他物质和组分,称为该目标物的基质[1]。需要强调的是溶剂亦属于基质。在药物色谱分析中,由于药物之间物理化学性质差别较大,每种基质对药物的影响也不相同,直接影响方法的重现性、线性和准确度,这些干扰和影响被称为基质效应[2]。基质效应多出现在气相痕量检测、气相串联质谱和液相串联质谱。
基质效应产生机理
当分析一个多组分样品时,一旦基质和目标分析物一起进入分析系统中,就会产生基质效应。液相串联质谱中的基质效应是由于基质中的非挥发性组分与目标分析物,在雾滴表面离子化的过程中产生竞争, 影响电喷雾接口处的离子化效率。
气相(串联质谱)的基质效应是样品中的基质成分与目标分析物分子竞争进样口或柱头的金属离子、硅烷基及其他活性位点,从而掩盖了这些活性位点,使得目标分析物与活性位点接触诱导的吸附、分解等于干扰大大减少,从而使样品中的目标分析物的含量较纯溶剂中的含量在色谱响应上明显增高。图1很形象的描述这种现象[3]。.
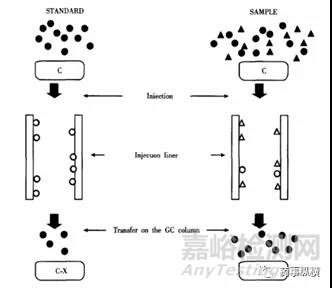
图1 基质效应的影响机理[4]
基质效应的来源
产生基质效应的干扰物主要有内源物质和外源物质[3]。内源物质主要是样品中存在的有机和无机成分,经样品处理后仍然存在。外源物质并非来自样品本身,而是来源于方法建立过程中外部环境,包括缓冲盐溶液、离子对试剂、有机酸、溶剂等[4,5]。笔者大量实验证明,在气相色谱中采用N-甲基吡咯烷酮作为溶剂较其他溶剂更易发生基质效应。
基质效应的评价
文献报道了评价基质效应主要有柱后灌注法、监控法、提取后加入等方法。
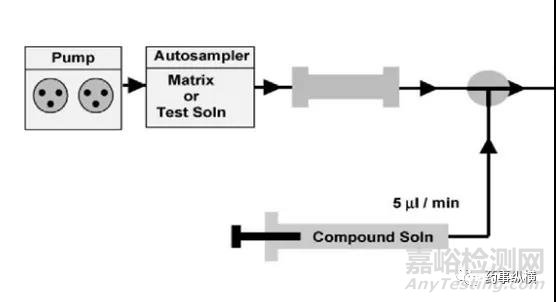
图2 柱后灌注法(来源:网络)
柱后灌注法一种常见的评价方法,它是用溶剂制备的纯的目标分析物标准溶液通过色谱柱和检测器之间的三通注入后所得到色谱图与将溶剂和样品溶液直接进样的色谱图进行比较,如果样品溶液的响应信号明显增强或减弱,则说明存在基质效应[6]。在这里笔者介绍两种简单方法:相对响应值法和标准曲线法。
1)相对响应值法是以对照溶液与样品加样溶液中目标分析物的响应值进行比较,以百分比表征基质效应。
基质效应(%)=B/A×100
A:在纯溶剂中目标分析物的响应值
B:样品基质中添加的相同含量目标分析物的响应值
2)标准曲线法是制备3组标准曲线,通过比较3组标准曲线待测组分的绝对响应值、待测组分与内标的响应值比值和标准曲线的斜率,可以确定基质效应对定量的影响。
表1 标准曲线法评价基质效应
|
标准曲线编号 |
配制方法 |
评价描述 |
|
1 |
用有机溶剂配制成含系列浓度目标分析物和内标的标准曲线 |
可评价整个系统的重复性 |
|
2 |
5种不同来源或不同品种的的空白样品经提取后加入与第1组相同系列浓度的目标分析物和内标物 |
同第1组测定结果相比,若待测组分响应值的相对标准偏差明显增加,表明存在基质效应的影响。 |
|
3 |
采用与第2组相同的空白样品在提取前加入与第1组相同系列浓度的目标分析物和内标后再经提取 |
若目标分析物的响应值的相对标准偏差明显增加,表明存在基质效应和提取回收率因样品来源不同而产生的共同影响。 |
一般情况下,我们习惯采用第一种评价方法进行基质效应评价。此外,还有人建议使用定量限下限(LLOQ)的某个浓度的准确度来评价基质效应。
规避基质效应的方法
在药物分析中,要想获得准确的回收率就尽量规避基质效应,目前文献报道的方法主要有以下几种:
1)合适的样品制备方法
采用合适的样品制备方法消除基因效应实际上就是净化除去基质成分从而提高色谱灵敏度,不过这样也会降低目标分析物的检出能力。因此选择最适当的样品处理方法也是十分必要的。常用的样品的处理方法包括蛋白沉淀,液液萃取(LLE)和固相萃取(SPE)[7]。
通常利用LLE或 SPE制备的样品内源性杂质较少,有助于降低绝对基质效应。但样品前处理过程的复杂会降低分析检测的效率,增加污染的风险,并可能带来待测组分的损失,也直接影响待测组分的提取回收率。因此在样品制备方法的选择中要兼顾基质效应和提取回收率两方面的因素,选择合适的样品制备方法。对样品进行稀释,确定合适的样品浓度就是消除基质效应的一种常见的操作。
笔者曾经采用不同溶剂制备某药物溶液来检测杂质A,分别考虑了不同溶剂中杂质A的回收率。由图 1可知,杂质A在N-甲基吡咯烷酮中的基质效最为严重,在乙腈、四氢呋喃及N,N- 二甲基酰胺中基本没有基质效应。
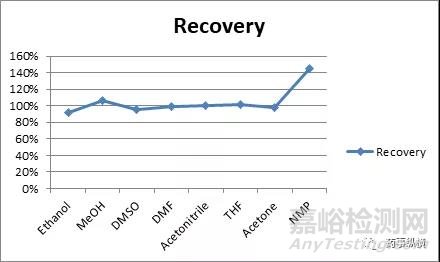
图3 不同溶剂基质效应表现
2)合适的色谱条件
采用合适的色谱条件消除基因效应实际上就是优化色谱分离条件使得内源性杂质与目标分析物分离。样品中的基质在反相色谱中会优先洗脱,如果分析时间较短或者分离效果不好,目标分析物就会受基质影响[7,8]。因此,改善色谱分析条件(调整流动相pH、整条流动相比例、改变固定性等。)适当增加目标分析物的保留(但要兼顾样品运行时间延长带来的峰展宽、灵敏度下降的问题),有利于减少基质对测定的影响。
3)减小进样量。
采用合适的色谱条件消除基因效应实际上就是尽量降低基质在色谱行为中的作用,从而在一定程度上降低基质效应。目前各个实验室基本都配备自动进样器,即使很小的进样体积也能实现良好的进样精密度。
4)内标法
在样品中加入内标物是药物分析中一种有效消除基质效应的方法,在分析测定样品中目标分析物时,加入一种内标物质消除基质效应对分析结果产生的影响,以提高分析结果的准确度。内标法是药物分析方法中一种常见的方法在此就不做赘述。
5)改用不同的离子源
对于质谱分析来说,消除基质效应还可以通过改变离子源的方式。目前用于定量的离子源主要是电喷雾离子源(ESI)和大气压化学离子源(APCI),通常ESI对于基质效应的敏感程度要高于APCI。对于特定的化合物,特别是对于蛋白质沉淀法处理的样品,若采用ESI有明显的基质效应,更换成APCI源或大气压光离子源(APPI)可能是一种简单易行的方法[3,6]。
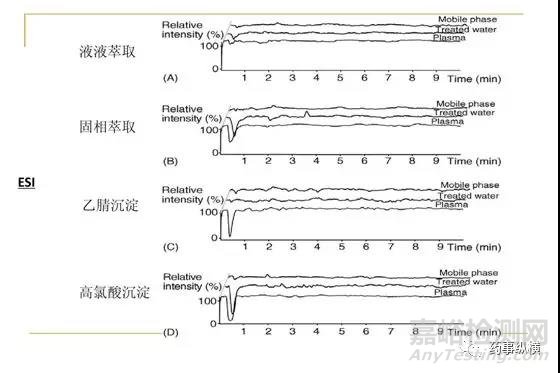
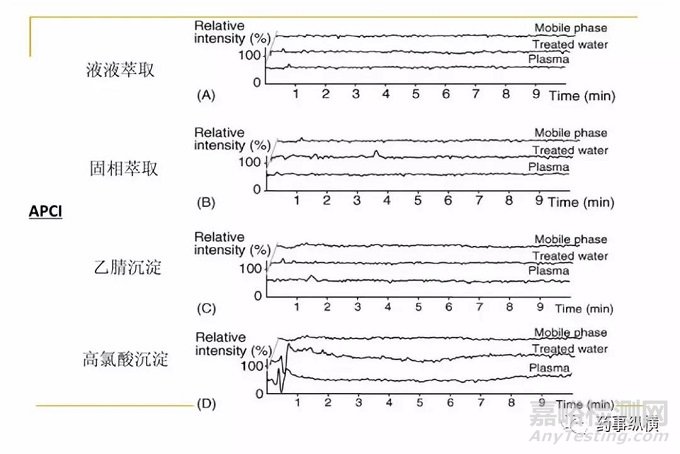
图4 两种离子源基质效应对比(来源:网络)
6)标准加入法
标准加入法消除基质效应实际上就是在将已知浓度的目标分析物加入到含有样品中,分析加入前后的目标分析物的影响值,拟出标准曲线,以标准曲线计算目标分析物含量[7]。标准加入法是在对照品和样品中同时加入基质,两者是在同等基质效应影响下采集,故可以相互抵消基质效应的影响。
7)校正因子校准法
校正因子校准法消除基质效应实际上是利用溶剂标准曲线校正基质匹配标准曲线获得校正因子,建立统计模型。该方法需要环境和系统一直处于稳定状态,而在科研实验室中这是很难做到的。按照图5的规则就可以计算基质中的目标分析物,假设某基质中目标分析物的响应值以Y表示,Y与XSC(在纯溶剂中浓度)有关,依据:
XMC=A+B×XSC
XMC—目标分析物在基质中的浓度;
A—(纯溶剂标准曲线截距-基质标准曲线截距)/基质标准曲线斜率
B—纯溶剂标准曲线斜率/基质标准曲线斜率
从原理上看标准加入法是校正因子校准法的一种。
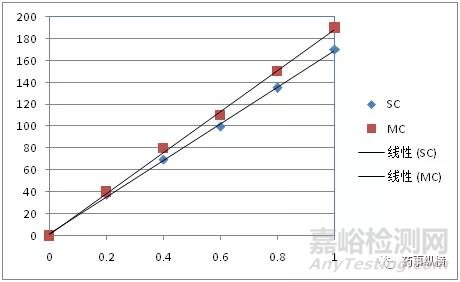
图5 氧化乐果在牛奶基质匹配液(MC)和乙腈溶剂(SC)中的校准曲线[8]
8)分析保护剂法
分析保护剂法消除基质效应实际上在溶剂制备的标准溶液和样品溶液中加入相同量得保护剂同等程度地补偿标准溶液和样品溶液的基质效应。
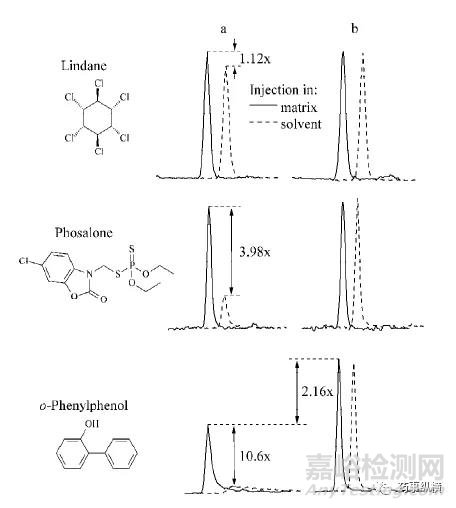
图6 混合水果乙腈提取液中利用分析保护剂效果对比[9]
结 语
基质效应给药物分析实验室中对药物的定性和定量带来了很多影响,掌握基本的基质效应机理有利于药物分析工作者在日常科研工作中正确规避基质效应。国外学者很早就对药物分析工作中基质效应进行研究,发明了多种消除基质效益的方法和技术,而我国分析工作者对这一客观存在的现象尚未引起注意和重视。有关报道较少[10]。
以上是笔者翻查多篇文献和著作对色谱分析中基质效应理论的简单总结,其中涉及一些个人观点,难免有不妥之处,还请多批评指教。也欢迎与笔者一样有此方面研究兴趣的同行一起探讨研究!
参考文献
【1】 MatuszewskiB K , Constanzer M L , Chavez-Eng C M . Strategies for the Assessment of MatrixEffect in Quantitative Bioanalytical Methods Based on HPLC?MS/MS[J]. AnalyticalChemistry, 2003, 75(13):3019-3030.
【2】 TaylorP J . Matrix Effects: The Achilles Heel of Quantitative High-Performance LiquidChromatography-Electrospray-Tandem Mass Spectrometry[J]. Clinical Biochemistry,2005, 38(4):328-334.
【3】 DipartimentoDSG, Tecnologie CEA, Universita DSDU, et al. An Overview of matrix effects inliquid chromatography-mass spectrometry [J]. Mass Spectr Rev, 2011, 30:491–501.
【4】 SchenckF J , Lehotay S J . Does Further Cleanup Reduce the Matrix Enhancement Effectin GC Analysis of Pesticide Residues in Food?[J]. Journal of Chromatography A,2000, 868(1):51-61.
【5】 BonfiglioR, King RC, Olah TV, Merkle K. The effects of sample preparation methods on thevariability of the electrospray ionization response for model drug compounds.Rapid Commun. Mass Spectrom. 1999, 13(12):1175-1185.
【6】 MatuszewskiB K , Constanzer M L , Chavez-Eng C M . Matrix Effect in Quantitative LC/MS/MSAnalyses of Biological Fluids:? A Method for Determination of Finasteride inHuman Plasma at Picogram Per Milliliter Concentrations[J]. AnalyticalChemistry, 1998, 70(5):882-889.
【7】 CeleiroM , Llompart M , Lamas J P , et al. Determination of fungicides in white grapebagasse by pressurized liquid extraction and gas chromatography tandem massspectrometry[J]. Journal of Chromatography A, 2014, 1343:18-25.
【8】 ErneyD R , Pawlowski T M , Poole C F . Matrix-induced peak enhancement of pesticidesin gas chromatogrtaphy: Is there a solution?[J]. Journal of Separation Science,1997, 20(7):375-378.
【9】 CajkaT, MastovskáK, Lehotay S J, et al. Use of automated direct sample introduction with analyteprotectants in the GC-MS analysis of pesticide residues[J]. Journal ofSeparation Science, 2015, 28(9‐10):1048-1060.
【10】 YongH B , Ping P C , Ru W Y , et al. Rapid Determination of Pesticide Multiresiduesin Vegetable by Gas Chromatography-mass Spectrometry and Compensation forMatrix Effect with Protectants[J]. Chemical Journal of Chinese Universities,2006.

来源:Internet


