您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-11-24 11:33
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
贝达药业SHP2抑制剂报IND。贝达药业化学1类新药BPI-442096片的临床试验申请获CDE受理,拟单药或联合用药针对KRAS突变、RTK突变等实体瘤患者开展临床研究。BPI-442096是一款新型的小分子口服SHP2抑制剂,具有高效与高选择性等特点。临床前研究显示,BPI-442096在体内外均具有显著的生物活性,且体内外的药代动力学特征良好,具有较高的口服生物利用度,毒性安全可控。目前全球尚无SHP2抑制剂获批上市。
国内药讯
1.腾盛博药新冠鸡尾酒Ⅲ期临床揭盲。由清华大学、深圳市第三人民医院和腾盛博药合作研发的新冠中和抗体组合疗法(BRII-196和BRII-198)Ⅲ期临床于日前揭盲,联合用药组在治疗28天后实现零死亡,对照组8例死亡,详细结果将于近期对外公布。据悉,这是我国进展最快的抗体药物,有望12月底前获得批准附条件上市。与欧美已获批紧急使用的新冠抗体药相比,该药是唯一进行了变异株感染者治疗效果评估并获得数据。
2.亚盛BCR-ABL抑制剂获欧盟孤儿药资格。亚盛医药1类新药奥雷巴替尼(HQP1351)获欧盟委员会授予孤儿药资格认定,用于治疗慢性髓细胞白血病(CML)。HQP1351是一款第三代BCR-ABL抑制剂,已获FDA授予快速通道资格及孤儿药资格。今年7月,信达生物与亚盛达成合作协议,获得HQP1351在中国大陆、香港、澳门及台湾地区联合开发及商业化的授权。目前,HQP1351的上市申请已被CDE纳入优先审评,和突破性治疗品种。
3.科济自体CAR-T获批加拿大临床。科济药业自主研发的自体CAR-T细胞注射液CT041获加拿大卫生部批准开展临床试验。CT041是一款人源化抗CLDN18.2自体CAR-T细胞新药,拟用于治疗CLDN18.2阳性实体瘤如胃癌/胃食管结合部癌及胰腺癌。该新药此前已得中国国家药监局、FDA的临床许可,且获得欧洲EMA的优先药物(PRIME)资格。初步的临床试验数据显示CT041具有良好的疗效与安全性。
4.百济神州OX40激动剂获批临床。百济神州1类新药OX40激动剂BGB-A445注射液获国家药监局临床试验默示许可,此次为BGB-A445首次在国内获批临床,拟开发用于治疗晚期实体瘤。BGB-A445是百济神州自主研发的一款靶向OX40抗原的激动剂抗体,此前已在澳大利亚、新西兰等地获批临床。在临床前研究中,BGB-A445在包括PD-1耐药模型中表现出广泛的单药疗效,并已显示出与替雷利珠单抗、TLR9激动剂、P13Kδ抑制剂、sitravatinib和化疗联用具备疗效。
5.信达SIRPα抗体获批临床。信达生物1类新药IBI397获国家药监局临床试验默示许可,拟临床用于治疗晚期恶性肿瘤。IBI397是信达生物从Alector引进的一款具有独特双机理的SIRPα抑制剂。IBI397并非直接阻断SIRPα与CD47的结合,而是通过刺激巨噬细胞上的SIRPα内吞和降解来降低SIRPα/CD47通路信号,解除免疫抑制;此外,IBI397的Fc端可以结合激活型的Fc gamma受体来进一步提高肿瘤免疫反应,达到抑制肿瘤目的。
6.和泽医药GLP-1/GIP受体激动剂报IND。浙江和泽医药化学1类新药HZ010注射液的临床试验申请获CDE受理。HZ010是和泽医药自主研发的一款GLP-1/GIP受体双重激动剂,拟开发的临床适应症包括糖尿病、肥胖、非酒精性脂肪肝炎。靶向GLP-1/GIP受体激动剂为降糖药物研发赛道的热点,目前全球范围内已有多款候选药物进入临床阶段,进展最快的为礼来的Tirzepatide注射液。
国际药讯
1.瑞派替尼获欧盟批准四线治疗GIST。欧盟委员会(EC)批准Deciphera制药靶向抗癌药Qinlock(中文商品名:擎乐®,ripretinib,瑞派替尼)用于治疗先前接受过3种或3种以上激酶抑制剂治疗(包括伊马替尼)的晚期胃肠道间质瘤(GIST)成人患者。ripretinib是一款KIT/PDGFRα激酶开关调控抑制剂,也是首个获批用于四线治疗GIST的新药。再鼎医药拥有瑞派替尼在大中华区开发和推广的独家许可,目前该新药已在中国获批上市。
2.礼来CGRP偏头痛药物启动头对头研究。礼来CGRP偏头痛药物Emgality启动一项Ⅳ期临床Challenge-MIG,计划在美国入组约700例发作性偏头痛成人患者,评估每月皮下注射一次Emgality与口服片剂Nurtec ODT对比,用于发作性偏头痛(EM)的预防性治疗。该项研究将测量3个月双盲期内每月偏头痛天数至少减少50%的患者比例,测量与基线相比每月偏头痛天数至少减少75%和100%的患者比例,以及生活质量的改善情况。
3.创新CAR-T获再生医学先进疗法认定。CRISPR公司基于CRISPR基因编辑技术改造的同种异体CAR-T细胞疗法CTX110获FDA授予再生医学先进疗法认定(RMAT),用于治疗CD19阳性的B细胞恶性肿瘤患者。在一项Ⅰ期临床中,CTX110基于意向治疗分析的总缓解率达到58%,完全缓解率为38%。在接受治疗6个月后,完全缓解率为21%,最长的缓解持续时间超过18个月。此外,CTX110表现出积极的安全性特征。
4.β地贫基因疗法获FDA优先审评资格。FDA授予bluebird bio公司一次性基因疗法betibeglogene autotemcel(beti-cel)的生物制品许可申请(BLA)优先审评资格,用于治疗需要接受常规血红细胞输注的β地中海贫血患者。beti-cel已在多项临床中获得积极结果,接受beti-cel治疗的63例患者中,有2例患者的随访时间长达7年,8例患者的随访时间至少6年,19例患者随访时间超过5年。如果获批,这将是FDA批准的首款造血干细胞体外基因疗法。
5.即用型NK细胞疗法早期临床积极。Affimed公司脐血来源的自然杀伤细胞疗法,预先与先天细胞接合剂(ICE)AFM13 (CD16A / CD30)结合,在治疗接受过多线预治疗的霍奇金和非霍奇金淋巴瘤患者的Ⅰ期临床中获积极结果。接受推荐剂量(1×10^8个NK细胞/kg)治疗的12例患者中,客观缓解达到100%,完全缓解率达到42%;未观察到细胞因子释放综合征、神经毒性综合征或移植物抗宿主病等事件。
6.GSK布局NASH的RNAi疗法。葛兰素史克与Arrowhead公司就后者拟用于治疗非酒精性脂肪性肝炎(NASH)的RNAi疗法ARO-HSD达成合作协议,将获得ARO-HSD在大中华区之外的开发和商业化权益。ARO-HSD旨在靶向抑制HSD17β13蛋白的产生,来降低慢性肝病风险,以及降低脂肪变性进展为脂肪性肝炎的风险。根据协议,Arrowhead将获得1.2亿美元前期付款,并有资格获得超过10亿美元的开发和商业化里程碑付款。
医药热点
1.北京加强精神医疗服务。北京市卫健委等8部门联合印发《北京市加强和改善精神医疗服务实施方案》。《方案》明确,增加精神科医师等专业人员数量,优化专业技术人员结构,到2025年,全市精神科医生数量达8.2人/10万人口;采取急慢分管的复合式支付方式,对长期住院患者完善按床日定额支付政策,对中短期住院患者探索按DRG付费,重点调整精神、心理治疗等技术劳务项目价格。
2.甘肃:医院可自主确定分配模式。甘肃省日前印发《甘肃省深化公立医院薪酬制度改革实施方案》。《方案》明确,各级公立医院可继续完善岗位绩效工资制度,也可结合本单位实际,自主确定其他更加有效的分配模式。可探索实行年薪制、协议工资制、项目工资等分配形式;可自主设立岗位津贴、生活补贴、科研津贴等体现医疗行业特点、劳动特点和岗位价值的薪酬项目等。
3.中国医院科研诚信联盟成立。11月21日,中国医院科研诚信联盟在长沙正式成立。该联盟由中南大学湘雅医院、四川大学华西医院、中山大学附属第一医院、华中科技大学同济医学院附属协和医院、吉林大学附属第一医院、山东大学齐鲁医院、上海交通大学医学院附属第九人民医院共同发起,由国内各级各类医疗机构自愿组成的非赢利性合作组织。目前首批联盟成员单位36家,分布于全国19个省份及直辖市,其中湖南省6家。
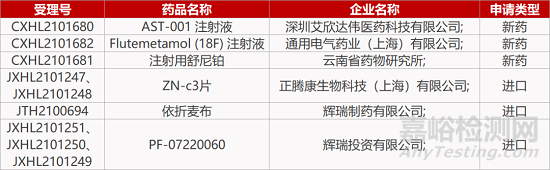
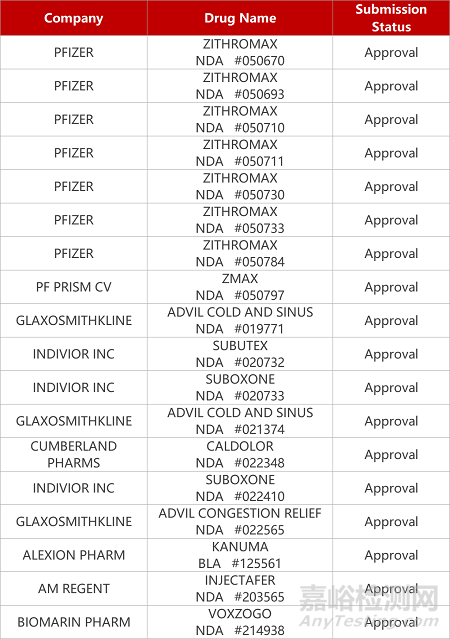
评审动态

来源:药研发


