您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-08-26 12:17
从药物早期药代动力学(PK阶段)研究直至药物上市,自始至终均使用选定的一种晶型(或盐型),不发生晶型/盐型的变更,是最理想的情况。但“现实状况”常常偏离“理想情况”很远。目前为止,没有任何一种晶型/盐型的筛选方法能够保证筛选得到API所有的晶型;此外,基于创新药研发的规律,不同研究阶段晶型/盐型的研究目标不同,以上原因决定了新药研究进程中可能存在着晶型/盐型的变更。
1. 先导化合物优化阶段(寻找候选化合物)
新药的这一阶段,筛选成药性最好的化合物作为候选化合物。限于先导化合物的量非常少、纯度不高,简单的晶型初步筛选几乎很难得到最稳定、物性最好的晶型或者盐型。寻找候选化合物阶段对固体形态的要求相对较低(满足溶解度需求、有一定的稳定性、能实现毫克级-克级的分离纯化),这一阶段的药学研究本身就存在诸多的不确定性,初选的晶型/盐型,本质上并未涉及到晶型/盐型的选择,变更的频率极高且几乎无风险。
2.临床前候选化物研究阶段
候选化合物合成工艺开发,提供的样品量足够开展系统的晶型/盐型筛选,这一阶段固体研究最重要的目的是评估挑选到最合适后续开发的固体形态。评估选择的过程类似过筛子,一层层筛掉某一特性不满足后续开发的晶型,各种晶型均有系统的对比研究,因此该阶段研究过程中的晶型变更,桥接药学研究相对简单,风险不高。
但确定候选化合物至以后的开发阶段,变更盐型的风险>变更晶型的风险,更换盐型需要重复所有已经完成的药学甚至临床研究。不同盐基导致的物理化学性质差异、安全性差异远大于不同晶型之间的差异(如不同晶型的毒副作用主要来源于剂量毒性,而盐基本身存在潜在生理毒性)。不同的盐基本质可以理解为化合物结构的改变,不同盐基的生理作用差异巨大,临床药效和药物毒性会存在显著区别。仿制药研究中,改盐基往往可作为改良性新药按2.1类新药申报,需要做大临床研究,而新晶型规避专利提前上市(即改晶型)BE实验通过即可,按3/4类仿制药申报。因此在晶型/盐型筛选中研究策略通常是:1,候选化合物晶型的筛选;2,如果后续开发评估需要开发盐型,则优先确定盐型的种类后,再对选定的盐型进行晶型筛选,最后选择特定盐型的晶型。
3 临床研究阶段
整体来说,临床前候选化物阶段是晶型系统研究最关键步骤,该阶段对晶型研究越透彻、后期因晶型开发导致的失败风险就会降到最低。I、II期临床主要是药物的初步评价阶段,如评估有必要,还会在临床I、II期变更晶型或盐型,但风险较高;临床III期是药物治疗作用的确证阶段,变更晶型/盐型风险极高,需非常审慎考虑。举两个例子说明变更晶型所带来的研究重复及项目延误风险。
案例 1 :临床早期变更晶型,不同晶型生物等效
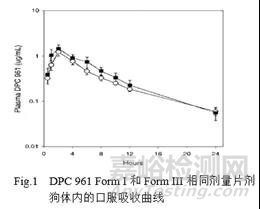
化合物DPC 961 BSC II 类药物,口服片剂给药,选定晶型Form I;临床样品生产期间,出现FormIII;因为Form III出现后,以前的工艺无法制备得到Form I,因此变更晶型为Form III。Form I 与Form III是互变多晶型,动物体内吸收曲线一致(Fig.1),变更晶型不需要额外增加临床人体内的桥接实验,这种情况在BCSII类药物中已属非常幸运的情况,但变更晶型导致的重复的药学研究:新晶型Form III分离纯化结晶工艺的开发、稳定性考察、对应晶型分析方法的开发以及晶型药物活性研究,耗费不同团队6个月以上的时间去完成。
案例2 临床III期更换晶型,不同晶型生物不等效
药物立普妥(阿伐他汀钙),BSC II 类药物,因未做过晶型筛选,早期临床I、II期使用的是半钙盐型的无定形,II期临床显示药效远远优于同类产品,FDA批准优先审评以缩短药物开发周期。但III期临床样品大规模放大生产性差,纯度偏低、过滤和干燥等后处理问题非常严重。与此同时,辉瑞研发团队在放大生产中发现一种半钙盐的三水合物晶型Form I,半钙盐晶型I与无定形比较优势非常明显:纯度高、化学稳定性更好、理化性质如粒度分布均匀、过滤干燥后处理等性能好。权衡工艺-成本,新晶型有“足够的优势”支持晶型的变更。在临床研发后期变更晶型,付出的代价巨大,重复了所有晶型相关的研究:1,API生产工艺;2,制剂工艺;3,稳定性研究;4,分析方法的开发;5,人体生物等效性研究。
4 新药申请(NDA)及上市阶段
上市晶型变更,肯定是“被迫”变更。如罗替高汀因为晶型问题被部分撤市,被迫变更晶型。罗替高汀是透皮贴剂,制剂中API是溶解状态,变更晶型对制剂的药效、药物安全性无影响,但UCB公司为了贴片的重新上市,开发新的制剂工艺、开展临床BE实验证明不同贴剂的生物等效研究,耗时近4年,造成巨大经济损失。
整体来说,临床前候选化物阶段是晶型/盐型研究风险控制点,是在持续的变更“目标晶型”的过程中,系统透彻的研究不同晶型理化性质、工艺可开发性、制剂成药性、药理药代生物活性等,从而选择一种最优的晶型用于临床开发。因为晶型/盐型会影响药物的安全性和有效性,临床阶段更换晶型,均是重大变更,会存在不同的中高级风险,大多是“逼不得已,不换不行”。
小结:本文是作者和同事讨论过程中,因有些概念相对模糊,遂搜集资料学习并整理成文。新药每一个阶段对应的晶型/盐型研究都会面临不同的议题,本文只是概述,深度欠佳。
参考文献:
[1] Newman A, Wenslow R . Solid form changes duringdrug development: good, bad, and ugly case studies [J]. AAPS Open, 2016,2(1):2.
[2] 《创新药(化学药)临床试验期间药学变更技术指导原则(试行)》
[3] 阿伐他汀钙仿制药专利战判决
来源:药事纵横


