您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-02-19 09:30
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
全球首个新冠病毒“人体挑战试验”在英国启动。英国新冠病毒“人体挑战试验”招募志愿者于17日启动。该项目拟招募不超过90名18-30岁的健康志愿者,在安全、可控的环境中,分析健康志愿者接触新冠病毒引发感染所需病毒的最少数量。这是全球首个新冠病毒“人体挑战试验”,该试验获得英国政府资助,由帝国理工学院、医疗公司hVIVO以及伦敦皇家免费国民保健制度信托基金会合作开展。
国内药讯
1.科兴新冠疫苗在港获紧急使用授权。科兴控股(香港)新冠灭活疫苗克尔来福获香港食物及卫生局批准,在香港作紧急使用,在现时疫情下用于预防新冠肺炎病毒感染。香港特区政府将在接收到有关疫苗并对其完成质检后,尽快启动由政府主导的全港性疫苗接种计划。目前,特区政府正积极跟进其余已采购疫苗的紧急使用批核和供应时间表,以确保香港疫苗接种的顺利开展。
2.百济神州泽布替尼新适应症申请获FDA受理。FDA受理百济神州BTK抑制剂百悦泽(泽布替尼)用于治疗华氏巨球蛋白血症(WM)患者的新适应症上市申请(sNDA),PDUFA日期为2021年10月18日。此次sNDA获受理主要是基于泽布替尼对比伊布替尼用于治疗WM患者的全球Ⅲ期ASPEN研究的安全性和有效性数据。在美国,该药已于2019年11月获FDA加速批准用于治疗既往接受过至少一项疗法的套细胞淋巴瘤(MCL)患者。
3.海思科环泊酚新适应症申报上市。辽宁海思科1类新药环泊酚注射液新适应症上市申请获CDE受理,用于支气管镜诊疗的镇静和/或麻醉。环泊酚注射液是海思科开发的全新的具有自主知识产权的静脉麻醉药物,目前已获批胃肠镜检查和麻醉诱导两大适应症,其用于“全麻维持”、“重症监护期间的镇静”两个适应症正处于Ⅲ期临床试验阶段。
4.君实生物TIGIT单抗美国获批临床。君实生物子公司TopAllianceBiosciences抗TIGIT单抗注射液(TAB006/JS006) 获FDA批准,即将在美国开展用于治疗晚期恶性肿瘤的临床试验。临床前研究结果表明,TAB006/JS006可特异性阻断TIGIT-PVR抑制通路,刺激杀伤性免疫细胞活化,分泌肿瘤杀伤性因子,与抗PD-1/PD-L1抗体可发挥协同抗肿瘤作用。目前,国内外尚无同类靶点产品获批上市。
5.豪森引进first in class口服抗真菌药。豪森药业与Scynexis公司签订了战略合作协议,获得Scynexis的葡聚糖合成酶抑制剂Ibrexafungerp在大中华区(包括香港、澳门及台湾)开发和商业化的独家权益。目前Scynexis已在美提交了Ibrexafungerp口服制剂治疗外阴阴道念珠菌病(阴道酵母菌感染)的上市申请,PDUFA日期为2021年6月1日。根据协议,豪森将向Scynexis支付1000万美元首付款、潜在的里程金付款及销售提成。
6.华东医药引进PRV-3279双抗大中华区开发权益。华东医药子公司杭州中美华东与Provention Bio签署战略合作协议,引进CD32B/CD79B双抗PRV-3279用于治疗系统性红斑狼疮以及预防或降低基因治疗的免疫原性这两项适应证在大中华区的独家临床开发及商业化权益。根据协议,Provention Bio将获得600万美元预付款、1150万美元研发等费用、1.72 亿美元的潜在里程碑付款以及产品销售分成。
国际药讯
1.阿斯利康免疫毒素Lumoxiti欧盟获批上市。欧盟委员会(EC)批准阿斯利康(AstraZeneca)抗癌药Lumoxiti(moxetumomab pasudotox)上市,用于治疗既往已接受过至少2种系统疗法(包括嘌呤核苷类似物[PNA])的复发/难治性毛细胞白血病(HCL)成人患者。Lumoxiti是一种抗CD-22重组免疫毒素,已于2018年9月获FDA批准上述适应症,成为过去20多年来获批治疗HCL的首个药物。
2.诺华重磅心衰药Entresto获FDA批准新适应症。FDA批准诺华重磅药Entresto(沙库巴曲/缬沙坦,中文商品名诺欣妥)扩展适用范围,用于治疗射血分数保留性心力衰竭(HFpEF)患者。Entresto也是首款可同时治疗射血分数降低性心力衰竭(HFrEF)和HFpEF的药物。一项Ⅲ期PARAGON-HF试验数据显示,Entresto能够为HFpEF患者提供临床获益,在左心室射血分数(LVEF)低于正常水平的患者中效益尤为显著。Entresto也是FDA批准治疗HFpEF的首款药物。
3.礼来双重机制糖尿病疗法临床结果积极。礼来GIP/GLP-1双重激动剂tirzepatide在治疗2型糖尿病的两项Ⅲ期临床(SURPASS-3和SURPASS-5)中均达主要和所有关键性次要终点。其中,在为期52周的SURPASS-3试验中,与insulin degludec对照组相比,最高剂量tirzepatide治疗组有92.6%的患者A1C水平小于7%,48.4%的患者A1C水平降低到正常水平,而且患者体重降低了12.9公斤。目前礼来已展开一系列Ⅲ期临床,检验其单药或联合用药治疗不同类型的2型糖尿病的效力。
4.奥拉帕利治疗早期乳腺癌Ⅲ期结果积极。阿斯利康/默沙东PARP抑制剂奥拉帕利(Lynparza)治疗BRCA突变(gBRCAm)的高风险HER2阴性早期乳腺癌的Ⅲ期临床OlympiA获积极结果。中期结果分析发现,与安慰剂相比,奥拉帕利在主要终点上已达到优越性标准,并表现出持久的治疗效果。独立数据监测委员会(IDMC)建议试验提前进入主要数据分析和报告。FDA此前已批准Lynparza用于治疗携带种系BRCA突变的晚期卵巢癌、乳腺癌、胰腺癌等多种癌症类型。
5.安进KRAS抑制剂获FDA优先审评资格。FDA授予安进KRAS G12C抑制剂sotorasib优先审评资格,用于治疗接受过一种前期全身性治疗的KRAS G12C突变、局部晚期或转移性非小细胞肺癌(NSCLC)患者,PDUFA日期为今年8月16日。据悉,sotorasib是首个进入临床开发阶段的KRAS G12C抑制剂,已获FDA授予的突破性疗法认定。在中国,安进和百济神州共同申报的sotorasib今年也拟纳入突破性治疗品种。
医药热点
1.全国疫情高风险地区清零。黑龙江省卫健委18日发布消息,17日0-24时,黑龙江省新增新冠肺炎确诊病例1例,为境外输入病例,由日本鹤见市进入哈尔滨市。从2月18日零时起,哈尔滨市利民开发区裕田街道、呼兰区建设路街道风险等级调整为低风险。至此,全国疫情中风险等级地区还有4个;高风险地区已经清零。
2.美国拟向世卫补交超2亿美金会费。据新华社报道,美国将在本月底前向世卫组织缴纳超过2亿美元的会费,包括评定会费和现阶段应缴纳的会费。美国国务卿在联合国安理会的新冠问题会议上说:“这是我们作为世卫组织成员国履行经济义务的重要一步。”他还表示,“这体现了我们对世卫组织的最新承诺,从而保证世卫在带领全球应对新冠疫情的工作中得到应有的支持。”。
3.国家药监局公布72个重点实验室名单。国家药监局公布第二批共72个重点实验室名单。本次重点实验室遴选重点向民族区域中药倾斜,评定了14家中药重点实验室;新认定了以四川大学华西医院为依托单位的创新药物临床研究与评价重点实验室等多个以药物创新为研究目的的实验室;并将以首都医科大学附属北京天坛医院为依托单位的体外诊断试剂质量控制重点实验室等纳入综合审评认定。
股市资讯
【华大基因】控股子公司华大吉比爱的十五项基于磁微粒化学发光免疫分析法检测试剂盒近日取得医疗器械注册证。
【君实生物】特瑞普利单抗联合化疗用于晚期一线未接受过系统性治疗的复发转移性鼻咽癌的新适应症上市申请获得受理。
【海辰药业】近日收到达比加群酯胶囊药品注册受理通知书。
审评动向
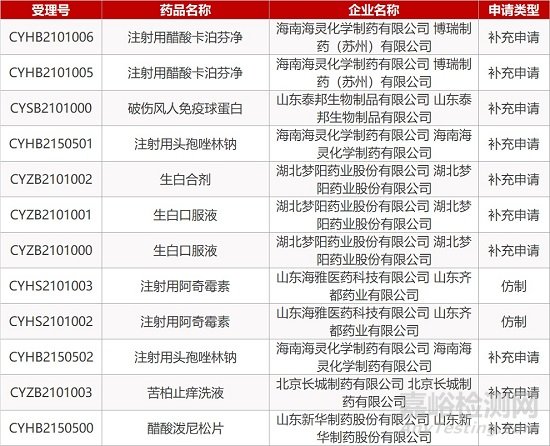
1. CDE最新受理情况(02月18日)
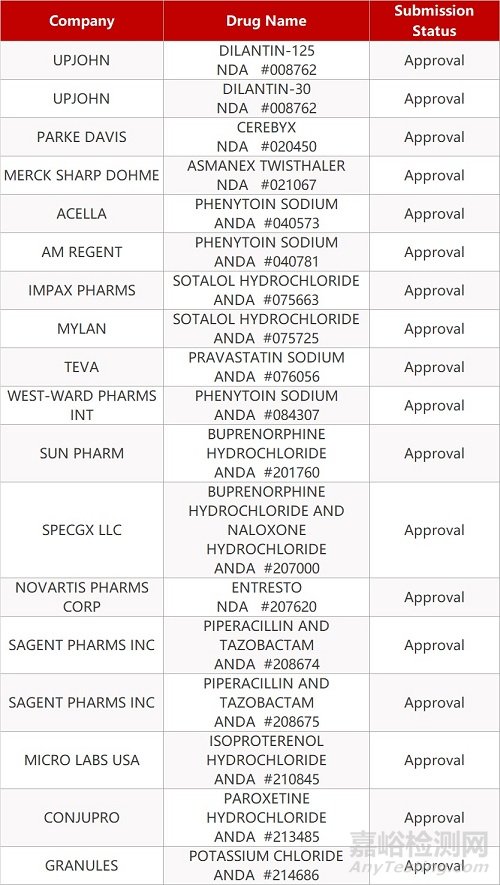
2. FDA最新获批情况(北美02月16日)

来源:药研发


