您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-02-09 08:41
仿制药在各国政府的大力推动下蓬勃发展。特别是近年来,诸多“重磅炸弹”级品牌药专利的集中到期,加剧了国际仿制药市场特别是美国等主流市场的竞争,更是成为我国医药企业培育出口新优势的难得契机。为降低药品市场价格,使需求人群能够更容易、更便利地获得急需的各种药品,各国政府积极鼓励仿制药企业对品牌药进行仿制。美国政府设立了专利挑战机制和严格而精巧的仿制药审批制度,即简明新药申请(abbrevitive new drug application,ANDA)。中国政府推荐优先审评同时申报中美的仿制药和/或采购进行可专利挑战的仿制药。
对于一个药物来说,专利申请的数量往往非常巨大,既包括核心专利,通常为化合物专利,也包括外围专利,如晶型、制剂、工艺专利等;各专利的关系错综复杂,而且一篇专利往往在多国申请,各个国家针对相同专利的权利要求范围以及法律状态各异,这就进一步增加了专利情况的复杂性。即使核心专利已经过期,但大量外围专利仍然处于有效状态,继续阻碍仿制药厂家的仿制药品上市,仿制药厂家仍然难以无风险地提早上市产品。
1.1 仿制药开发的专利挑战机制
医药产业是我国培育战略性新兴产业的重点领域,极具发展潜力。近年来,不少有远见的药企选择开发欧美仿制药,尤其是开发美国市场的第一家仿制药(首仿药)。提到美国首仿药,就不可避免地要探讨其与美国《药品价格竞争和专利期延长法》(也称“Hatch-waxman法案”)的关系。美国的《药品价格竞争和专利期延长法》明确规定,ANDA申请者可以通过发起专利挑战,谋求获得更有利“席位和收益”:第一家提交ANDA申请且挑战专利的公司,可获得相对优先的审评席位和有可能获得市场专卖权;其中的挑战专利即为在新药获批后的第5年的d1递交ANDA申请,同时根据橙皮书(orange book,OB)中列出的药品的相关专利,采取第四段声明——声明相关专利无效或者不侵犯相关专利(即通常所述的PIV声明)。在美国,一方面新药拥有者可以获得由于FDA审批耽误时间的补偿;另一方面,为了激励仿制药的开发,规定如果第一家仿制药厂商(即首仿药申请者)能够采用第四段声明挑战专利并且成功,则可以获得180d的市场专卖权,而不挑战专利的ANDA申请人,不能在新药获批后的第5年d1递交ANDA申请,而是需要在新药获批5年后才能递交ANDA申请。专卖权过后,其他仿制药才可以上市销售。
1.2 中国药企仿制药专利挑战现状
从国际经验来看,仿制药企业通过首仿专利挑战取得药物上市,不仅为企业赢得了巨额利润,也通过技术和资金的积累,为企业下一步新药研发创新提供了重要支撑。因此,在当今医药市场多方博弈的竞争格局中,我国医药企业在美国提交ANDA申请,开展仿制药专利挑战,争取180 d独占期,不仅能够以相对较小的成本赚取比普通仿制药以及国内仿制药品更高额的利润回报,获得与辉瑞公司、默克公司、梯瓦公司等跨国药业巨头竞争的主动权,更能够迅速提升我国医药企业的综合实力,从而实现我国医药产业结构的全面调整。
目前,医药市场较为成熟的区域主要集中在美国和欧盟,使之成为全球仿制药厂商竞争角逐之地。然而早期,国内仿制药企大多因认证缺失、不熟悉法规、专利意识和战略不成熟等,未能早早抓住这场首仿争夺战中的机遇,因而无法赢得这场竞争潮带来的市场红利。如辉瑞公司研发的降血脂药物立普妥(1iptor,通用名:阿托伐他汀)是医药史上第一个突破千亿美元大关的重磅炸弹药物,该药品专利于2011年11月在美国失效。而针对其ANDA申请和专利挑战早在2003年以后便拉开了帷幕,当立普妥的首仿竞争在美国如火如茶进行的时候,国内企业却由于各种障碍被阻挡在游戏的门槛之外,只好眼睁睁地看着这场高回报的竞争失之交臂,实为可惜。
近年来,中国药企把握全球大量创新药专利到期高峰到来的战略机遇,将眼光盯上国际市场,然而,仅个别中国药企能在国际市场中分得一杯羹。2011年,江苏恒瑞药业挑战艾普昔布美国首仿专利成功,最终取得FDA批准并上市,这是国内首例成功挑战美国专利并赢得创新药注射剂艾普昔布首仿的ANDA申请新药,也开创了仿制药企通过专利挑战获取首仿打入美国市场的先河。
中国药企进行美国仿制药特别是首仿药申报,还是相对新的方式,且首仿药存在较高的经济利益预期,是值得中国药企开展的申报方式,同时也需要企业提早进行准备,包括专利评估、分析、专利策略准备、技术准备等。
1.3 仿制药开发的专利策略
一种药品要上市,往往涉及多个方面,包括活性物质本身(即化合物)、化合物的制备方法、化合物的检测方法、化合物的晶型形式、药品的处方(即组合物)、药品的制备方法、药品的使用方法(即适应证)用途等;新药原研企业往往为其品牌药申请多个专利,将其重重保护起来。我们通常将药品中活性成分的化合物专利称为基础专利(核心专利),从属专利(外围专利)则包括药品活性成分的异构体、晶型、盐类、制备方法、制剂处方、新的适应证等,甚至可能涉及特定药物制剂形式,如特定结构形式的胶囊、异形片和不同的剂量等。
FDA的橙皮书所列药品专利即OB专利信息对于仿制药开发尤为关键。基础专利到期日往往较早,因而也通常视为该药品专利到期日,而从属专利到期时间则相对较晚,有时可相差十多年。因此,在基础专利到期较早,技术壁垒较高的情况下,企业通常优先考虑从到期较晚、易于攻破的从属专利下手,其中主要涉及的有药品活性物质的晶型专利、药品具体处方的制剂专利、药品的用药方法专利等。
晶型专利的主要特点有:①为物质专利,能够从实质上保护药品。②因原研企业的研发时间早,往往保护了有利晶型,专利壁垒较高。③专利保护的晶型往往是原研药品使用的晶型,而为了规避专利而改变晶型将使仿制药的生物等效风险增加,晶型专利能够增加仿制药开发难度。
鉴于仿制药申报和药品上市面临的专利障碍和相关专利的特点,通常针对仿制药厂商面临的晶型专利、仿制药开发的专利策略,可从以下几个方向考虑。
改变晶型可以相应改变晶型的结晶度、粒径、溶出特性,进而相应改变制剂处方,在规避了晶型专利的同时可在一定程度或范围内避开制剂专利的障碍,并且同时形成自主知识产权和产品竞争力。
其次,如果无法绕开专利保护晶型,则仿制药厂商要上市药物可能面临一连串的专利侵权的风险;为了提交美国ANDA申请,需向FDA提交PIV声明,随后仿制药企业将可能会面临原研企业的诉讼,此策略耗时长、费用高,如无充分把握,代价较高,这是许多国内企业难以承受的。一旦诉讼失败,那么仿制药企业上市可能面临原研公司侵权的起诉与赔偿。同时,原研公司也可能会选择与仿制药企业达成协议的保守策略,以一种双方利好的方式和解,近年来首仿专利挑战以和解告终渐成趋势。该策略是最复杂的,也是不确定性因素最高的。
如果以上方法均无法通过,那么仿制药企业只有被动等待专利过期,这是一个漫长的过程,仿制药厂家将丧失这段时间上市盈利的大好机会,同时面临后期更大的市场竞争,在此过程中不排除有其他仿制药厂家挑战专利成功,或许可以坐收渔利。
2、罗沙司他仿制药开发专利分析
仿制药厂商如何规避原研药的晶型专利,是仿制药开发者在研发之初就需要考虑的问题。本文通过研究罗沙司他(roxadustat)晶型专利规避方法,为仿制药研发者在研发中如何规避晶型专利提供了一种思路。其化学名为[(4-羟基一1-甲基-7-苯氧基异喹啉-3-羰基)氨基]乙酸,结构式见图1。
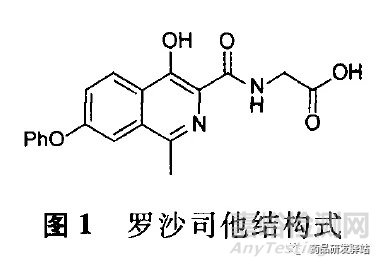
罗沙司他是由美国菲布罗根公司(FibroGen)研发的一种缺氧诱导因子脯氨酰羟化酶(HIF.PH)抑制剂,其作用机制是模拟缺氧状态,抑制HIF被羟化降解,从而激活并稳定HIF,诱导促红细胞生成素产生,最终达到治疗贫血的作用;其通过口服给药,与传统的输血相比,具有更好的使用顺应性;其在2017年底被国家药品监督管理局药品审评中心形容为“与现有治疗手段相比具有明显治疗优势”的新药,被列为优先审评药物,在2018年12月在中国获得批准上市,用于治疗慢性肾病或终末期肾病导致的慢性贫血;其极可能成为一个重磅炸弹级药物,其预测销售额可为20亿美元。
罗沙司他化合物于2004年12月16日在PCT申请W02004108681中公开,申请进人了中美欧等,都保护了罗沙司他具体化合物及其盐/酯等,是其基础专利,到期时间至2024年6月。随后,为了延长其药品生命周期,在2013年原研公司申请了晶型专利W02014014834及其同族,分别在中美欧等国家/地区要求保护包括晶型A在内的多种晶型和与多种氨基酸的盐,此晶型专利可使其药品的保护周期从2024年延伸至2033年。仿制药企业若不能突破此专利的限制,将不能及早上市此产品。我们本着使仿制药尽早上市又提升自身实力的目标,对罗沙司他的中国专利规避方式方法、专利策略等进行了分析、研究和尝试。
2.1 罗沙司他的相关专利
全面分析罗沙司他的专利,发现其存在包括化合物、晶型、工艺、制剂等多篇专利,主要专利见表1。
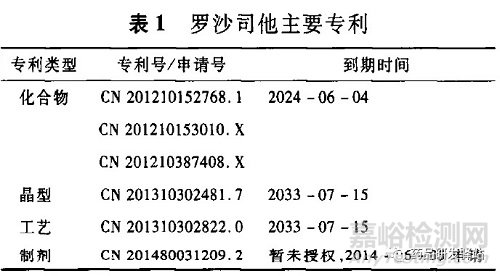
可以看出,原研厂商对罗沙司他化合物的保护非常重视,也很全面,有3篇专利。因此要挑战化合物专利即无效化合物专利,难度较大且费用等成本也会较高。而其他专利申请时间较晚,到期时间也相应较迟,要及早上市仿制药,必须无效专利或者突破专利范围,突破技术壁垒。根据药品领域内的已有经验,突破晶型、工艺或制剂专利堡垒相对容易、成本相对较低且收益巨大。如果能够突破晶型专利,则在其基础上可以相对容易地突破工艺或制剂的专利限制。因此,突破其晶型专利对于仿制药的提早上市有关键性影响。有鉴于此,全面、完整地分析晶型专利保护的情况,为制定专利策略和规避专利方法提供信息/支持和技术建议是非常有必要的。
2.2 晶型专利权范围
分析原研Fibrogen公司在2012年7月16日递交了优先权申请,然后在2013年7月15日递交了国际专利申请(PCT申请),依据PCT条约进入中国,相当于在2013年7月15日向中国递交专利申请,并且在2016年8月获得授权公告,其欧美同族也获得了授权。同时,其还有一些同族申请在审查过程中,见表2。
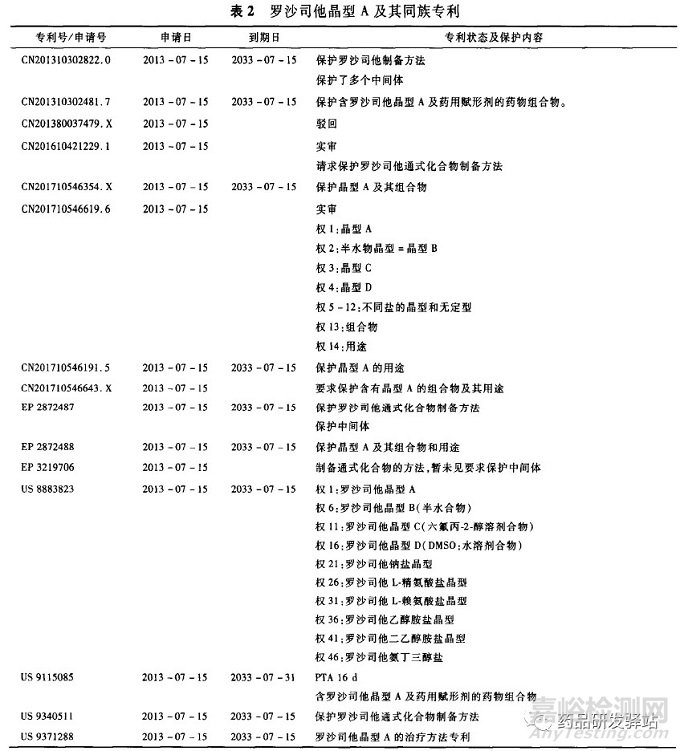
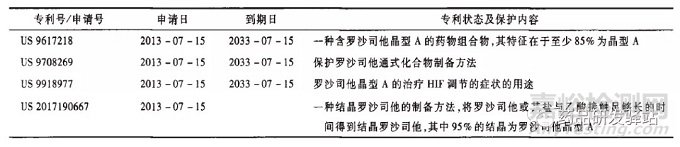
根据各专利的授权内容及同族专利申请要求保护的内容可知,原研公司想要重点保护的晶型为晶型A,同时也要求保护其他多种晶型和多种盐,包括氨基酸的盐,这些保护在美国获得了授权,且美国是既保护了晶型本身,又保护了晶型的组合物;在中国和欧洲目前授权的范围是保护了晶型A的组合物,但实质上仍然是对晶型的保护,因为没有关于组合物组分的其他任何限定,且原研公司仍然在递交新的分案或继续申请仍然要求保护晶型A等晶型本身。
2.3 晶型专利审查
对比文件分析对晶型专利无效可能性进行分析,首先查阅和分析了其专利审查历史文件。在中国和欧洲,审查时采用的对比文件基本相同,涉及对比文件D1(US 20040254215),D2(CN 201310302822.0),D3(WO 2013013609),晶型A主要相关专利及有关信息见表3。

根据晶型专利申请的审查过程看,对于新颖性申请人很容易就克服,只要给出数据认为与D1(US20040254215)中公开的化合物晶体形式不同即可克服;对于创造性质疑,申请人认为其晶型A具有较好的稳定性等也就是说具有更好的性能而具有创造性,这一观点也被审查员予以接受,且申请人还证明对比文件D3(w0 2013013609)公开的为错误信息,实际上没有公开罗沙司他晶型任何相关信息而对其申请的晶型的创造性无影响,也被审查员接受,最终获得授权。从整个审查过程看,晶型A的创造性存在可争议性,但仍然被答复通过。同时,根据审查过程中采用的对比文件看,对于罗沙司他晶型A,相关的现有技术较少,且还存在可能错误的信息,对于要无效专利来说,是一种不利的现况。
2.4 其他有关专利分析
如前所述,罗沙司他除了存在晶型专利外,还存在制剂、工艺和使用方法等专利,其中,工艺、制剂和使用方法专利都直接或间接地与晶型相关,如使用不同晶型可因晶型不同存在不同性质而采用不同处方,得到不同制剂产品,且晶型不同,则原料药制备工艺需要调整,也会导致工艺可能与专利工艺不同;另外,原研公司保护的使用方法专利是与晶型相关。因此,如能够规避晶型,则使用方法专利可相应规避。此外,工艺专利和部分使用方法专利与晶型专利属于同族专利同时到期;而制剂专利是更迟递交的申请,目前还在审查过程中,若其授权则到期时间比晶型专利更迟,如不能规避只能进行无效才能使仿制药尽早上市,这样对相关专利都进行无效,将面临较多的诉讼,较高的诉讼时间成本和费用成本。
综合上述分析和面临的各种现况,重点考虑中国市场,同时需要兼顾美国等市场,结合申报法规,认为对晶型专利采用开发新晶型以规避专利比较适宜,这样将来在美国即会涉及第四段声明,侧重于不侵权,既有ANDA获得市场独占的资格,也可以避免更多的诉讼费用等。
罗沙司他化合物专利到期相对较早,而其晶型专利到期相对较迟且与其他专利有较大关联,规避晶型专利从而突破专利限制,有利于罗沙司他仿制药的整体开发和各种成本控制,具有较高的实用性和可行性及经济价值预期。
3、罗沙司他晶型专利的规避方法
为了尽早上市仿制药,降低风险和费用成本等,综合考虑后认为开发新晶型是一种较好的选择,于是进行了新晶型的筛选研究工作。我们使用了多种方法,包括在多种溶剂中,不同条件下结晶,不同的滴加溶剂的方式,微波、超声等多种条件下结晶,发现可以得到某些新晶型;但通过对新晶型的性质研究发现,所得的新晶型更易转变为晶型A,即筛选得到的新晶型不适于开发为制剂,不具有成药性,此种方式不可行。因此,仍然需要筛选其他晶型或者采用其他方式开发可供使用的原料形式。
我们查阅药品领域内的专利、文献后发现,关于复合物,固体分散体的专利申请很多,关于共晶的专利申请也有一部分,但相对其他类型显得较少。由此产生一些想法,即是否可以开发共晶,既规避了专利又提升自我竞争力?而开发共晶是否可行和是否有法规支持,我们查阅了FDA的有关法规条款,发现FDA发布的《药物共晶的监管分类》修订指南草案,提供了关于共晶固态形式的监管分类等信息。FDA在指南中表示“共晶是由2种或更多不同分子,通常是药物和共晶形成物在相同的晶格中组成的结晶物料。共晶可以根据需要用于增强药品生物利用度和稳定性,以及在药品制造过程中提高API的可加工性能。其第二组分是非易失性。
根据美国安全物质特别委员会数据库(Selectcommittee on GRAs substances,sc0Gs),结合FDA相关法规、指南,认为可尝试采用氨基酸和常用的食用酸物质,糖类物质、酰胺物质等物质作为共晶形成物。最终通过实验,我们获得了多种共晶,也发现了稳定存在的和溶解度比罗沙司他晶型A更好的共晶。溶解性较好,有利于药品的溶出和体内的生物利用度,意味着具有较好的制剂可行性。
通过对专利挑战制度、罗沙司他药物的专利布局情况、侵权和无效可能性等的全面分析,我们选择了规避晶型专利的策略;而通过研究药品专利文献和FDA法规及安全物质相关的数据库,制定采用开发共晶的具体方式,最终结合实验,筛选寻找到具有较好稳定性和较好溶解度性能的共晶,为制剂的开发提供了一种可能选择。
4、结语
通过对罗沙司他相关专利的全面分析,综合考虑专利、法规、市场、项目进展预计等因素,制定了开发新晶型规避晶型专利及其相关专利的策略;采用以常用辅料,或者某些惰性物质,或者某些具有保健作用的物质,或营养助剂,或者具有某些辅助药物作用的物质为共晶形成物,与药品的活性成分一起形成共晶的方式,筛选到稳定性、溶解性比现有晶型更好的共晶这种非常规的新晶型,规避了晶型专利障碍;又能够保证药效,甚至可以提高药效。这种策略和方法,突破了专利限制,提升了企业自身实力,提高了产品竞争力,可以获得较好的市场价值,为规避专利和新晶型开发提供了一种新的思路和方法;但仍然存在一些疑问有待进一步研究、解决。
罗沙司他与其他物质的共晶体,作为药物活性成分的一种形式,在已有的上市药物中,暂未见类似情况,因此原料药如何控制质量标准是未知的尝试,还需要进一步研究;共晶体药物活性成分在药品申请上市的行政法规审批中如何看待,仿制药公司如何安排及安排哪些实验提供哪些实验数据,如何撰写申报资料满足法规要求都没有明确法规规定,没有可参考实例,如何配合法规要求还需要细致研究。

来源:Internet


