您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-01-27 10:37
辅助生殖用医疗器械的使用贯穿辅助生殖技术的全流程,包括人工授精、取精取卵、胚胎的体外培养、囊胚移植等,这些技术环节都需要使用辅助生殖用医疗器械才可以完成操作。这类产品种类丰富,既包含操作所需的高分子材料导管类产品、器皿类产品、穿刺针类产品,也包括液体培养液类产品、机电设备类产品。
近年来,我国药监部门从分类管理、行业标准制定、质量控制技术、注册技术审评等方面全方位加强对辅助生殖用医疗器械的监管,取得显著成效。
产品分类管理更加明晰
2017年8月31日,原国家食品药品监督管理总局发布新版《医疗器械分类目录》,辅助生殖医疗器械被纳入子目录18“妇产科、辅助生殖和避孕器械”范畴,细分为18-07-01 辅助生殖导管、18-07-02 辅助生殖穿刺取卵/取精针、18-07-03 辅助生殖微型工具、18-07-04 体外辅助生殖用液及18-07-05 辅助生殖专用仪器五大类产品。
其中,18-07-01辅助生殖导管类产品、18-07-02辅助生殖穿刺取卵/取精针类产品和18-07-03辅助生殖微型工具类产品作为Ⅱ类医疗器械管理,如胚胎移植导管、人工授精导管、次性使用无菌取卵针、单腔/双腔取卵针、卵母细胞采集器、睾丸穿刺取精器、附睾穿刺针、睾丸穿刺活检枪、体外受精显微操作管、显微吸液管、胚胎活检针、辅助生殖用培养器皿、玻化冻存管等。18-07-04体外辅助生殖用液按照Ⅲ类医疗器械管理,如卵泡冲洗液、配子缓冲液、取卵-胚胎处理液、囊胚培养液、卵裂胚培养液、洗精受精液、精子梯度分离液、精子显微操作液、胚胎移植液、精子洗涤培养液、冷冻解冻液、玻璃化冷冻液、玻璃化解冻液精子制动液、卵母细胞体外成熟培养液、培养用油、器皿冲洗液、胚胎活检液、受精培养液等。18-07-05辅助生殖专用仪器中带激光系统辅助受精卵孵化功能的按照Ⅲ类医疗器械管理,如辅助生育激光系统;18-07-05 辅助生殖专用仪器中用于观察、培养、提供洁净操作环境的仪器按照Ⅱ类医疗器械管理,如显微注射用显微镜、时差倒置显微镜、胚胎培养箱、时差培养箱、辅助生殖用恒温台、程序冷冻仪、程控降温仪、体外受精(IVF)超净工作台、阴茎勃起多参数定量分析仪、阴茎勃起监测仪、阴茎硬度测量仪、自动精液采集仪。
行业标准制定国际领先
由于辅助生殖用医疗器械多与配子、合子及不同细胞阶段的胚胎相接触,使其安全性特别是对子代远期影响的潜在风险更引人关注,需要一系列的标准来规范相关医疗器械的设计开发、生产、检验、安全性评价,强化风险控制与管理,为监管提供强有力的技术支撑,保证该类器械的安全性及有效性。
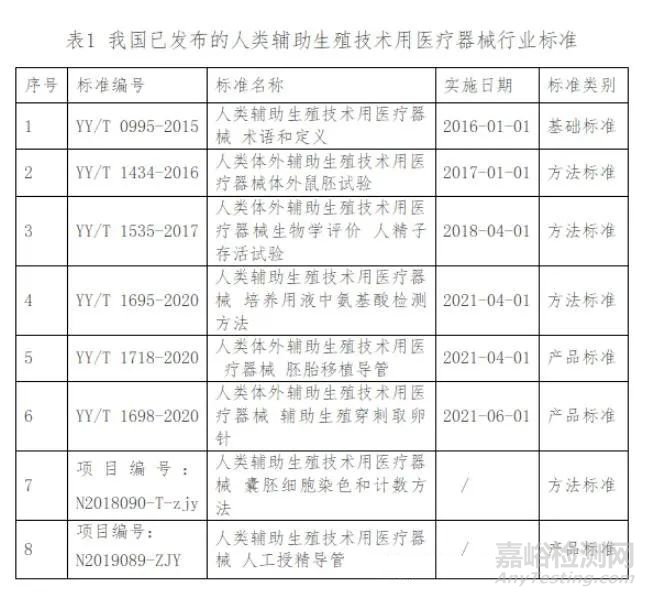
2014年,国家药监局批复由中国食品药品检定研究院(以下简称中检院)作为人类辅助生殖技术用医疗器械标准技术归口单位,组建专家组,研究制定该领域的行业标准,开启了我国人类辅助生殖技术用医疗器械的标准化工作,对该类医疗器械产业发展起到了积极的指导与促进作用。至2020年12月,中检院已自行组织制定了部分人类辅助生殖技术用医疗器械行业标准8项,目前已发布6项,报批标准2项,已发布的6项标准中包含基础标准1项、方法标准3项和产品标准2项。具体标准信息统计见表1。
值得一提的是,这些标准全部由我国自主研发,且我国在该领域的标准制定工作已走在国际前列。已发布的标准涵盖产品的质量控制的急需领域,有助于支撑企业研发和科学监管。现阶段ISO或其他国际标准化组织中没有针对人类辅助生殖技术用医疗器械的专门技术委员会。我国自主研发制定的行业标准处于国际领先阶段
质量控制技术喜获进展
因辅助生殖用医疗器械直接与胚子和胚胎接触,其质量控制除了关注传统的安全性指标和生物相容性评价指标外,更应评价其对配子和胚胎的毒性。中检院作为标准技术归口单位,应产业质控急需,开发了有针对性的质量控制方法,将胚胎学操作技术和分子生物学技术引入临床前标准化检测方法的研究中,研制了评价产品胚胎和配子毒性的检测方法和标准,支撑产品的安全性和有效性评价。
目前,中检院已陆续自主研究开发了胚胎毒性评价体系、精子毒性评价体系、培养用液中成分及降解产物的表征技术等,此外还研究制定了器具类产品的通用技术要求、专用技术要求和试验方法。近5年,中检院共对274个产品开展了成分分析、生物学评价、胚胎毒性、精子毒性等检测。
将风险意识贯穿于产品进行质量控制方法研究中,研判风险、分析风险、建立评价风险的方法、制定控制风险的标准。本着这个原则,中检院针对辅助生殖用液类产品的生产用水的技术指标控制展开研究。研究证实了去除其中内毒素和核酸成分的重要性,为辅助生殖用液的水质选择和控制提供了依据。这些研究都为更好的对此类产品进行精准的风险监控和科学监管提供技术支撑。
注册技术审评日渐完善
为加强辅助生殖医疗器械注册工作的监督和指导,进一步提高注册审查质量,国家药品监督管理局陆续发布《人类体外辅助生殖技术用液注册技术审查指导原则》《辅助生殖用胚胎移植导管注册技术审查指导原则》和《辅助生殖用穿刺取卵针注册技术审查指导原则》。
2019年12月,国家药监局发布新修订的免于进行临床试验医疗器械目录的通告,新增12个类别的辅助生殖技术用医疗器械进入免临床试验目录,包括18-07-01辅助生殖导管、18-07-02辅助生殖穿刺取卵/取精针、18-07-03辅助生殖微型工具、18-07-04体外辅助生殖培养用油、精子密度梯度分离液、精子制动液、颗粒细胞去除液、体外辅助生殖用操作液、体外辅助生殖用冷冻/解冻液、18-07-05胚胎培养箱、时差培养箱、18-18-07辅助生殖用恒温台、程序冷冻仪、程控降温仪、体外受精(IVF)超净工作台。此举旨在贯彻落实《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》及国务院深化“放管服”改革相关要求。
注册技术审查指导原则的及时制定与临床评价的执行,为企业开展研发和申报工作提供了明确的路径。近五年,国内生产企业的此类产品获证数量明显增多,现阶段已有21个国内生产厂家的54个辅助生殖用医疗器械产品获得注册证。(作者单位:中国食品药品检定研究院)

来源:Internet


