您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-09-25 09:17
设计控制的概念始于FDA,FDA发现设计控制的不足是造成医疗器械召回的主要原因之一。此后,设计控制,采购控制,生产和过程控制构成了产品实现过程中的主要控制过程。
1. 什么是设计控制?
通过设计控制确保医疗器械满足
· 预期用途
· 用户需求
· 具体要求
确保医疗器械的设计能够有效的转换到生产制造。
2. 法规的要求
US CFR,Title21,Part820.30
适用于所有ClassII,ClassIII 医疗器械,及部分ClassI 医疗器械
ISO13485中第7.3章节
医疗器械生产质量管理规范第28条~38条
第二十八条 企业应当建立设计控制程序并形成文件,对医疗器械的设计和开发过程实施策划和控制。
第二十九条 在进行设计和开发策划时,应当确定设计和开发的阶段及对各阶段的评审、验证、确认和设计转换等活动,应当识别和确定各个部门设计和开发的活动和接口,明确职责和分工。
第三十条 设计和开发输入应当包括预期用途规定的功能、性能和安全要求、法规要求、风险管理控制措施和其他要求。对设计和开发输入应当进行评审并得到批准,保持相关记录。
第三十一条 *设计和开发输出应当满足输入要求,包括采购、生产和服务所需的相关信息、产品技术要求等。设计和开发输出应当得到批准,保持相关记录。
第三十二条 企业应当在设计和开发过程中开展设计和开发到生产的转换活动,以使设计和开发的输出在成为最终产品规范前得以验证,确保设计和开发输出适用于生产。
第三十三条 企业应当在设计和开发的适宜阶段安排评审,保持评审结果及任何必要措施的记录。
第三十四条 企业应当对设计和开发进行验证,以确保设计和开发输出满足输入的要求,并保持验证结果和任何必要措施的记录。
第三十五条 企业应当对设计和开发进行确认,以确保产品满足规定的使用要求或者预期用途的要求,并保持确认结果和任何必要措施的记录。
第三十六条 确认可采用临床评价或者性能评价。进行临床试验时应当符合医疗器械临床试验法规的要求。
第三十七条 企业应当对设计和开发的更改进行识别并保持记录。必要时,应当对设计和开发更改进行评审、验证和确认,并在实施前得到批准。
*当选用的材料、零件或者产品功能的改变可能影响到医疗器械产品安全性、有效性时,应当评价因改动可能带来的风险,必要时采取措施将风险降低到可接受水平,同时应当符合相关法规的要求。
第三十八条 企业应当在包括设计和开发在内的产品实现全过程中,制定风险管理的要求并形成文件,保持相关记录。
3. 设计控制框架
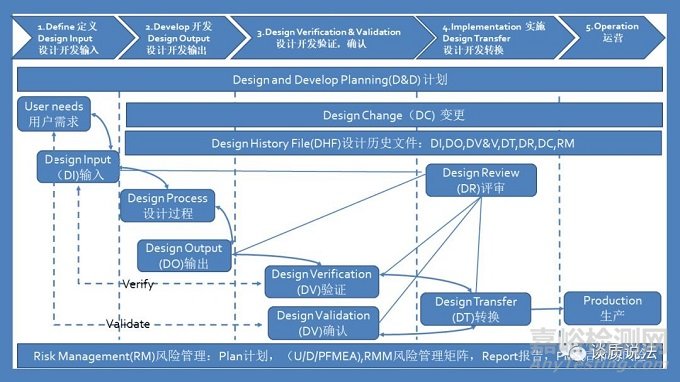
精心策划的设计控制流程是保证医疗器械能够满足预期用途、用户需求和具体要求的手段。

来源:谈质说法


