您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2019-03-19 09:12
中国医疗器械产品主要出口市场包含英国、美国、澳大利亚、加拿大、德国、韩国、日本等。办理医疗器械境外注册手续,大公司一般有自己当地的注册专员,资源有限的公司一般由第三方完成。基本的流程包括确定在某一国家/地区的分类,了解该地区的相关法规,做出注册方案(regulatory strategy),还要考虑临床数据的通用性等。由于各国医疗器械注册均有不同,本文将以美国、欧盟、日本、韩国等国为主,综合介绍医疗器械国外注册指南。
第一步:指定美国代理人
FDA被公认为是世界上最大的食品与药物管理机构之一。其职责是确保美国本国生产或进口的食品、化妆品、药物、生物制剂、医疗设备和放射产品的安全。
FDA规定,国外的医疗器械、食品、酒类、药品等工厂在进入美国之前必须进行注册,同时必须指定一位美国代理人,该美国代理人负责紧急情况和日常事务交流。
美国代理人是指在美国或在美国有商业场所,国外工厂为了进行FDA注册而指定其为注册代理人。美国代理人作为FDA和国外工厂之间的交流纽带,负责紧急情况和日常事务交流。当发生紧急情况时,FDA会联系美国代理人(除非注册时指定另一个作为紧急情况联系人),美国代理人代表国外工厂,FDA将视美国代理人的陈述为国外工厂的陈述,并且将会认为向美国代理人提供的信息或文件等同于向国外工厂提供了信息或文件。国外制造厂商只能指定一个人作为FDA工厂注册的美国代理人,为了进行工厂注册指定美国代理人不妨碍工厂为了进行其它商业活动而指定其他多个代理人(例如国外供应商)。
第二步:确定产品的分类
I类产品:“普通管理(General Controls)”产品,是指风险小或无风险的产品,如医用手套、压舌板、手动手术器械等,约占全部医疗器械的30%。FDA对这些产品大多豁免上市前通告程序。一般生产企业向FDA提交证明其符合GMP并进行登记后,产品即可上市销售。
II类产品:“普通+特殊管理(General & Special Controls)”产品,其管理是在“普通管理”的基础上,还要通过实施标准管理或特殊管理,以保证质量和安全有效性的产品,约占全部医疗器械的62%。FDA只对少量的II类产品豁免上市前通告程序,其余大多数产品均要求进行上市前通告(510K)。生产企业须在产品上市前90天向FDA提出申请,通过510K审查后,产品才能够上市销售。
III类产品:“上市前批准管理(Pre-market Approval,PMA)”产品,是指具有较高风险或危害性,或是支持或维护生命的产品,例如人工心脏瓣膜、心脏起搏器、人工晶体、人工血管等,约占全部医疗器械的8%。FDA对此类产品采用上市前批准制度,生产企业在产品上市前须向FDA提交PMA申请书及相关资料,证明产品质量符合要求,在临床使用中安全有效。FDA在收到PMA申请后45天内通知生产企业是否对此申请立案审查,并在180天(不包括生产企业重新补充资料的时间)内对接受的申请做出是否批准的决定,只有当FDA做出批准申请的决定后,该产品才能上市销售。
第三步:注册
在指定美国代理人及明确了产品分类信息后,企业就可以着手准备有关的申报资料,并按一定程序向FDA申报以获取医疗器械FDA认证批准。对于任何产品,企业都需进行企业注册(Registration)和产品列名(Listing)。
在明确申请工作内容后,还要明确产品是否符合强制标准(一般要求检测机构的正式检验报告)。
在准备510(K)申请文件前,需考虑是否真正需要递交、何时递交以及递交哪一种性质的510(K)申请:常规510(K)、特殊510(K)、简化510(K);申请上市产品分类和管理要求。
需提交的资料
1. 申请函,此部分应包括申请人(或联系人)和企业的基本信息、510(K)递交的目的、申请上市器械的名称型号和分类资料、进行实质等效比较的产品(Predicate Device)名称及其510(K)号码;
2. 目录,即510(K)文件中所含全部资料的清单(包括附件);
3. 真实性保证声明,对此声明,FDA有一个标准的样本;
4. 器材名称,即产品通用名、FDA分类名、产品贸易名;
5. 注册号码,如企业在递交510(K)时已进行企业注册,则应给出注册信息,若未注册,也予注明;
6.分类,即产品的分类组、类别、管理号和产品代码;
7.性能标准,产品所满足的强制性标准或自愿性标准;
8.产品标识,包括企业包装标识、使用说明书、包装附件、产品标示等;
9.实质相等性比较(SE);
10.510(K)摘要或声明;
11.产品描述,包括产品的预期用途、工作原理、动力来源、零组件、照片、工艺图、装配图、结构示意图等;
12.产品的安全性与有效性,包括各种设计、测试资料;
13.生物相容性;
14.色素添加剂(如适用);
15.软件验证(如适用);
16.灭菌(如适用),包括灭菌方法的描述、灭菌验证产品包装和标识等。
注意
1.对申请过程中FDA所提出的问题应及时给予书面的、及时的回答;
2.所有递交FDA的资料企业需留有备份,因为FDA在收到申请资料后即电子扫描登录,同时销毁申请资料,并不归还企业。
3.对少部分产品,FDA将对企业进行现场GMP考核,企业需参照美国GMP管理要求,并在FDA现场审核时配备合适的、对GMP和企业有一定了解的翻译人员;
4.指定的与FDA的联系人需对FDA法规和工作程序有一定的了解,并能与FDA直接交流,以方便及时反馈,企业可明确自己或委托咨询机构负责与FDA的日常沟通。
注册流程
完整的注册流程如下图。
上图为三个种类的医疗器械的注册流程,各类具体情况不再赘述。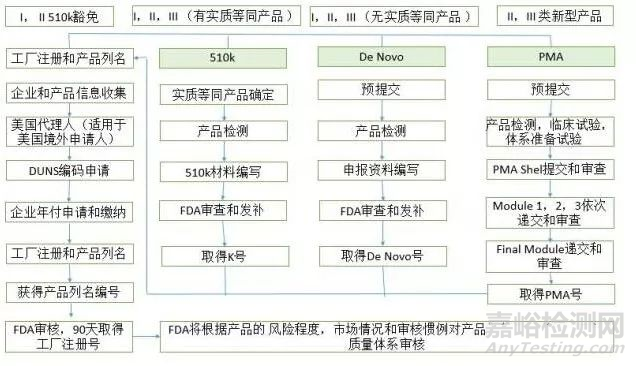
注册情况查询
注册进度查询
如需查询注册进度请登录FDA官网:http://www.fda.gov/default.htm。
最近批准查询链接
http://www.fda.gov/MedicalDevices/default.htm,在栏目:Approvals & Clearances 下有
· Recently-Approved Devices
· 510(k) Clearances
· PMA Approvals
国内正在注册的体外诊断试剂,在FDA上市的情况:https://www.fda.gov/MedicalDevices/DeviceRegulationandGuidance/Databases/default.htm。

来源:AnyTesting


