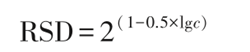分析方法的质量是药品质量控制中的重要研究内容,开发稳健可靠的分析方法是药品研发人员的关 键目标之一。各国药典及国际组织均先后颁布了有 关分析方法的指导原则,这些指导原则涵盖了分析方法生命周期的各部分,包括方法开发、验证、确认、转移等。
判断分析方法是否能满足其预期用途,是方法验证所要探讨的核心问题之一,在 2015 版和 2020 年 版《中华人民共和国药典》(以下简称《中国药典》) 中增加了对此问题的解决思路,即采用 Horwitz 方程作为接受标准 。 然而,被国内广泛接受并使用的 Horwitz 方程具有一定局限性,且 USP 也已经放弃使用该方程作为方法性能的判断标准。
本文在简要概述 Horwitz 方程内容的基础上,探讨了使用 Horwitz 方程作为判断方法满足预期用途的不足之处,并介绍最新研究的可行方式,以用于替代 Horwitz方程在方法验证接受标准中的作用。
1、 Horwitz 方程概述
1980 年,Horwitz 等对1000 多个实验室间的 实验结果进行了比较研究,发现方法的重现性相对标准偏差(RSD)和分析物的浓度水平之间的关系,可 以用如下公式表示:
公式中 RSD 为实验室间的相对标准偏差,即方法重现性 RSD,c 为分析物的质量或浓度分数(例如被分析物浓度为 1 mg•g-1 时,c=10-3)。
Horwitz方程在发现之初是作为重现性RSD的经验描述,它关注的是方法在不同实验室使用过程中的精密度。同时还衍生出了 Horrat 值以用于评估实 验室间比较的质量,该值给出了分析物的特定水平下测量方法的实际测量精密度与 Horwitz 方程的预测值的比较,公式如下[3]:
通常来说,Horrat 值越小表示实验室间的精密度越让人满意,当 Horrat 值大于 2 时,则认为该分析方法的变异太大或者说大于根据 Horwitz 方程 计算的预期变异,因此一般建议将 Horrat 值设定在 0.5~2.0之间作为可接受标准。据此,在为方法性能提供可接受标准时,期望实验室间的方法变异值在 Horwitz方程所计算RSD的0.5~2倍之间。
Horwitz 方程提出后,逐渐得到认可,并被部分法规所采纳。其中最主要的是 ISO13258,它将 Horwitz 方程预测值作为实验室分析能力的判断标准[5]。此外,《中国药典》2020 年版将 Horwitz 方程作为方法验证中准确度和精密度的可接受标准; 甚至有人建议使用 Horwitz 方程的结果作为测量 确定性的估计,Horwitz方程的应用范围被逐渐扩大。
然而,根据下面第 2 部分的分析,作者建议分析人员可以使用 Horwitz 方程来对方法历史数据进行总结评估,但不应将其用作方法验证的可接受标准,或者使用此代替对实验结果的不确定性进行估计。
2、 Horwitz 方程的局限性探讨
2.1 未包含所有变异来源
Horwitz 在后期对更多数据集进行了分析,发现其结果与 Horwitz 方程的预测值相差很大。并且在 Horwitz 的原始论文和一些后续论文中,虽然证明了分析物的浓度水平是解释实验室间方法重现性的最重要变量,但从未论述过此方程的计算结果涵盖了所有方法变异,即 Horwitz 方程的预测值不能包含所有的方法影响来源(见本部分第 3 条),而这正是 Horwitz 方程不能作为方法验 证接受标准的原因之一。
Linsinger 等人针对 Horwitz 论文中有关真菌毒素测定的数据,进行了重新分析,建立了浓度与重现性 RSD 的回归方程,并将此方程与 Horwitz 方程进行比较研究。结果显示,Horwitz 方程完全落在了回归方程的 95% 置信区间之外,并且回归方程的决定系数 R2 为 0.22,这表明 Horwitz 方程能解释的 RSD 只有 22%。因此尽管浓度肯定会影响重现性,但几乎 80% 的重现性无法用 Horwitz 方程解释。
另一项针对膳食纤维方法的验证数据回顾性研究也表明:Horwitz 方程不能有效预测其研究 结果。在研究的 391 项分析数据中,只有 16% 的 Horrat 值低于 2,这意味着如果将 Horrat 值作为可接受标准,那么将有 84% 的结果会被拒绝。
此外,Horwitz 对此方程的优势和局限性一直持有开放性态度,承认了 Horwitz 曲线并非普遍适用于所有分析物。对于某些种类的化合物,例如水分和灰分的测定等,Horwitz 方程均不适用。上述文献说明,在针对具体检测项目时,Horwitz 方程有明显不足。因此将 Horwitz 方程作为判断方法是否满足其“预期用途”的通用标准或依据,具有很大风险。
2.2 缺少不确定度
如果仅仅根据 Horwitz 方程, 计算得到的是确定的 RSD 单值,但实际上根据文献中的回归方程,RSD 具有不确定性,Linsinger TP 等人建议纳入预测区间以确定 RSD 的范围。而 Horwitz 方程恰恰忽略了方法性能评估中的不确定度。
使用 Horwitz 方程的预测结果计算测量不确定度的做法,也与 ISO所要求的测量不确定度评估方法相矛盾。不确定度计算的基本思想是收集有关特定 测量的信息,并在理想情况下评估所有不确定因素的贡献。当从方法验证数据中计算了变异度后,应使用一些常规的质量保证工具(如质量控制图)将实际测量结果与方法性能标准联系起来。但使用 Horwitz 方程结果作为 RSD 的评估标准,切断了实际测量值和不确定度估值之间的关系,这意味着 Horwitz 方程的结果很可能不是测量不确定度的准确估值。
2.3 未联系产品限度范围
如果仅以 Horwitz 方程得出的计算结果作为方法是否能满足预期用途的依 据,而未与产品或检测项目的限度范围相联系,可能会导致如下后果:
(1)如果所检测产品(检测项目)根据其安全性 、有效性 ,制定了较为宽泛 的限度范围 ,那么使用 Horwitz 方程的标准来评价方法是否满足预期用途, 会把一些不满足 Horwitz 方程标准,却仍可以保证产品准确检测的方法排除在外。这种情况,会对企业建立方法产生过多要求。例如,当某分析物在产品中的可接受上限是 100 μg·mL-1,根据 Horwitz 方程, 预测其在该浓度水平下的重现性 RSD 为 8%,即由检测方法导致的测定误差范围为 ±8 μg·mL-1。但若产品中该分析物的实际浓度水平在 10 μg·mL-1,此时根据 Horwitz 方程的预测结果,方法重现性 RSD 应为 11%,即由检测方法导致的测定误差范围为 ±1.1 μg·mL-1[11]。然而,由于 10 μg·mL-1 的浓度水平远低于确定的标准上限,指定如此高的精密度(±1.1 μg·mL-1)是没有必要的,不但会浪费更多的资源,而且对产品的质量控制过程也不能带来更高的益处。
(2)如果所检测产品(检测项目)根据其安全性、有效性,必须限定在较窄的限度范围,那么,这时使用 Horwitz 方程会指定过低的方法精密度和准确 度,从而无法保证产品的安全性或有效性。例如,《中国药典》对于原料药的含量测定,常见的限度范围是 标示量的 98% 以上,根据 Horwitz 方程,准确度(回 收率)在 98%~101%,重现性 RSD 值在 2% 内时,认为方法满足需求。这种宽泛的标准,使预期的方法变异已达到质量限度范围所允许的最大变异,而没有给产品的其他变异,如工艺波动、稳定性变化等留出余 地。若按照此标准进行控制,则这种方法的准确度和 精密度可能会导致产品不合格(OOS)的概率增大, 不利于产品的质量控制。若该方法是检测一个毒性很强的成分(现实需要规定更窄的限度范围),将导致严重的临床后果。
2.4 其他关键因素的忽略
根据 Horwitz 方程,方法的重现性 RSD 仅考虑了分析物的浓度,而忽视了分析物的种类、分析方法等因素的影响,举例如下:
(1)忽略了不同的产品或检测项目,其重现性 RSD 不同。Horwitz 本人曾讨论过分析物的影响,并 得出结论:与其他测定相比,霉菌毒素测定的重现性 较差。还有从广泛的观察结果发现,分析物的种类会 影响测量方法的重现性,在痕量金属中表现的尤其明显。
(2)忽略了同一产品属性的不同分析方法也会 影响到分析方法的重现性。显然,基于液相色谱的分 析方法往往比薄层色谱法具有更好的可重现性;操 作的复杂与否也会影响方法的精密度,简单的重量分 析例如干燥后的残留物测定,往往比涉及到复杂化学 操作的方法精密度更好。相信随着分析设备和分析方法的不断发展,方法的精密度将不断得到改善。
3、 讨论
分析方法是药品质量标准的关键要素,是保证检 测结果准确可靠的根本。而选择更加科学准确的反 映方法满足预期用途的标准是方法验证中必须回答 的问题。早期的方法验证文件,如 ICH Q2(R1),因当时的研究不充分,未给出相应的判定标准,亦有法规 进行了相应探讨。虽然有法规将 Horwitz 方程作为 理化方法验证的标准,但在实际应用中发现其存在明 显缺陷[14]。欧洲官方实验室(OMCL)也进行了相应 探讨,并从方法精密度的角度提出了判断标准[15],然 而该标准忽略了方法的准确度,也不够全面。作者认为下面2种方式更适于作为方法验证的判定标准。
3.1 容忍区间和预测区间满足预期用途的预判标准
该方式最早收载于 2018 年 USP 41-NF 36 中新 增的 <1210>,在 <1210> 中,对于定量类分析方 法,使用方法准确度 - 精密度联合评价的方式得到 方法检测结果的容忍区间和预测区间,将其作为方法 验证应提供的参数以评价其是否满足质量标准的要 求。该方式的思路是:建立新方法 - 方法验证找出 方法变异的范围 - 确定产品检测时的限度范围。但 对统计基础薄弱的药品专业人员而言,该方式具有(1)计算相对复杂;(2)比较抽象;(3)不知如何与已 有限度标准的产品直接关联评价,即,不知如何判定 该新建方法是否已经满足对现有产品的检测的预期用途等缺点。
3.2 方法能力指数
FDA 在 2015 版的方法验证指 南 中已经提到在评价方法性能参数如准确度和精 密度时,需要考虑到其具体用途,对于生产工艺中的 原料药和成品等,其样品要求是不同的。显然,对于质量标准里限度范围不同的产品,其所允许的方法变 异范围存在差异。2019 年,谭德讲等从已有产品 质量限度标准或预定期产品质量限度范围的角度出 发,提出了使用方法能力指数的概念,将产品质量中 的限度范围标准与方法总变异结合的方式对方法进 行判断。该方式还提出了检测方法的可靠性分级及 具体使用时产生方法误判概率的计算,使检测人员更易于理解。作者认为,方法验证中,通过提供上述 2 种方式的评价参数,可以更科学、全面地说明该方法对检测产品是否满足检测需求。