验证方案的起草与审批:
1. 验证目的
通过安装确认、运行确认和性能确认,确定该设备的安装、资料等符合预期要求;设备的运行符合说明书的设计要求;该设备按拟定的标准操作规程操作,灭菌器内温度分布均匀性及灭菌效果等达到使用要求,性能稳定、可靠。根据GMP要求制定本验证方案,作为对***型脉动真空灭菌器进行验证的依据。
2. 验证范围
适用于对计划安装于***生产车间***房间(编号: ),用于的***剂型的***用途的***型脉动真空灭菌器的安装、运行以及性能进行确认。
3. 验证职责
3.1. 验证委员会
l 负责所有验证工作的组织和领导。
l 负责对验证系统的风险评估结果进行审核和批准。
l 负责对验证中出现的偏差和验证结果进行分析讨论,并作出评价,决定再验证周期。
l 负责对验证系统的变更进行审核和批准
l 提出全厂的年度及长期验证工作计划,包括验证的项目,周期及时间安排等。
l 组织协调验证活动,提供验证所需资源,确保验证进度。
l 审批验证报告。
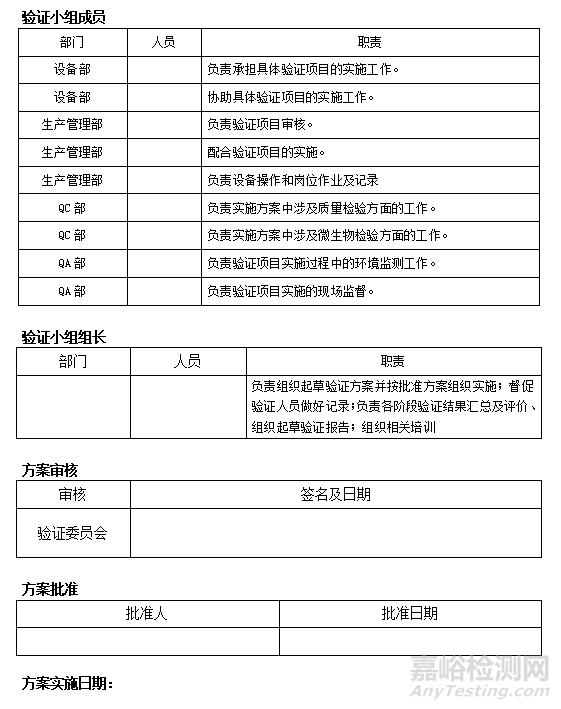
3.2. 验证小组
l 负责验证方案的制订、实施与协调,组织验证的相关培训。
l 执行并确认验证方案中的内容,并对实施过程中出现的结果进行分析,对出现的偏差填写“偏差调查处理表”,并上报验证委员会。
l 对验证系统的变更按照《变更管理规程》提出变更申请。
l 负责收集各项验证、试验记录并归入验证文件中。
l 准备和起草验证报告。
3.3. 设备部
l 负责设备的预防性维修、保养计划的制订和实施。
l 负责仪器、仪表的校准或检定。
l 负责为厂房、设施、设备验证工作提供技术指导。
3.4. QC部
l 负责对验证过程中的微生物检测,对方案中的检查结果进行审查及偏差分析。
l 负责完成验证过程中的试验记录。
3.5. QA部
l 负责对验证的结果进行审核批准
l 负责验证报告的编制和总结
l 负责验证文档的管理
3.6. ***车间
l 负责设备的操作,安排设备具体验证时间
l 负责设备的操作、清洁文件的制订,指定设备管理人员
l 负责提供被灭菌物品的种类和数量
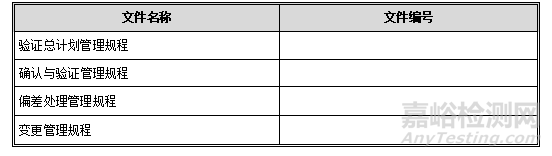
4. 验证指导文件
下列文件是验证的基础文件:
4.1. 内部文件
4.2. 相关法规文件
《药品生产质量管理规范》(2010修订版) 附录一:无菌药品
《自动控制压力蒸汽灭菌技术条件》(GB 8599)
《大容量注射剂、小容量注射剂灭菌器》(JB20001)
《药品生产质量管理管理实施指南》(2011年版)
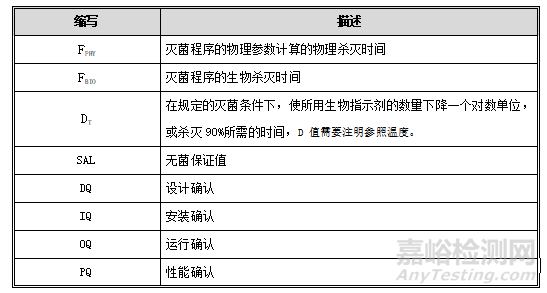
5. 术语缩写
6. 设备概述
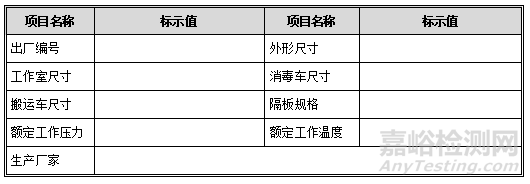
6.1. 主要技术参数
6.2. 管路原理示意图
图 1脉动真空灭菌器管路原理示意图(略)
6.3. 工作原理及模式描述
该灭菌器采用纯蒸汽对***进行灭菌,系统预置程序为织物灭菌程序和液体灭菌程序两种,具体程序内容如下所述,灭菌工艺控制使用PLC系统,温度控制系统使用Pt100探头,放置于灭菌器底部冷凝水排放口处。灭菌过程的温度自动控制、记录并可打印。……
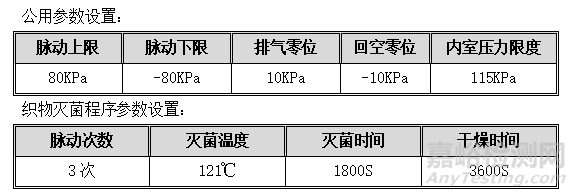
6.3.1. 织物灭菌程序
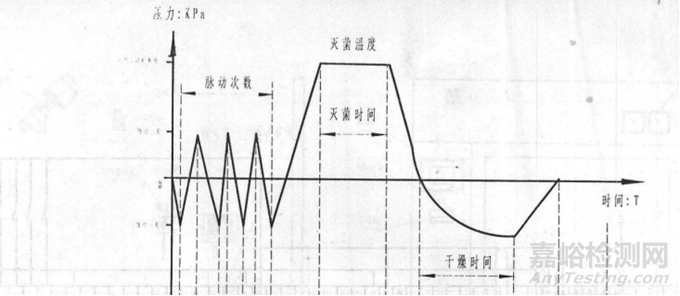
织物灭菌程序:可设置参数为脉动次数、灭菌温度、灭菌时间、干燥时间;灭菌步骤分为脉动、升温、灭菌、排汽、干燥、结束六个阶段。详见织物工作曲线图:
图 2织物工作曲线图
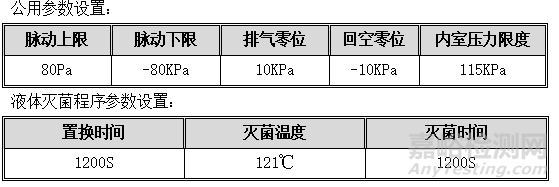
6.3.2. 液体灭菌程序
液体灭菌程序:可设置参数为置换时间、灭菌温度、灭菌时间;灭菌步骤为进汽升温置换、灭菌、慢排气、结束四个阶段。详见液体工作曲线图:
图 3液体工作曲线图
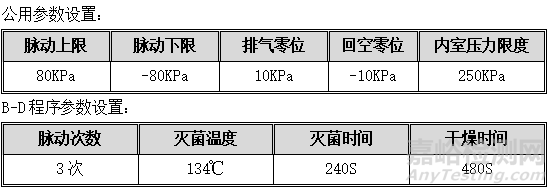
6.3.3. B-D程序
B-D程序:可设置参数为脉动次数、灭菌温度、灭菌时间、干燥时间;灭菌步骤分为脉动、升温、灭菌、排汽、干燥、结束六个阶段。工作方式与织物灭菌程序相同。
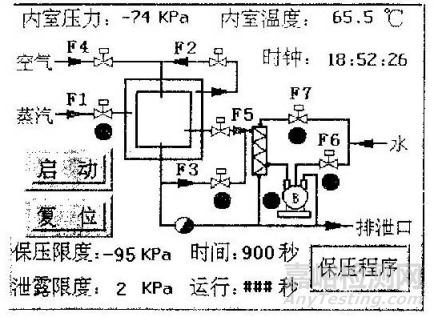
6.3.4. 保压程序
此程序用来检测管路的密封情况,可设置参数为:真空保压限度、真空泄漏限度、真空保压时间,操作画面如下:
图 4保压程序操作画面
7. 验证实施前提条件
7.1.各相关人员已经经过岗位培训且考核合格,见附表1 人员培训及考核确认记录。
7.2.各相关文件系统已编制完成并经过审批,见附表2 验证所需文件确认记录
8. 人员确认
验证小组成员和所有参与测试的人员均经过验证方案的培训,记录在附表3 验证方案培训签到表中。
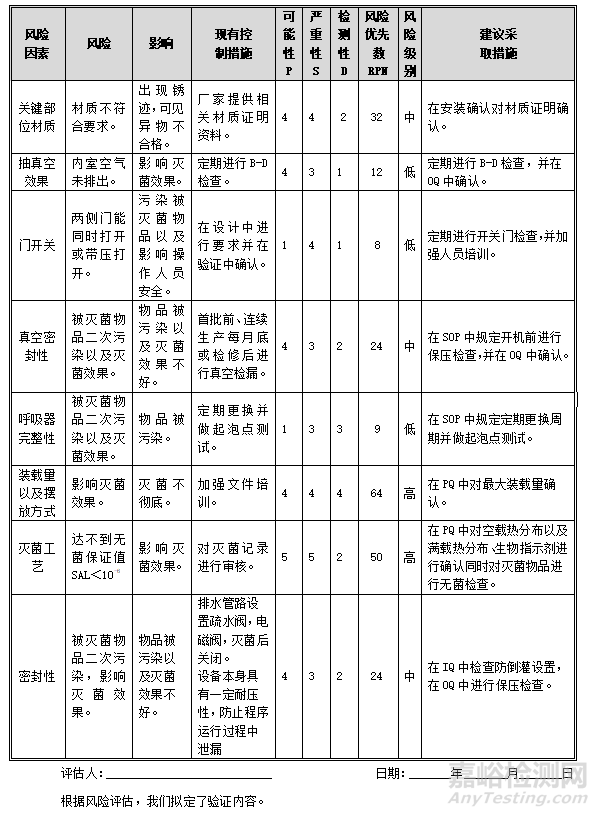
9. 风险评估
经验证小组人员共同对***型脉动真空灭菌器进行了风险评估,对存在的质量风险提出了预防和纠正措施建议,具体见下表:
10. 验证时间安排
设计确认时间安排:****年 **月 **日 至****年 **月 **日。
安装确认时间安排:****年 **月 **日 至****年 **月 **日。
运行确认时间安排:****年 **月 **日 至****年 **月 **日。
性能确认时间安排:****年 **月 **日 至****年 **月 **日。
验证报告起草时间:****年 **月 **日 至****年 **月 **日。
11. 验证内容
11.1. 安装确认
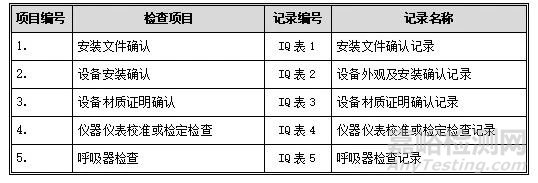
按照下表中的内容进行安装确认检查:
1. 安装文件确认
目的:对厂家提供的技术资料进行整理审查,确认资料的完整性。
程序:对厂家提供的安装资料进行整理并审核。
可接受标准:厂家提供的安装资料完整。
记录:见IQ表1:安装文件确认记录。
2. 设备安装确认
目的:确认设备按照”***型脉动真空灭菌器安装示意图”进行安装,安装位置是否正确,安装是否符合要求。
程序:检查设备到厂时设备外观,对照示意图纸及供应商提供的技术资料,检查设备的安装情况。
可接受标准:设备外观完好,与“***型脉动真空灭菌器安装示意图”一致。
记录:见IQ表2:设备外观及安装确认记录。
3.设备材质证明确认
目的:确认***型脉动真空灭菌器材质符合GMP及生产工艺要求。
程序:对厂家及相关方的提供的材质证明材料进行检查。
可接受标准:灭菌器内室、内室进汽管道和阀门、内车为316L不锈钢材质;灭菌室外壳、夹套进汽管道、外车为304不锈钢材质。
记录:见IQ表3:设备材质证明确认记录。
4 仪器仪表校准或检定检查
目的:确认脉动真空灭菌器中安装的所有仪器仪表经过检定或校准。验证过程中使用的所有仪器、仪表均经过检定或校准。
程序:对脉动真空灭菌器的安装的所有仪器仪表和验证过程中使用的所有仪器仪表进行检定或校准检查,并且对仪器仪表上的标识进行检查。
可接受标准:所有仪器仪表经过检定或校准,且全部在有效期内。所有仪器仪表上的检定或校准标识完整且信息准确。
记录见IQ表4:仪器仪表校准或检定检查记录。
5. 呼吸器检查
目的:确认脉动真空灭菌器安装的呼吸器的完整性,保证在冷却干燥过程中灭菌物品不会被空气二次污染。
程序:检查呼吸器更换及起泡点测试记录。
可接受标准:按照相关规程进行呼吸器更换及起泡点测试,测试合格。
记录:见IQ表5:呼吸器检查记录。
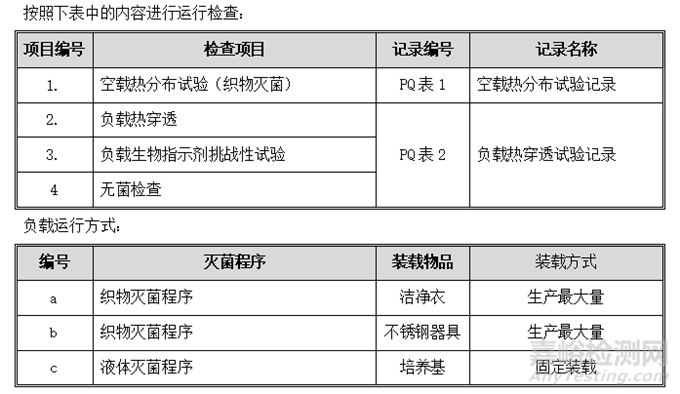
11.2. 运行确认
按照下表中的内容进行运行检查:
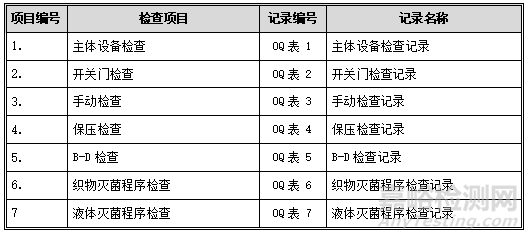
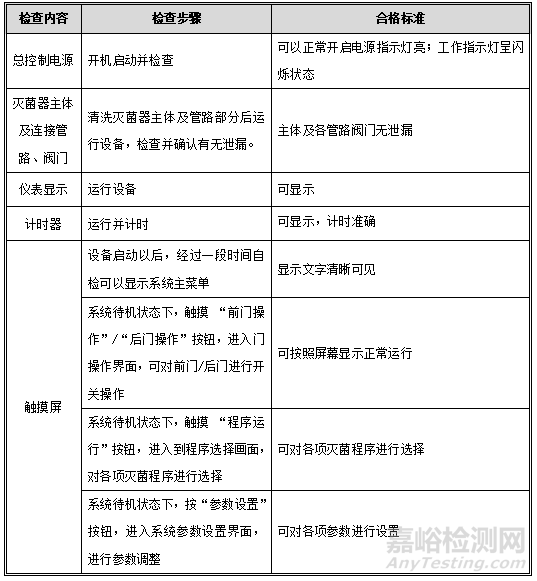
1. 主体设备检查
目的:确认主体设备可正常开启运行,各部件功能有效。
程序:按下表检查步骤逐步进行操作,并检查。
可接受标准:每项操作均应符合下表中的标准要求。
记录:见OQ表1:主体设备检查记录。
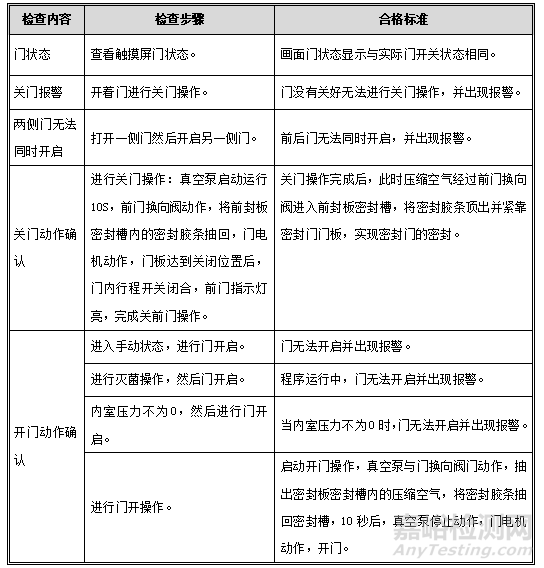
2. 开关门检查
目的:确认两侧门在不同状态下的开启和闭合状态及其控制程序,确认不能同时打开,并保证生产安全。
程序:按下表检查步骤逐步进行操作,并检查。
可接受标准:每项操作均应符合下表中的标准要求。记录:见OQ表2:开关门检查记录。
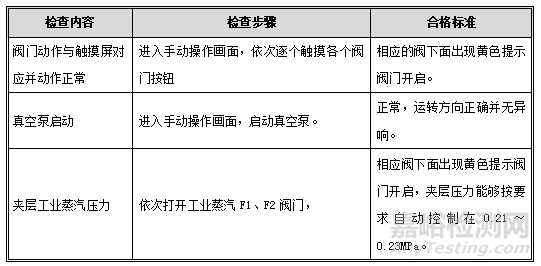
11.2.3. 手动检查
目的:确认在手动状态下,各个控制动作正常。
程序:按下表检查步骤逐步进行操作,并检查。
可接受标准:每项操作均应符合下表中的标准要求。
记录:见OQ表3:手动检查记录。
4. 保压检查
目的:确保在排除空气的过程中,渗入灭菌腔室的气体量不会干扰蒸汽的渗透并且在干燥过程中不会受到二次污染。
程序:设备为空载状态,进入保压程序,设定保压限度并运行:-95KPa,泄漏限度:2KPa,时间900秒。
可接受标准:保压15min后,真空度降低值不大于2KPa,三次检测均合格。
记录:见OQ表4:保压检查记录。
5. B-D检查
目的:测试脉动真空灭菌器空气排出效果,确保高真空多孔物品本身及其灭菌腔室内的空气能够成功排除。
程序:设备为空载状态,每次将1个B-D检查包放入小车最底层靠近内室排水口附近,进行B-D检查。参数设置如下:
可接受标准:测试图上的图案由原来的浅黄色变为均匀的深褐色或黑色,中央部分和边缘部分颜色一致,判为合格;图案不变色或变色不彻底,通常中央部分与边缘部分颜色浅,为不合格。
通过三次检查均合格。
记录:见OQ表5:B-D检查记录。
6. 织物灭菌程序检查
目的:确认设备的运行程序与使用说明书的描述相同。
程序:设备为空载状态,按照下表中的参数进行设置,并启动程序进行检查。
可接受标准:程序运行过程中的每项动作应符合下表中的要求。
记录:见OQ表6:织物灭菌程序检查记录。
7. 液体灭菌程序检查
目的:确认设备的运行程序与使用说明书的描述相同。
程序:设备为空载状态,按照下表中的参数进行设置,并启动程序进行检查。
可接受标准:程序运行过程中的每项动作应符合下表中的要求。
记录:见OQ表7:液体灭菌程序检查记录。
11.3.性能确认
相关术语描述
灭菌温度标准范围:121~125℃。
按照下表中的内容进行运行检查:

1. 空载热分布试验
目的:检查并确认脉动真空灭菌器在预定的灭菌条件下,腔室内的温度均匀性和灭菌介质的稳定性,测定灭菌腔室内不同位置的温差状况,确认灭菌器控制用传感器位于灭菌室内的最冷点。
程序
1.温度验证探头前校准:按照(SOP编号 )《温度验证仪标准操作规程》对验证用的16支温度探头进行校验,校验偏差范围为0.5℃:采用三点校验:111℃、121℃、131℃。
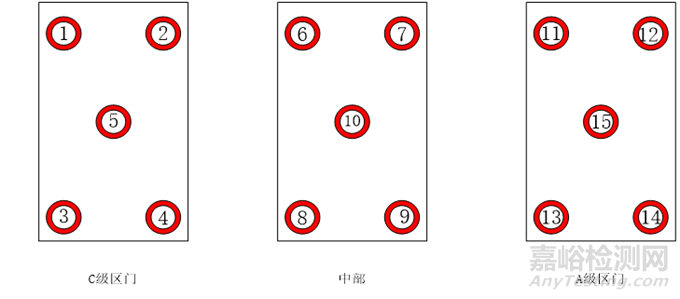
2.探头布置:在脉动真空灭菌器的内室内均匀分布16支温度探头,温度探头不得与内室接触,第16支探头放置温度控制探头处(排水口),详细布局图见下图:
3.测试运行:按照《XG1.D型脉动真空灭菌器标准操作规程》(草稿),开启织物灭菌程序,按自动程序运行(设置同11.2.5项下),运行过程中,通过温度验证记录系统对各点温度数据进行记录并绘出温度分布图,重复运行三次,以检查其重现性,设定数据采集周期为60S,设备控制探头打印时间设置为60S,设备系统时间与温度验证系统的时间一致。
4.温度探头后校准:按照(SOP编号)《温度验证仪标准操作规程》对验证用的16支温度探头进行校验,校验偏差(121℃)为≤0.5℃为合格:采用三点校验:111℃、121℃、131℃。
可接受标准
1、在灭菌时间段内所有温度探头的温度均在温度标准范围(121~125℃)内。(30分钟)
2、在灭菌时间段同一时刻各个探头的温度最大值与最小值的差值不超过2℃。验证过程中如果发现温度分布不符合标准,或使用后探头校准结果不符合规定,需要查找原因,进行调整后再重新连续三次验证,直至合格。
记录:见PQ表1:空载热分布试验记录。
2. 负载热穿透试验
目的:通过不同的待灭菌物品及不同的摆放方式确认受热最慢的负载(最冷点)能够在预定的灭菌程序中获得足够的无菌保证值。
程序
1.温度验证探头前校准:按照(SOP编号)《温度验证仪标准操作规程》对验证用的16支温度探头进行校验,校验偏差(121℃)为≤0.5℃为合格。
2.织物灭菌程序探头布置:在脉动真空灭菌器的内室内均匀分布16支温度探头并放置到物品最不容易穿透的部位,第16支探头放置温度控制探头处(排水口),布局图与空载热分布相同。
3.液体灭菌程序探头布置:在两个培养基桶内各放置7支温度探头,另外16号探头放至排水口附近,8号探头放置腔室内中心。
4.测试运行
◆ 开启灭菌程序,按自动程序运行,运行过程中,通过温度验证记录系统对各点温度数据进行记录并绘出温度探头分布图,不同灭菌程序、不同物品重复运行三次,以检查其重现性:
a:织物灭菌程序对洁净衣灭菌按生产最大量的装载方式进行热穿透三次;
b:织物灭菌程序按生产最大量的装载方式对不锈钢器具进行热穿透三次;
c:液体灭菌程序对无菌培养基进行满载装载各热穿透三次。
◆ 热穿透完成后对验证探头进行后校验:按照(SOP编号)《温度验证仪标准操作规程》对验证用的16支温度探头进行校验,校验偏差(121℃)为≤0.5℃为合格:采用三点校验:111℃、121℃、131℃。
合格标准
除了与空载热分布标准一致外,另需要满足以下要求:
1.验证温度探头前后校准合格。
2.最小F0值>12。
3.织物灭菌程序能够对洁净衣以及不锈钢器具达到干燥效果:展开洁净衣用手检查内外是否干燥一致;不锈钢器具干燥后目测容器内外无污迹并无可见水。
在验证过程中如果发现不符合标准,则应对灭菌器待灭菌物品进行重新摆放并再重新连续三次验证,直至合格。
记录:见PQ表2:负载热穿透试验记录。
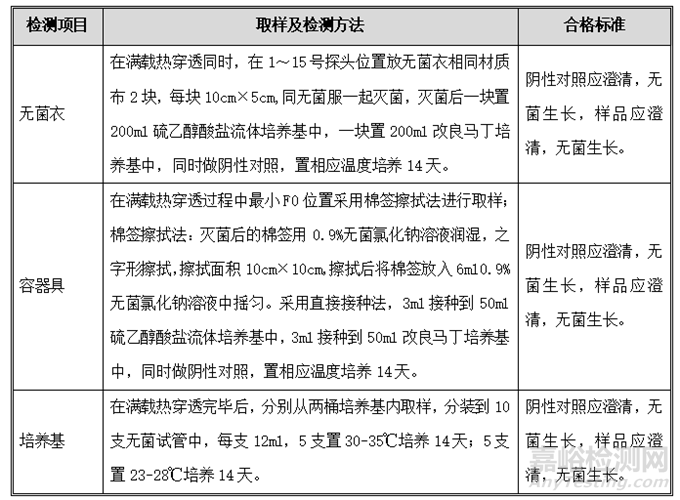
3. 负载生物指示剂挑战性试验
目的:确认物理杀灭时间FPHY和生物杀灭时间FBIO的一致性,为负载时各位置具有相同的杀灭效率提供证据。
程序
1.生物指示剂放置:生物指示剂挑战性检查与负载热穿透同时进行,在织物灭菌程序中生物指示剂放置位置与温度探头的位置相同,每个温度探头位置放置一支生物指示剂,每次负载热穿透后取出生物指示剂进行培养;在液体灭菌程序中每个桶内放置8支生物指示剂。另在呼吸器的灭菌下游测放置一支。
2.生物指示剂的培养和结果判断:灭菌结束后将生物指示剂折断后在56~58℃培养48小时,观察指示剂的颜色变化情况,如果培养液颜色由紫红色变成黄色,说明灭菌不完全;如果培养液颜色保持紫红色不变,继续培养2天,若无变色迹象,则可判断灭菌完全,同时作阳性对照试验并观察该阳性对照试验中指示剂的颜色由紫红色变成黄色。
可接受标准:经过灭菌的生物指示剂没有微生物生长,对照样品管呈阳性,有微生物生长。
记录:见PQ表2:负载热穿透试验记录。
4. 无菌检查
目的:确认在规定的灭菌工艺的条件下能够对待灭菌的物品达到灭菌效果。
程序:在进行负载热穿透试验的同时,按下表取出灭菌后相应的装载物品,进行无菌检查。
可接受标准:无菌检查的结果均应符合下表中的要求。
记录:见PQ表2:负载热穿透试验记录。
12、 偏差处理
将验证过程中发现的所有偏差记录在(记录编号)“偏差调查处理表”中, 并由验证小组提出解决方案,由验证委员会审核和批准偏差解决方案及其实施。
13、 风险的接收与评审
对判断的关键性风险和非关键性风险采取的初步风险控制措施若经检查确认符合要求,则其相应的风险可降至为可接受风险,确认结果记录在验证报告中。
14、 方案修改记录
在执行过程中,本方案若有必要修改,应由验证小组提出,经验证委员会批准后方可执行,并记录在附表4“方案修改记录”中。
15、 验证计划
a) 按照确认与验证管理规程进行再验证。
b) 设备需大修或主机更换时需进行再验证。
c) 每年对系统进行回顾分析,系统的回顾分析趋势需做验证时进行再验证。
d) 再验证周期:暂定一年。
16、 附件
附表1 人员培训及考核确认记录
附表2 验证所需文件确认记录
附表3 验证方案培训签到表
附表4 方案修改记录
IQ表1安装文件确认记录
IQ表2设备外观及安装确认记录
IQ表3设备材质证明确认记录
IQ表4仪器仪表校准或检定检查记录
IQ表5呼吸器检查记录
OQ表 1主体设备检查记录
OQ表 2开关门检查记录
OQ表 3手动检查记录
OQ表 4保压检查记录
OQ表 5 B-D检查记录
OQ表 6织物灭菌程序检查记录
OQ表 7液体灭菌程序检查记录
PQ表1 空载热分布试验记录
PQ表2 负载热穿透试验记录
附件 灭菌岗位操作记录