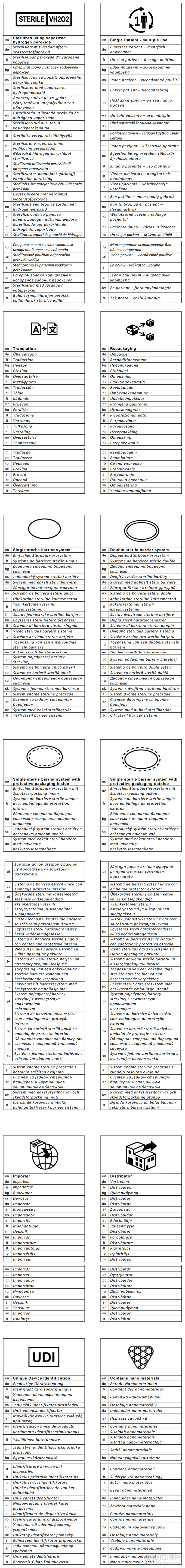
MDR法规要求在医疗器械的标签上注明各种信息。
欧洲有24种官方语言,这就需要根据器械提供的地方将标签上提供的信息翻译成多种语言。这个要求可以通过使用标识来处理。MDR 法规允许在标签上使用标识作为书面语言的替代品,具体法规信息在MDR Annex 1, chapter III中做了具体说明,标识是高效、节约成本和国际理解的概念,可向医疗器械用户传达所需信息。
2、欧盟法规下的要求明细
在MDR Annex 1, chapter III有关器械随附信息的要求, paragraph 23.2 标签上的信息中,概述了标签上必须包括的内容,并作为下列标识的立法参考:
以下标识可在ISO 15223-1:2021中找到。如果一个符号是在ISO 7000中注册的,那么它的数字引用将包括在符号标题旁边。否则,没有在ISO 7000中注册的符号只能在ISO 15223-1:2021中找到。
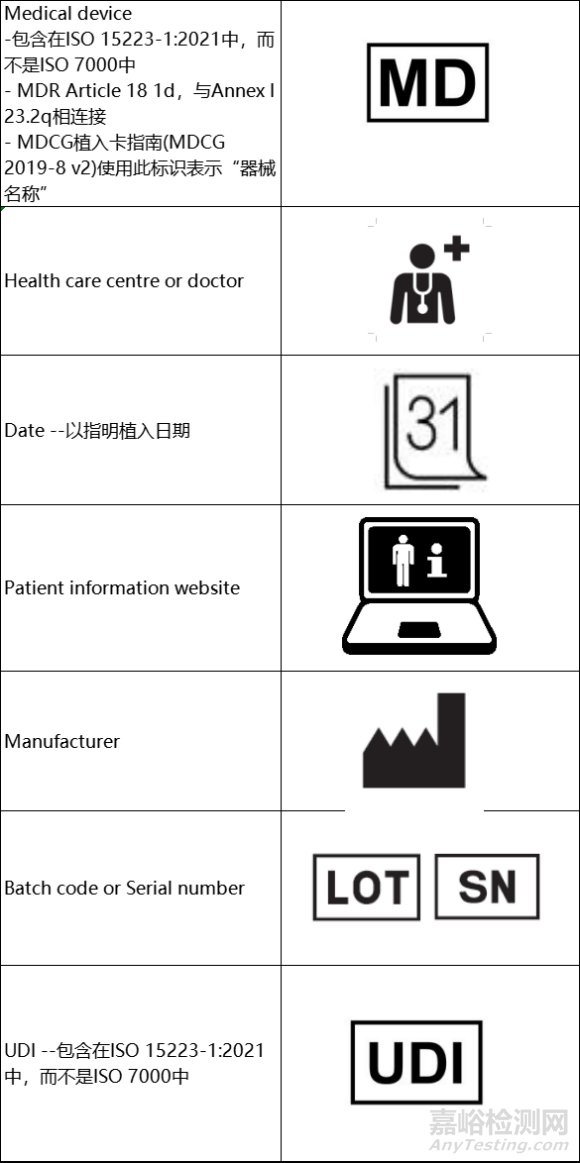
1. 医疗器械 MDR, Annex 1, 23.2, q.
2. 含有人类血液或血浆衍生物(3701) MDR, Annex 1, 23.2, e.
3.含有药用物质(3702) MDR, Annex 1, 23.2, e
4. 含有有害物质(3723) MDR Annex 1, 23.2.(f)
5.含有人源的生物材料(3700) MDR, Annex 1, 23.2, e.
-此标识表示其所贴的医疗器械包含源自人类的组织或细胞,或其衍生物
6. 含有动物源的生物材料(3699) MDR, Annex 1, 23.2, e.
-此标识表示其所贴的医疗器械含有动物源的组织或细胞或其衍生物。
7.使用蒸汽过氧化氢消毒 MDR ,AnnexI, 23.2, 1 .(灭菌方法)
8. 翻译(3728)& 9.再包装(3727)
•MDR Article 16 Point 3要求在器械/其包装或随附文件上提及这些活动:“进行第2段(A -包括翻译)和(b -包括再包装)所述活动的经销商或进口商应在器械上,或者在不可行的情况下,在其包装上或在器械随附的文件中注明所进行的活动及其名称,注册商号或注册商标,注册营业地点和可以联系它的地址,以便确定其位置。”
这些标识已被开发用于这些实体,以促进其遵守
10.单患者多次使用(3706)
建议使用当前的符号来表示“单患者多次使用的意思。
此符号是ISO 15223标准的一部分,也是ISO 7000数据库的一部分。它的使用得到了ISO和IMDRF文件中引用的支持。
•参考ISO 20417: 2021 Medical devices — Information to be supplied by the manufacturer and IMDRF 2019‘’Principles of Labelling for Medical Devices and IVD Medical Devices’’, Art. 5.2.18: ‘
11. 单一无菌屏障系统(3707)
12. 双重无菌屏障系统(3704)
13. 内置保护性包装的单一无菌屏障系统(3708)
14. 外部有保护性包装的单一无菌屏障系统(3709)
MDR AnnexI GSPR 23.3,保持器械无菌状态的包装上的信息(“无菌包装”),具体而言,该部分a)点:“允许无菌包装被识别的指示”形成了这四个标识被开发的要求。
15. 进口商(3725)& 16.经销商(3724)
进口商和经销商在MDR 下有新的义务,其中包括在标签上标明他们的活动与再包装和翻译有关(MDR Article 16)。开发这些标识是为了方便遵守MDR 。
17. UDI
MDR AnnexVI, Part C UDI系统,The UDI System, 4. UDI Carrier, 4.5”如非UDI载体的AIDC载体是产品标签的一部分,UDI载体必须易于识别。”
18. 含有纳米材料(3703)
MDR 越来越重视纳米材料(例如 AnnexI GSPR,chapter II, Article 10.6),虽然没有正式要求在标签上注明有关纳米材料的具体信息,但该符号的创建被认为是有用的。
3、标识验证和处理
根据ISO 15223-2流程(ISO 15223-2:2010-01 Medical Devices – Symbols to be used with medical device labels, labelling, and information to be supplied – Part 2: Symbol development, selection and validation)对上述标识1,2,4,6,8 -10进行了验证。验证在多个地区以五种语言运行,包括患者和医疗保健提供者。根据上述ISO 15223-2流程对剩余的新符号进行了验证。
所有符号在5毫米高度(与CE MARK要求的最低高度相同)可伸缩和识别。他们将确保医疗器械以有效的方式符合MDR ,并将向医疗保健专业人员和患者等最终用户清楚地传达相关信息。
4、标识注释:关于标识使用的注释
在欧盟,这些标识必须在符合MDR 23.1. h)直到它们以统一的欧洲标准出版。请注意,欧盟以外的司法管辖区可能对“制造商提供的信息”有不同的要求。
使用以下标签介绍中提供的模板时:
•如果制造商的特定需求不需要某些符号,可以从列表中删除全部或部分符号,但建议您始终保持所附列表中所示的相同顺序。制造商总是使用相同的订单将加快用户识别和接受符号及其含义。
•请确保始终使用与ISO 7000或ISO 15223-1:2021相同的标题(以避免用户之间的混淆)。
5、标识模板-标识设计、标题和翻译
以下内容包含的所有符号均可在ISO 15223-1(2021) 2021医疗器械-与制造商提供的信息一起使用的符号-第1部分:一般要求中找到。
6、患者植入卡使用的推荐标识
-作为文本的替代
-根据MDR Article 18的要求,推荐使用以下符号
-以下符号可以在ISO 15223-1:2021中找到。如果一个符号是在ISO 7000中注册的,那么它的数字引用将包括在符号标题旁边。否则,没有在ISO 7000中注册的符号只能在ISO 15223-1:2021中找到