引言
依据《注射剂项目研发生产策略全解析系列》(小试实验设计篇)得到的相关数据指导中试放大,但不能一味依赖小试实验数据,更需要考虑小试阶段所使用的设备、参数与车间生产设备的不同点,特别是运行原理不一致的设备如(1)机械搅拌和磁力搅拌,(2)陶瓷泵和蠕动泵,(3)饱和蒸汽灭菌和沸水灭菌,等等,所以许多参数在中试放大阶段需要重新考察。
本篇《注射剂项目研发生产策略全解析系列》(中试放大的重点考量)得到的数据为技术转移及工艺验证提供直接的依据,降低此阶段的风险。
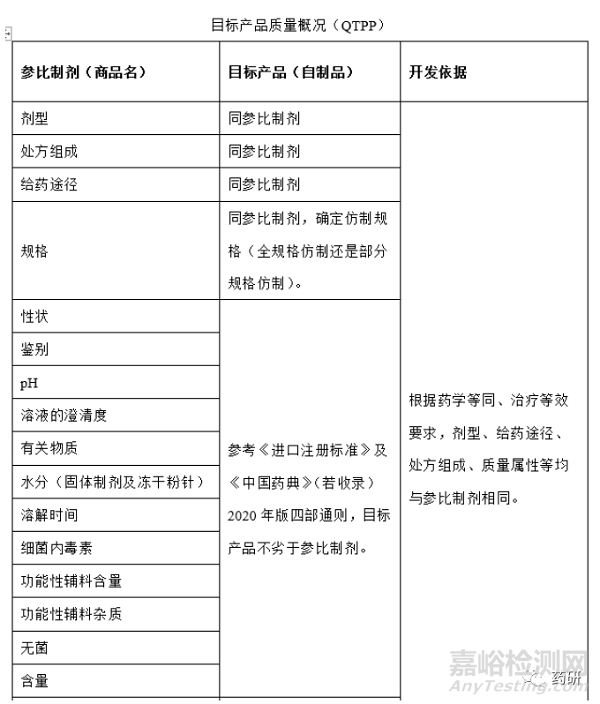
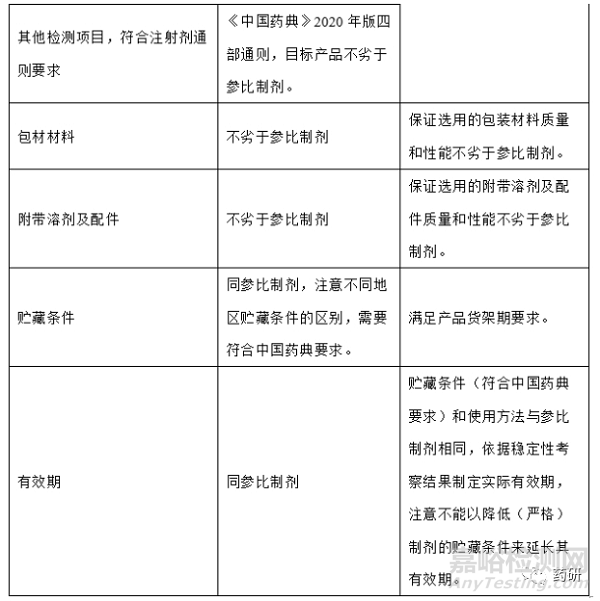
1、目标产品质量概况(QTPP)
根据参比制剂上市国药典(原料药和制剂项)、参比制剂国内进口说明书等资料,确定参比制剂处方工艺信息,未查询出来的处方工艺信息运用反向工程以确定,初步形成QTPP,根据小试实验数据完善QTPP,再次确定QTPP;举例如下:
2、工艺交接表
(1)工艺信息表
工艺信息表包括产品名称、产品规格、产品代号、批量(符合批量最低要求)、包装形式、装量、装量范围、中间产品和成品主药及活性辅料(如抗氧剂、抑菌剂)含量范围、中间产品密度、pH值范围、中间产品及成品存储条件、产品有效期等参数。
(2)生产工艺
①:处方信息,包括原辅料种类、用量及配制总量。
② :生产工艺信息一般包括:瓶处理工序、配制工序、灌封工序、灭菌工序、灯检工序、包装工序。
(3)工艺质控点
工艺质控点一般包括各工序的工艺参数、工艺控制点及质量控制点。
(4)毒理数据
查询该品种的毒理数据,计算出基于健康的暴露限度(HBEL),并根据该产品说明书,将HBEL、千分之一最低日剂量、10ppm、半数致死量LD50给到生产车间,用于计算产品的清洁残留数据。
3、产品质量草案
(1)中间产品质量草案
协同分析,根据检测项目及法规要求,并参考《进口注册标准》及《中国药典》(若收录)2020年版四部通则,完成中间产品质量草案。
(2)成品质量草案
协同分析,根据检测项目及法规要求,并参考《进口注册标准》及《中国药典》(若收录)2020年版四部通则,完成成品质量草案。
4、物料
需要准确的原辅包、过滤器的名称、在国家药品监督管理局药品审评中心的登记信息、规格/型号、生产厂家、密封/开封储存条件及稳定性等信息。
5、取样计划
(1)中间产品取样计划
制定完善的取样计划,一般包括密度、中间产品中控(一般包括性状、pH、含量等)、滤膜吸附(一般包括原料药、功能性辅料如抗氧剂及抑菌剂含量等)、微生物污染水平、理化(一般包括性状、pH、含量及有关物质等)、可见异物及生测(一般包括微生物等)药液存放时限验证、灭菌后无菌、内毒素方法学验证及检验。
(2)成品取样计划
制定完善的取样计划,一般包括灭菌后冷热点样品,用于全检、影响因素及方法学。
6、批记录
根据产品处方、工艺、取样计划及车间相应文件设备等信息与车间工艺员一同起草批记录。
7、中试放大
执行批记录,注意考察各工序的相关参数,可使用最差工况考察,完善产品工艺。
8、成品考察
取得的冷热点成品用于全检、影响因素及方法学,并与参比制剂对比,要求质量不劣于参比制剂。
9、数据总结
总结工艺参数、生产过程异常情况、中间产品及成品数据,需要重新研究的设计相应实验进行研究,评估如需要再中试则重新中试验证,最终得到的数据用于指导工艺验证。
10、总结
本篇《注射剂项目研发生产策略全解析系列》(中试放大的重点考量)需要全面关注产品生产工况及成品质量,如小试工艺参数的适用性并根据现场反馈及时调整、生产过程的异常情况及时处理、中间产品及成品数据及时分析,并与参比制剂对比,最终保证产品生产的顺应性,质量不劣于参比制剂,最终中试得到的数据可以用于指导工艺验证。
11、资料收集途径
1)https://db.yaozh.com/(药智数据库,很全面,90%以上的资料都有)
2)https://db.ouryao.com/(中国药典、法规及标准,查药品及检测标准等)
3)https://drugx.cn/ (药研导航,查各国药监局及药典等)
4)化学药品注射剂灭菌和无菌工艺研究及验证指导原则(试行)
5)《化学药品注射剂生产所用的塑料组件系统相容性研究技术指南(征求意见稿)》
6)化学药物(原料药和制剂)稳定性研究技术指导原则