您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2023-08-25 11:29
一次性使用腹膜透析导管用于对肾功能衰竭患者进行腹膜透析建立治疗通路,属于一次性使用无菌产品。
根据《医疗器械分类目录》,一次性使用腹膜透析导管的分类编码为10-04-04,管理类别为Ⅱ类。
一、一次性使用腹膜透析导管的结构组成
一次性使用腹膜透析导管通常由管路、连接端口、保护帽等组成。一般采用高分子材料制成。根据临床需要,产品的管路结构会有所不同。常见的产品结构包括带有双涤纶套的直管型(见图1)、卷曲管型(见图2)、鹅颈直管型(见图3)、鹅颈卷曲管型(见图4)等型式。所列图示不代表固定的结构设计,可以为其他设计类型。
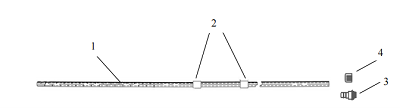
图1 直管型
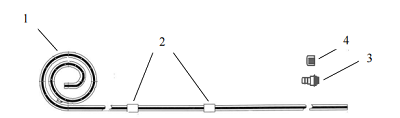
图2 卷曲管型
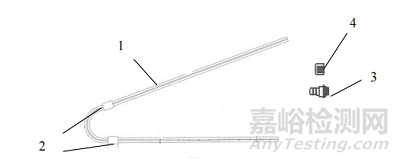
图3 鹅颈直管型

图4 鹅颈卷曲管型
1-管路;2-涤纶套;3-连接端口;4-保护帽
二、一次性使用腹膜透析导管的主要风险
除无源医疗器械已识别的共性风险外,对于一次性使用腹膜透析导管产品,至少还需关注以下危险(源):
1.设计
产品中管路组件的设计流量低于相关标准要求,会降低腹膜透析效率和质量。
2.原材料选择
产品中管路组件在自由弯曲或对折后易发生弯折或变形,导致临床使用时的流速降低;
原材料的生物学和化学危害,如材料与药物的相互作用、材料变更等产生的风险。
3.生产加工
腹膜透析导管的腹内段,存在过大的锐边、毛刺等,置入患者腹腔后容易划伤组织;
产品中各连接件密封不严,导致灌注或引流过程发生液体泄漏;
生产过程中的加工助剂残留;
产品未完全灭菌;
灭菌过程产生的有害物质(如环氧乙烷);
热原污染;
组件、成品缺陷。
4.产品说明书及标签
说明书中没有提供日常维护方法(如适用)、使用前的检查建议等信息;
没有维护或使用了不恰当或者不正确的维护方法;
产品或包装上标识不明确、不清晰,说明书编辑不当、未警示全部使用风险及注意事项所导致的使用风险。
5.临床使用
未遵循规定使用;
包装破损导致的无菌屏障破坏;
使用中保护帽组件意外脱落;
联合使用时,一次性使用腹膜透析导管全系统的密闭性无法保持。
三、一次性使用腹膜透析导管性能研究实验要求
1、性能指标
性能指标引用标准应当为现行有效版本,常见的参考标准包括:YY/T 0030《腹膜透析管》、YY/T 0586《医用高分子制品X射线不透性试验方法》、GB/T 15812.1《非血管内导管第1部分:一般性能试验方法》等,建议参考上述标准中适用条款制定产品的性能指标要求。如产品有特定设计,还需根据产品设计特征设定相应的性能指标,并将其列入产品技术要求。
产品技术要求中的性能指标包括但不限于以下几点。
外观:外表面、洁净度、无杂质;
尺寸;
流量;
抗弯曲性;
连接强度;
峰值拉力、座(如适用)、动力注射、侧孔、末端头端、透明度、标识等;
无泄漏;
射线可探测性;
无菌、内毒素;
耐腐蚀性(如适用);
化学性能(如管路为硅橡胶材质,应参考YY/T 0334适用部分)。
2、产品性能研究
应当开展产品性能研究,明确有效性、安全性指标的确定依据、所采用的标准或方法、采用的原因及理论基础等。
如产品预期与其他医疗器械产品联合使用,开发人应当开展证明联合使用安全有效的研究,如连接部位的适配性、长期使用时的阻菌性验证等研究。
如一次性使用腹膜透析导管产品为双层设计,考虑其临床应用中可能存在的断裂和分层的风险,开发人需开展产品断裂力、剥脱力和双层拉力性能的验证研究。如有除产品技术要求性能指标以外的其他特殊设计,需一并开展相关验证研究。
3、生物学特性研究
应对终产品与患者直接或间接接触的组件进行材料表征。参照GB/T 16886.1的要求,根据接触性质、接触时间判断产品的类别,对其进行生物学评价,生物学评价的终点可参考其附录A中“表A.1 生物学风险评定终点”。
一次性使用腹膜透析导管属于“植入医疗器械”中与组织直接接触的医疗器械,接触时间通常为持久接触。
应进行细胞毒性、致敏反应、刺激反应、热原、急性全身毒性、亚慢性毒性、植入反应、遗传毒性评价。
4、产品灭菌工艺研究
一次性使用腹膜透析导管产品以无菌形式提供,开发人应明确其灭菌工艺(方法和参数)和无菌保证水平(SAL),并开展灭菌验证及确认的相关研究。如采用的灭菌方法容易出现残留物,应当明确残留物信息及采取的处理方法,并开展相关研究。如产品或组件涉及两次或多次灭菌的情形,应当开展产品灭菌工艺耐受性的研究。
5、稳定性研究
5.1货架有效期
应当开展产品货架有效期和包装研究,证明在货架有效期内,在生产企业规定的运输贮存条件下,产品可保持性能功能满足使用要求,并保持无菌状态。
产品货架有效期的验证可选择加速稳定性试验或实时稳定性试验,具体需根据产品特性选择验证方式。无论加速稳定性试验还是实时稳定性试验,开发人均需在试验方案中设定测试项目、测试方法及判定标准。货架有效期验证项目通常包括产品技术要求中与有效期密切相关的条款,以及包装完整性。加速老化研究的具体要求可参考YY/T 0681.1《无菌医疗器械包装试验方法第1部分:加速老化试验指南》等标准。提交包装验证报告,常见验证项目包括但不限于:包装完整性、包装强度和微生物屏障性能等。
5.2使用稳定性
应当开展使用稳定性/可靠性研究,证明在生产企业宣称的使用期限内,在正常使用、维护条件下,产品的使用性能满足要求。
5.3包装及包装完整性
在宣称的有效期内以及运输储存条件下,保持包装完整性的依据。需开展产品包装验证和运输验证研究。运输稳定性应证明在生产企业规定的运输条件下,运输过程中的环境条件不会对医疗器械的特性和性能,包括完整性和清洁度等,造成不利影响。产品包装验证可依据有关国内标准进行(如GB/T 19633系列标准、YY/T 0681系列标准等),开展产品的效期末包装验证研究。在进行加速老化试验研究时需注意:产品选择的环境条件的老化机制需与宣称的运输储存条件下真实发生的产品老化的机制相匹配一致。对于在加速老化研究中可能导致产品变性而不适于选择加速老化试验方法研究的情况,需以实时老化方法测定和验证。
6.其他研究
如产品为列入《免于临床评价医疗器械目录》(以下简称《目录》)的一次性使用腹膜透析导管产品,开发人应当按照《列入免于临床评价医疗器械目录产品对比说明技术指导原则》的要求,将产品相关信息与《目录》所述内容的进行对比、产品与《目录》中已获准境内注册医疗器械进行对比,从基本原理、结构组成、性能、安全性、适用范围等方面,证明产品的安全有效性。

来源:嘉峪检测网


