您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-07-16 15:49
医用内窥镜是一个带有光源的管道,通过人体自然腔道或微创手术的小切口进入人体,帮助医生进行疾病诊断或协助手术的进行。内窥镜有多种分类方式:按产品结构可分为硬镜和软镜;按成像原理可分为光学镜、光纤镜和电子镜;按临床应用又可分为消化内镜、呼吸内镜、腹腔镜、关节镜等。本期文章我们主要跟大家分享一下医用电子内窥镜的国内注册相关事项。
PART 01 产品概述
电子内窥镜是指一种可插入人体体腔和脏器内腔进行直接观察、诊断、治疗的医用电子光学仪器。电子内窥镜的种类可以按预期作用部位来区分,也可以按是否可重复使用区分。按照适用部位分为支气管镜、十二指肠内窥镜、胆道镜等;按照成像维度可分为二维和三维内窥镜;按照可使用次数可分为一次性使用和可重复使用电子内窥镜;按照光源连接方式分为外置光源和内置光源内窥镜。常见种类一般按照预期作用部位分类,可分为腹腔内窥镜、上消化道内窥镜、输尿管肾盂内窥镜、大肠内窥镜、鼻咽喉内窥镜、支气管内窥镜等。
在结构上,电子内窥镜通常是一体式设备。组成包括头端部、插入部(镜管)、操作部等,其中头端需详细对比图像传感器的种类(如CCD或CMOS),插入部(镜管)需明确材质,操作部关注弯角功能、送水送气功能、吸引功能等。它采用尺寸极小的电子成像元件,将所要观察的腔内物体通过物镜光学系统成像到电子成像元件上,然后通过信号线将接收到的图像信号送到图像处理系统上,最后在监视器上输出处理后的图像,供医生观察和诊断。
依据《医疗器械分类目录》,电子内窥镜的分类情况如下:
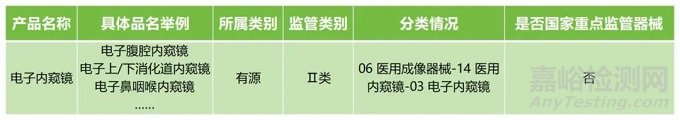
PART 02 注册法规和标准依据
《医疗器械监督管理条例》(国务院令第739号)
《医疗器械注册与备案管理办法》(国家市场监督管理总局令第47号)
《电子上消化道内窥镜注册技术审查指导原则》(2020年第87号)
《电子内窥镜同品种临床评价注册审查指导原则》(2023年第35号)
GB/T 42062-2022《医疗器械风险管理对医疗器械的应用》
……
国内适用于电子内窥镜现行有效的主要标准详见下表:
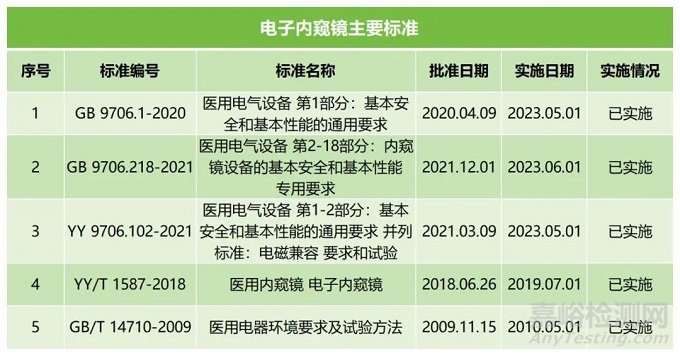
PART 03 注册情况和风险点
01 注册证数量和分布特点
电子内窥镜国产注册证(获证时间在2022年后的)约500张。主要分布在上海、广东、湖南、 浙江、江苏、北京、安徽、江西、重庆、天津、湖北;其中广东省124张。广东省内现有电子内窥镜相关生产企业40多家,分布前三地区分别为深圳市(20家),珠海市(9家),广州市(6家)。
02 风险点和存在问题
依据GB/T 42062-2022的要求,企业需要制定产品的风险分析管理文档。从产品的设计开发、生产制造、销售和售后服务等各环节遵循风险管理。过程包括风险分析、风险评价、风险控制、综合剩余风险可接受评价、生产和生产后的信息等。电子内窥镜在生产阶段和生产后的阶段已知和可预见的可能危险有以下几点:操作危害、电磁能危害、电能危害、机械能危害、生物学危害、信息危害等。
近年来,国内外多次报道电子内窥镜因设计缺陷、产品质量原因、材料老化、消毒不彻底等问题引起医疗事故频发。根据往年国家监督抽验情况,按标准要求,试验方法中应明确测试距离、背景亮度、摄影模式等试验条件,被抽样的企业出现产品技术要求中未明确试验条件情况。这反映出企业对电子内窥镜的行业标准的执行不到位,对标准中规定的检测方法不理解。产品技术要求在引用时出现错误,例如标称值错误的使用单位,这反映出企业对电子内窥镜行业标准的理解不到位。外包装上未体现生产日期等标签标识,这反映出企业对通用电气安全标准的理解不到位。相关企业应根据常见的问题,着重注意产品上述项目或功能完善。

来源:Internet


