一、 背景
在2020年版新的《药品注册管理办法》确立“基于风险启动的注册核查模式”以来,有两份文件最为重要,因为规定了注册核查启动的原则,以及启动核查之后的工作程序和流程。这两份文件分别为CDE制定的《药品注册核查检验启动工作程序(试行)》和CFDI制定的《药品注册核查工作程序(试行)》。
二、 注册核查的历史沿革:基于风险启动注册核查模式的确立
2.1 基于风险启动注册核查模式的确立发展过程
|
逢审必查模式 |
基于技术审评需要的注册核查启动模式 |
确立“基于风险启动注册核查模式” |
|
2007年版《药品注册管理办法》: 第五十八条省、自治区、直辖市药品监督管理部门应当自受理由请之日起5日内组织对临床试验情况及有关原始资料进行现场核查,对申报资料进行初步审查,提出审查意见。第六十条 国家食品药品监督管理局药品审评中心收到申报资料后,应当在规定的时间内组织药学、医学及其他技术人员对申报资料进行审评,必要时可以要求申请人补充资料,并说明理由。经审评符合规定的,国家食品药品监督管理局药品审评中心通知申请人申请生产现场检查。 |
《仿制药质量和疗效一致性评价工作有关事项的公告》 (2017年100号)十四条: 国家食品药品监督管理总局药品审评中心根据立卷审查情况提出有因检查和抽检的需求,由国家食品药品监督管理总局食品药品审核查验中心统一组织进行对研制现场、生产现场或临床试验数据的有因检查或抽样。《关于调整药品注册受理工作的公告》(2017年134号) 将药品注册受理调整为由NMPA集中受理,根据药品审评中心需求开展现场核查,核查节点提前,不再是技术审评完成后开展,由串联改为并联。 |
2020年版《药品注册管理办法》第四十六条药品审评中心根据药物创新程度、药物研究机构既往接受核查情况等基于风险决定是否开展药品注册研制现场核查。第四十七条 药品审评中心根据申报注册的品种、工艺、设施、既往接受核查情况等因素基于风险决定是否启动药品注册生产现场核查。2021年国家药监局药品审评中心发布《药品注册核查检验启动工作程序(试行)》 (2022年1月1日起施行]CFDI制定《药品注册核查工作程序(试行] 》等5个文件为适应《药品注册管理办法》中基于风险启动注册核查模式的具体要求,制定具体工作程序的配套文件。 |
2.2 基于风险启动注册核查的内涵
药品注册核查的目的或者说定位,是为了核实申报资料的真实性、一致性以及药品上市商业化生产条件,检查药品研制的合规性、数据可靠性等。不是全体系的药品生产质量管理规范检查。
2.3 基于风险启动注册核查关键点总结
基于风险启动的注册核查可以总结为3点:
● 基于风险启动
● 并联程序
● 检查主体:CFDI
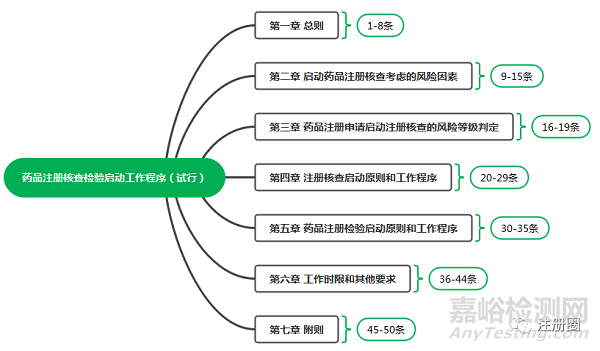
三、 《药品注册核查检验启动工作程序(试行)》的内容框架
注册核查工作程序(试行)》共有七章,50条,主要从启动的原则、程序、时限和要求进行规定。
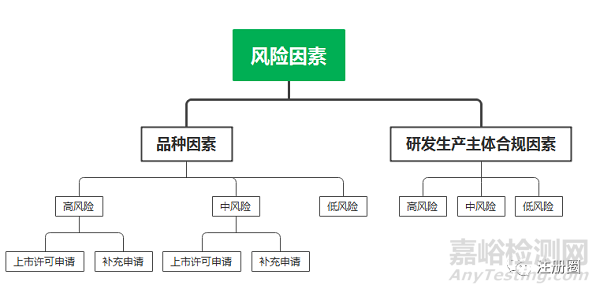
四、 启动药品注册核查的风险因素
启动药品注册核查的原则是基于风险,考虑的风险因素包括品种因素和研发生产主体合规因素。
4.1 品种因素高风险:
上市许可注册申请:
(1)化学药品创新药和改良型新药;
(2)中药创新药、改良型新药、古代经典名方中药复方制剂和中药注射剂;
(3)生物制品
(4)采用创新生产工艺或常规生产工艺中引入新技术,经评估可能增加风险的品种
补充申请:
(1)涉及生产工艺或生产场地重大变更的疫苗和血液制品以及细胞治疗产品等;
(2)涉及生产工艺重大变更的中药注射剂;
(3)变更生产工艺后采用创新生产工艺或常规生产工艺中引入新技术,经评估可能增加风险的品种
4.2 品种因素中风险
上市许可注册申请:
(1)脂质体、微球、微乳、长效或缓控释制剂、吸入制剂等复杂剂型;
(2)特殊化学药品(包括合成多肽、小分子核酸、多糖、生物来源化学药品、发酵工艺生产的化学药品等)以及处方中含有大毒药材的中药民族药等特殊品种;
(3)采用非常规生产工艺的品种
补充申请:
(1)除疫苗、血液制品以及细胞治疗产品等外,涉及生产工艺或生产场地重大变更的其他生物制品;
(2)除生产工艺重大变更外,涉及其他重大变更的中药注射剂;
(3)经评估,变更后采用非常规生产工艺的品种
4.3 合规因素高风险
(1)近三年在技术审评、注册核查、监督检查等过程中发现真实性问题的;
(2)近三年在注册工作中发现存在《药品管理法》第一百四十一条相关情形的;
(3)仅用于中国注册的生物等效性研究数据由境外临床研究机构完成的;
(4)药品生产企业尚无同剂型品种上市的或近三年未接受过国内外监管机构注册核查的;
(5)支持药品上市的关键临床试验数据研究机构近三年未接受过国内外药品监管机构注册核查、监督检查的。
4.4 合规因素中风险
申办方与临床试验项目研究机构之间(包括临床试验机构、中心实验室、生物样本分析检测机构、承担部分研究者职责的合同研究组织),或临床试验项目研究机构之间存在相关利益关系的。
五、 风险因素的判定
品种因素有高中低3种,合规因素有高中低3种,风险判定共9种组合,判定为就高原则。
判定为高风险100%核查,中风险10%的核查比例,低风险为2%的核查比例。
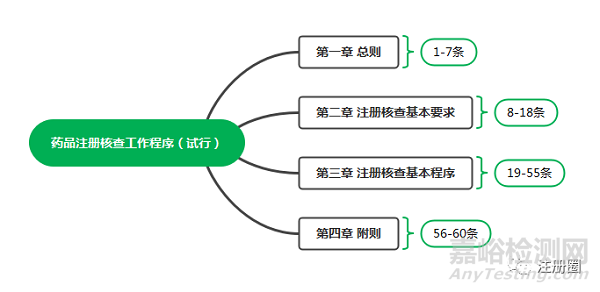
六、 《药品注册核查工作程序(试行)》内容框架
《药品注册核查工作程序(试行)》共分4章,共60条。最重要的章节为第三章,对注册核查工作的流程,核查的要求以及核查工作的时限等做了详细说明。
七、 药品注册核查工作流程
核查工作流程主要涉及3方,CDE基于风险决定是否启动,CFDI负责具体核查工作。
八、 药品注册核查实施的法规体系
关于注册核查的全流程框架为CDE基于风险判定是否启动,启动后CFDI负责具体核查工作,核查工作细分环节有核查工作流程、核查判定的原则要点等,此外还涉及注册生产现场核查和上市前生产质量管理规范检查衔接等。
九、 企业应对注册核查的准备
结合判定原则要点文件(附件2-4),关于注册核查的目的可以总结为真实性、一致性、可靠性和合规性,即(1)申报资料的真实性、一致性;(2)原始资料数据可靠性;(3)研究合规性。
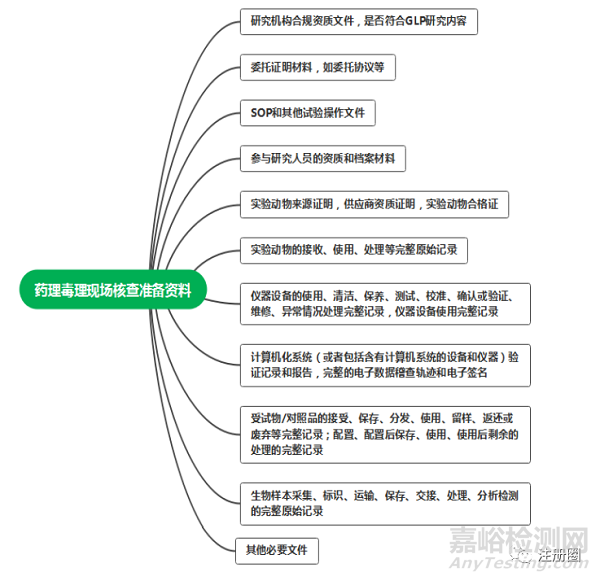
药理毒理学研究现场核查主要是对药理毒理学研究情况,包括药理和(或)毒理研究的条件、方案执行情况、数据记录和结果报告等方面进行的核查。
药物临床试验现场核查主要是核对注册申报资料与临床试验的原始记录和文件,评价试验实施、数据记录和结果报告是否符合试验方案和药物临床试验相关法规,同时关注受试者保护。
药学研制现场核查主要是对药学研制情况,包括药学处方与工艺研究、样品试制、质量控制研究及稳定性研究等研制工作的原始数据、记录和现场进行的核查。
生产现场核查是对药品注册申请的商业规模生产工艺验证、样品生产过程等进行核实,对其是否与申报的或者核定的原辅料及包装材料来源、处方、生产工艺、检验方法和质量标准、稳定性研究等相符合,相关商业规模生产过程的数据可靠性以及是否具备商业化生产条件进行确认。
具体核查要点在此不一一详细罗列,可以参考附件2-4。下面详细介绍应对注册核查,企业的准备。
9.1 注册现场核查前企业确认
前文已经介绍,CDE基于风险决定启动核查之后,发送核查通知后,企业需要先确认核查。
说明:附件主要是GMP检查文件,生产许可证、品种情况详细文件等。
9.2 核查第一步:汇报
汇报包括两方面内容,一是核查组向企业进行汇报,核查人员构成、向企业出示授权证明文件,告知本次核查的目的范围等。第二是核查组要求企业准备一份书面汇报文件(PPT)向核查组汇报要核查的品种及有关方面的情况。总结起来可以分为3块内容,一是品种的研发历程、来龙去脉,研发数据等,该部分内容可以在注册申报资料中摘取。第二是下文9.4、9.5介绍的现场准备资料部分,可以简单列表放入PPT中。第三是介绍核查准备情况以及现场生产计划安排等。
9.3 药理毒理学核查企业资料准备
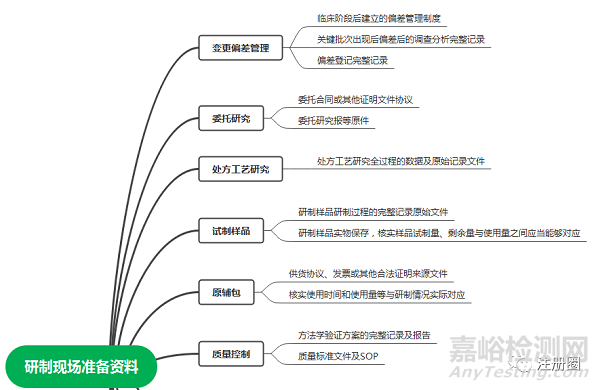
9.4 研制现场核查企业资料准备
9.5 生产现场核查企业资料准备
9.6 安排陪同人员
现场核查人员一般由CFDI派出2名核查人员,同时一般省药监局安排一名人员作为协助核查人员。企业需要安排陪同人员,陪同人员一般选择对该品种研发生产比较熟悉的一位负责人,同时安排3-5名(能少不要多)现场核查资料时,协助整理递送资料的项目人员。