摘要:美国食品药品监督管理局(FDA)于2023 年4 月发布了“评估简化新药申请仿制透皮和局部给药系统可能的刺激性和致敏性的供企业用的指导原则草案”,全面而又具体地阐明FDA对仿制透皮和局部给药系统(TDS)可能的刺激性和致敏性人体内研究的设计和实施的建议。其中包括一般原则(一般考虑)、研究设计和实施、统计分析(刺激性分析和致敏性分析)、辅料TDS 和阳性对照TDS 以及部分(切割)TDS 等。而中国目前还没有类似的指导原则,详细介绍FDA该指导原则主要内容,期望对中国仿制TDS 刺激性和致敏性人体内研究与监管有所裨益。
美国食品药品监督管理局(FDA)于2023 年4月发布了“评估简化新药申请仿制透皮和局部给药系统可能的刺激性和致敏性的供企业用的指导原则草案”[1],修订了2018 年10 月发布的“评估简化新药申请仿制透皮和局部给药系统的可能的刺激性和致敏性的指导原则草案”[2]。该修订的指导原则由FDA药物评价与研究中心(CDER)的仿制药办公室与CDER 的转化科学办公室合作编写,为评估拟议的透皮或局部给药系统(TDS)可能的体内皮肤刺激性和致敏性(I/S),提出了设计和实施研究的建议。该指导原则修订草案中的建议涉及为支持简化新药申请(ANDA)而提交的研究资料,修订后的指导原则草案,旨在阐明FDA 关于体内皮肤I/S 研究的建议和期望。
中国目前还没有类似的指导原则,本文详细介绍FDA 该指导原则草案的内容,期望对中国仿制TDS 的人体I/S 的研究和监管有益。
1、 该指导原则的前言
该指导原则对研究设计和实施提出了建议,这些研究用以评价拟议的TDS 可能的体内I/S。首字母缩写TDS 指的是透皮给药系统和局部给药系统,包括可能在其他地方描述或称为贴片(patches)、局部贴片(topical patches)或缓释膜(extended-releasefilms)的产品。该指导原则中的建议,涉及为支持ANDA 而提交的研究资料。新药申请或补充新药申请中表征可能的TDS 刺激性或致敏性研究的建议,可能与支持ANDA的建议不同。在支持新药申请的研究中,TDS 刺激性和致敏性的设计、实施和评估本质上是不同的,因为在这种情况下,TDS 刺激性或致敏性通常不与参比制剂(RLD)对比评价。有关新药申请,请查阅“用于皮肤的局部药物引起的接触性皮炎:人体安全评估供企业用的指导原则”(2020 年3 月)[3]。FDA定期更新指南,最新版本的指南,请查看美国食品药品管理局指南网页https://www. fda. gov/regulatory-information/searchfda-guidance-documents。
该指导原则修订了“评估ANDA透皮和局部给药系统可能的刺激性和致敏性的供企业用的指导原则草案”[2],此次修订对2018 年原来的指导原则草案做了如下更新:(1)阐明了评价拟议TDS 的可能的体内皮肤I/S 研究设计和实施的建议;(2)明确了何时可能不需要评估,TDS 产品可能的致敏性的体内研究;(3)为拟使用替代评分量表或替代方法,比较受试和参比TDS 之间的I/S 的申请人提供指导。
在该指导原则中,字母T(代表试验)将指作为ANDA对象的拟议仿制药,字母R(代表参照)将指参比制剂(RLD)和( 或)标准制剂(referencestandard product)。
FDA 建议申请人在考虑设计和实施可能适合支持拟用仿制TDS 产品与其RLD生物等效性的研究时,参考该指导原则以及任何相关的具体产品指导原则(PSG)[4]和任何相关的企业用的指导原则[5-6]。FDA还建议申请人,定期访问FDA的网站,因为可能有其他的指导原则,有助于开发仿制TDS产品。
FDA鼓励寻求使用FDA在相关PSG中建议的替代方法设计和实施研究。评价T 和R 产品之间TDS 的体内可能的I/S 的申请人,与FDA联系,讨论拟议的替代方法,以评价该药物产品可能的I/S[7-9]。
一般来说,FDA的指导原则文件并没有规定法律上可强制执行的责任。相反,指导原则描述了该机构目前对某一主题的想法,除非引用了具体的监管或法定要求,否则仅应视为建议。在该机构指导原则中使用“should”一词意味着建议或推荐某事,但不是规定。
2、 该指导原则出台的背景
TDS 制剂的成分和组成,包括原料药的性质和(或)TDS 材料阻止水蒸气从皮肤发散的程度,以及其他因素,如环境湿度或皮肤状态,可能刺激皮肤或导致致敏反应。皮肤致敏反应是指以前暴露过的物质引起的过敏性皮肤反应(即变应性接触性皮炎),通常以红、肿和痒为特征。这种反应可能使患者感到不舒服,并可能影响患者的依从性、皮肤渗透性和(或)TDS 与皮肤的黏附性。这些可能影响的总体后果,可能对由此产生的药物输送特点产生不确定性,并对TDS 的药物吸收速率和程度产生不确定性。因此在适当的情况下,申请人应使用适当设计的人体受试者皮肤I/S 研究,对T和R TDS 产品进行比较评估,以证明T TDS 引起皮肤刺激或致敏反应的可能性并不比R TDS 引起的反应更差(有关何时这类研究合适的信息,见下文的“一般考虑”)。
3、 一般考虑
皮肤I/S 研究旨在比较T 和R TDS 产品之间的相似性,以确定引起刺激和(或)致敏反应的可能性。TDS 可能只在一些使用该产品的患者中引发这些反应,但即使这种情况发生的频率很低,不良反应也可能影响数千人。为了评价这种I/S 的可能性,申请人应在至少200 例可评价受试者中,比较T和R TDS 产品(见第“4.1 节”),并且该研究应在激发条件下进行(在同一个皮肤部位重复去除和重新给予TDS),以最大限度地提高研究期间,受试者群体发生刺激和(或)致敏反应的可能性。
在某些情况下,如果有充分的理由,或者FDA确定进行致敏评估是不必要的或不道德的,则可能没有必要进行体内研究,评估ANDA中提交的TDS产品的致敏可能性(如已知活性成分是皮肤增敏剂,或基于与TDS 产品的成分和组成有关的信息或数据),以表明T产品不太可能比R产品更致敏。
环境温度或湿度的变化,包括常规淋浴期间TDS 每天暴露在热和水中,可暂短地影响TDS 制剂成分释放和渗透皮肤的速率。这种变化也可能影响TDS 中和(或)TDS 下的截留水分,这可能改变皮肤水合作用并影响制剂成分的生物利用度,进而可能改变I/S 反应。因此,在设计其I/S 研究时,申请人应考虑RLD的说明书任何使用条件,这些条件可能影响TDS 产品的I/S 可能性(如TDS 偶然暴露在水中,如在洗澡或淋浴时,特别是对于耗时长达或大于24 h 的TDS)。
除了可能由制剂成分的腐蚀性或免疫调节性质或皮肤对TDS 封闭的药效反应引起的I/S 反应外,皮肤也可能因去除TDS 期间可能发生的物理损伤,而受到刺激。例如,如果TDS 的黏附性使其在去除过程中剥离大部分角质层,则皮肤屏障损伤可能导致TDS 去除部位的刺激,这也可能增加致敏反应的可能性。
4、 皮肤刺激性和致敏性的综合评价
4.1 研究设计和实施
一般来说,FDA建议申请人进行评估者盲法随机研究,以支持他们对T和R产品的皮肤I/S 特点的比较评估。研究人群通常应包括健康男性和未妊娠、非哺乳的女性,除非某些TDS 产品与RLD说明书的使用条件一致的具体考虑,另有说明。在研究方案中,应预先规定拟使用的TDS 规格的选择,并应视情况,根据拟议研究人群中TDS 的使用,说明其合理性。
本文所述,如果包括足够数量的评价致敏性的受试者,FDA建议申请人在1 项研究中评价皮肤刺激性和致敏性。建议的研究由下列2 个阶段组成,每个阶段依次描述:(1)21 d 的诱导期,随后是14~17 d 的休息期;(2)激发期。
在诱导期,申请人应同时将所有TDS 单元(即每个全部或部分(Partial)[10]T 产品和每个全部或部分R 产品)用于每个受试者。Partial 是指原TDS 单元(matrix TDS)被切割成更小尺寸的TDS 单元。T和R产品用于同一解剖部位的对侧位置(例如,T 产品在左臀部,R 产品在右臀部);申请人应根据RLD说明书中的给药建议,选择解剖部位。
(1)在连续21 d 内,应使用、移除TDS 装置,并用新的TDS 装置更换,与初始应用相同的皮肤部位的重复持续时间;除非相关PSG 中另有说明,否则每个持续时间应代表RLD说明书的使用期。例如,3 d 使用期的TDS,可以每3 天去除1 次,评估I/S,并每3 天更换到相同的皮肤部位,总共21 d。
(2)申请人应在每次TDS 变化时,通过使用单独的评分表,分别评估受试者的“皮肤反应”和“其他效应”评分(两者均在下文中描述),评价受试者的刺激反应。
(3)对于经历过度刺激的受试者,TDS 可以转移到新的部位,以完成21 d 的诱导期,并继续研究的致敏部分。申请人应在其方案中预先定义,哪些标准可触发TDS 移到新部位(由于被确定为过度刺激的皮肤反应)。例如,标准可以规定,如果综合评分大于或等于3,TDS 可被移到新部位。
在激发期,申请人应同时将所有TDS 单元(即每个全部或部分T 产品和每个全部或部分R 产品)用于每个受试者。T 和R产品应用于同一解剖部位的两对侧位置(如T 产品在左臀部,R 产品在右臀部);申请人应根据RLD说明书中的给药建议选择解剖部位。
(1)TDS 组应在天然皮肤部位(即在诱导期未施用TDS 的部位)施用48 h,然后移除。
(2)申请人应在去除TDS 后30 min、24 h、48 h和72 h 评估受试者的皮肤反应。
(3)申请人应记录观察到的任何皮肤反应,并使用单独的评分表对受试者的“皮肤反应”和“其他效应”评分(两者均在下文中描述)进行叙述性描述。
(4)申请人应记录,研究人员对皮肤反应是否是接触致敏的看法。申请人应在其研究方案中预先规定,研究人员如何确定是否存在接触致敏。
(5)对于所有表现出潜在致敏反应的受试者,申请人应在最初的激发后4~8 周进行再激发试验,并以与上述激发期相同的方式进行。
在诱导期和激发期,申请人应根据量表(表1、2)对受试者皮肤反应进行评分。
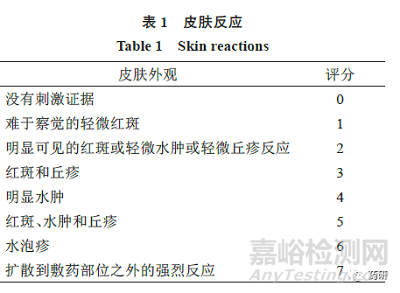
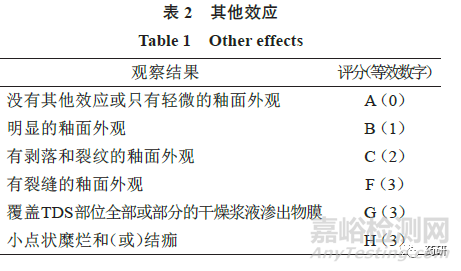
当观察到1 个或多个“其他效应”时,申请人应将每个评分报告为皮肤反应数(字母综合评分)和数字总数(即数字“皮肤反应”评分+ 等效数字的“其他效应”字母的评分)。例如,皮肤反应6 分加上有裂缝的釉面外观[F(3)]将等于9 分。当没有观察到“其他效应”时,零分应适用于观察的“其他效应。”
拟使用这2 种量表以外的替代量表的申请人,应在进行研究之前申请与FDA召开会议,讨论替代量表和拟议的统计分析方案(即提交ANDA前会议申请)。如果申请人使用这2 个量表之外的量表(如捕捉皮肤反应的渐进变化的单个数字量表),对观察到的皮肤反应评分,则他们应该报告,根据其选择的替代量表的每个评分以及根据这2 个量表的评分。
如果申请人认为可能需要使用胶带或覆盖物,在I/S 研究的相关持续时间内,保持TDS 与皮肤的最大接触,那么使用胶带或覆盖物可能是合适的。申请人应在其研究方案中预先规定,使用胶带或覆盖物加固任何可脱离TDS 的标准。如果TDS 用胶带或覆盖物加固,则应将胶带或覆盖物区域的皮肤刺激,与TDS 敷用区域相关的皮肤刺激分开报告。
在整个研究期间,申请人应在去除TDS 之前的每个时间点,评估TDS 对皮肤的黏附性,以监测适当激发诱导I/S 必要的皮肤接触的充分性。因此,即使在使用胶带或覆盖物的情况下,也应根据TDS 的表面积(不包括任何胶带或覆盖物)评估黏附性,以确保TDS 在整个诱导期和激发期都能很好地黏附。FDA评估TDS 黏附性的建议,在“评估ANDA透皮和局部给药系统黏附性”的供企业用的指导原则草案(2023 年4 月)中被描述[10]。
如果TDS 完全脱离,受试者应在24 h 内更换新的TDS 并继续研究。受试者应在脱离发生时立即记录脱离的日期和时间,申请人应保存受试者生成的原始文件(如受试者日记)。如果TDS 在21d 的诱导期内完全脱离超过24 h,申请人应将其排除在该产品的刺激性和致敏性分析之外,除非受试者因过度刺激而故意去除TDS。如果TDS 在48 h 激发期完全脱离超过24 h,申请人应将受试者排除在致敏性分析之外,除非受试者因过度刺激而故意去除TDS。
对于I/S 研究,申请人应纳入足够数量的受试者,以确保其每个方案(PP)人群中至少包括200 例可评价的受试者;然而,对于仅刺激性研究,PP 人群中可评价受试者的数量可能有所不同(见第“4.2.1”节。用于仅进行刺激性研究的样本量的确定)。受试者不应在放置TDS 的皮肤区域涂抹化妆品、护肤霜、乳液、粉末、酒精或其他局部产品,因为这些产品可能影响TDS 的黏附性或刺激的可能性。此外,在施用TDS 之前,应剪掉(而不是剃掉)受试者在施用部位的毛发。此外,申请人应建议,受试者避免将TDS 敷用部位,暴露在外部直接热源下,如加热垫、电热毯、加热灯、桑拿浴室、热水浴缸、热水床和(或)长时间的阳光直射。
下列清单规定了一些入选和排除标准,申请人可以用其选择受试者;然而,这些清单并不详尽,申请人可以酌情使用其他标准选择受试者。申请人应作为方案的一部分,描述纳入和(或)排除标准的依据,这些标准是下述标准的补充或与其不同。
(1)入选标准
① 年龄在18 至65 岁( 含)之间的男性和女性(未妊娠、非哺乳)健康受试者。健康受试者通常是指18 岁或18 岁以上的不吸烟成年人,不存在病症或需要发挥生理作用的药物。
②有生育潜力的女性必须在研究之前至少14 d内和整个研究期间,准备避免性交或使用可靠的屏障避孕方法[如女用避孕套、子宫帽、宫内节育器、避孕海绵,或让她们的伴侣使用屏障方法(含杀精剂的避孕套)],或在研究前至少30 d,使用激素方法避孕并将在研究期间继续使用相同类型的激素避孕措施。
(2)排除标准
①受试者正在妊娠或哺乳。
②重大皮肤病或病症的病史,如特应性、银屑病、白癜风,或已知改变皮肤外观或生理反应的病症(如糖尿病或卟啉病)。
③明显影响免疫反应的疾病病史[如原发性或获得性免疫缺陷(如HIV 或艾滋病)、过敏性疾病(如过敏反应、哮喘或全身药物反应)、肿瘤(如淋巴瘤或白血病)、类风湿性关节炎或系统性红斑狼疮]。
④严重皮肤癌(如黑色素瘤或鳞状细胞癌)病史,但浅表性基底细胞癌除外,且不涉及TDS 敷用部位。
⑤在研究治疗开始的3 周内,使用以下药物或疗法:显著影响或增强对T或R药品的反应,或改变对T或R药品的炎症或免疫反应(如环孢菌素、他克莫司、全身或局部皮质类固醇、细胞毒性药物、免疫球蛋白、卡介苗免疫疗法、单克隆抗体或放射疗法)。
⑥研究治疗开始72 h 内,使用抗组胺药或在TDS 部位使用局部用药。
⑦受试者两手臂之间的皮肤颜色有明显差异,或存在皮肤病症、涂抹部位毛发过多、疤痕组织、纹身、开放性溃疡、近期晒伤或身体穿孔,这些都会干扰受试品的放置、皮肤评估或受试者对TDS 的反应。
申请人应提供受试者在研究期间禁用的处方药和非处方药产品清单,例如可显著影响或增强受试者对T 或R 产品的反应,或可改变受试者对于该产品的炎症或免疫反应的药物或疗法(如抗组胺药、全身或局部皮质类固醇、环孢菌素、他克莫司、细胞毒性药物、免疫球蛋白、卡介苗免疫疗法、单克隆抗体或放射疗法)。
一般来说,受试者的身体活动在研究过程中不应受到限制。对于敷用时间长达或超过24 h 的产品,FDA建议在研究期间可以按照RLD的说明书使用方式,常规洗澡或淋浴,并且在此类常规活动中,不应保护TDS 不直接暴露在水中。
申请人应将他们的T 和R 产品,随机分配给皮肤部位,在方案中描述他们的随机化方法,并以XPT格式将随机化方案作为SAS 传输数据集提供。
经过培训的观察者应在每次去除TDS 时,对TDS 的依从性和受试者的皮肤反应评分,申请人应尽量确保所有观察都采用同一评分者。如果不是所有观察都采用同一评分者,申请人应提供确保不同评分者评分一致的证据。由于T产品和R产品之间TDS 的外观可能存在差异,观察者盲法是不可能的,尤其是需要直接观察TDS 的黏附性时。然而,申请人应尽可能对I/S 的评估采用盲法。
FDA 推荐的评价刺激性的主要终点是平均刺激性评分(MIS)。在每例受试者和每个产品的每个评估时间点,申请人应通过“皮肤反应”分数加“其他效应”字母分数的等效数字,计算综合刺激性评分。对于每例受试者和每种产品,申请人应将MIS计算为评估时间点上的综合刺激评分之和,除以评估总数。
申请人应在频率表中提交描述性刺激评分数据,说明每个TDS 单元的数量和比例,以及每个评价时间点的皮肤反应数字评分和“其他效应”字母评分的每个组合。如果TDS 因过度刺激而被移动或移除,则移除前在原始施用部位观察到的最后1次刺激评分被视为剩余时间点该部位TDS 刺激程度的合理表示。这种方法被称为原始敷用部位的末次观测值结转法(LOCF)。频率表应反映LOCF后的刺激性评分。
4.2 统计分析考虑
4.2.1 刺激性分析
对于刺激性分析,申请人应在方案中定义,他们每个TDS 的每个方案(PP)人群,而不是每个受试者。PP 人群应包括在整个21 d 的诱导期内顺序敷用于同一解剖部位的所有TDS 单元,而没有任何超过24 h 的脱离期。如果TDS 因过度刺激而被移动或移除,则应将其包括在PP 人群中,并使用原始敷用部位的LOCF。
申请人应比较T 和R 产品的每个受试者MIS(即上述主要终点)的总平均数。为了证明T 产品与R 产品相比,在MIS 方面的非劣效性(NI),应根据评价T 产品和R 产品的MIS 总平均数的差值,证明T 产品在统计学上不劣于R 产品,NI 界值为0.20(δ=0.20)。0.20 的NI 界值表示基于先前描述的刺激量表的T和R产品之间的MIS 总平均数的差值;该NI 界值可能不适合用于基于其他刺激量表或数据转换(例如对数转换或向所有刺激评分添加常数)的MIS 总平均数的差值或T 和R 产品之间的MIS 总中位数的差值。
申请人应在0.05 显著性水平检验下列假设:
H0:μT−μR≥δ
H1:μT−μR<δ
μT 和μR 分别是T 和R 产品MIS 的群体总平均数,以及替代假设H1表示,T产品刺激性相对于R产品刺激性的NI。这些假设也可以表示为:
H0:μD≥δ
H1:μD<δ
μD等于T 和R 产品MIS 的总平均数之差:μD=μT−μR。当在配对研究中,没有缺失数据时,针对个体受试者j,对配对每个受试者MIS( jR)之间的差值Dj来讲,μD与群体平均数是一样的[Dj=-XjT--XjR,E(Dj)=μD]。
为了证明T 产品具有可容许的刺激反应,申请人应设计并进行该指导原则的“第4.1 节”所述的刺激性研究。如果只设计刺激性研究,申请人应招募足够数量的受试者,以使研究达到0.80 或更高的水平。由于刺激量表的离散性和刺激数据的其他潜在问题,FDA 建议申请人使用足够大的样本量,以确保任何大样本(渐进)高斯(Gaussian)假设的有效性(如果使用的话)。
申请人应最终确定其统计分析计划,详细描述计划分析的各个方面,然后再对数据进行揭盲;在提交ANDA时,应向FDA提供统计分析计划。
不完整的数据和与不依从性相关的数据,可严重影响NI 研究的有效性。因此,FDA建议良好的研究设计和实施,以防止患者退出和不依从。如果出现任何1 种情况,申请人应详细记录退出和(或)不依从的原因。尽管FDA建议将PP 人群作为NI 研究的主要分析人群,但FDA也对信息缺失和不依从的可能性特别关注。如果将使用LOCF 以外的方法,估算因过度刺激而移动或移除的TDS 的数据,申请人应在其方案中预先规定这些估算方法。FDA 建议申请人进行预先规定的敏感性分析,以评价任何不平衡或信息缺失和不依从对NI 结论的潜在影响。
对于刺激性评估,FDA还考虑其他临床相关数据,包括达到最大刺激性评分的TDS 单元敷用数量,以及因过度刺激而停止产品敷用的受试者数量。相同的MIS 可以通过少量的高分(如3 分或更高)达到,这可能具有较大的临床意义,或者通过大量的低分(如1 分)达到,其可能具有较小的临床意义。因此,很难确定给定MIS 或给定的产品之间MIS 差异的临床意义。
因此,除MIS 外,FDA 建议申请人评价每种产品过度刺激的受试者比例。T产品过度刺激的受试者比例不应高于R 产品,并且T 产品的刺激在敷药期不应早于R 产品出现。就MIS 而言,T 产品应不劣于R产品,并且在刺激程度方面,T 产品与R产品相比,不应显示有意义的差异。
4.2.2 致敏性分析
申请人应在方案中根据TDS而不是每个受试者定义用于致敏分析的PP 人群。
用于致敏分析的PP 人群应包括,在整个21 d 诱导期和整个48 h 激发期(没有任何超过24h 的脱离期),敷用所有TDS 单元。每个受试者返回试验,应在移除激发TDS 后48 h 和72 h,经过至少1 次预先规定的评估。如果由于过度刺激而在48 h 激发期结束前移除TDS 单元,则应在移除TDS 后24 h、48 h和72 h 评估敷用部位,并使用原始敷用部位的LOCF,将其纳入致敏分析。
对于每个TDS 单元,应单独评价激发期去除TDS 后,48 或72h 综合评分为2 或更高的PP 受试者的潜在致敏性。如果符合下列所有标准,申请人应考虑为可能致敏的受试者:
(1)受试者至少有1 个评价时间点,处于激发期TDS 去除后24 h 以上(如48 h 或72 h)。
(2)受试者在激发期的最后1 次评价中,综合刺激评分至少为2 分。
(3)如果受试者完成了再激发期,则在激发期和再激发期都符合上述两个标准。
48 h 前消退的皮肤反应,通常被认为是由刺激而非致敏引起的。对于在激发或再激发期观察到的任何潜在致敏反应,申请人应提供理由支持T 产品的致敏率与使用R产品观察到的致敏率相当。
申请人应报告,被认为可能对T 和(或)R 产品过敏的受试者的各自数量。
申请人应提供描述性统计数据,比较可能对每个TDS 单元过敏的受试者的数量和比例,以及对每个TDS单元过敏的受检者数量和比例。
申请人应提供频率表,显示每个TDS 单元在激发期的敷用数量,以及每个评价时间点的每个具体综合“皮肤反应”数字评分和“其他效应”字母评分。
对于所有受试者,在激发期去除TDS 后48 h 或72 h,至少有1 个2 分或以上的综合刺激评分,申请人应提供表格,显示每个受试者在诱导和激发期,每个评价时间点的实际评分。
在某些情况下,如果提供了充分的理由,或者FDA确定进行致敏评估是不必要或不道德的(如已知活性成分是皮肤致敏剂,或者基于与TDS 产品成分和组成相关的信息或数据),以表明T产品不太可能比R产物更致敏,则可能没有必要对TDS 产品进行体内致敏性评价。
4.3 辅料TDS和阳性对照TDS
如果安全问题,不允许通常的比较研究(包括使用T和R产品),则可以通过试验辅料TDS 与产生轻度刺激的阳性对照TDS(如小于或等于0.1%的十二烷基硫酸钠),评估T 产品引起皮肤I/S 的评价。辅料TDS 应包含T 产品中的所有非活性成分,并且除不存在活性成分外,其他方面均与T 产品完全相同。如果辅料TDS 中的非活性成分与T 产品中所含的成分不同,或含量与T产品不同,则申请人应清楚地描述其差异,并提供数据表明差异不影响T 产品的安全性或申请人对研究结果的解释。
对于将辅料TDS 与阳性对照TDS 比较的皮肤I/S 研究,申请人应使用与该指导原则的“第4.1”和“第4.2”节中,建议的T 和R 产品比较,基本相同的方法,但辅料TDS 应作为T 产品,阳性对照TDS应作为R产品。
申请人应确保阳性对照在诱导期能够持续引发并维持刺激反应。阳性对照既不能持续引发刺激反应,也不能维持刺激反应,这可能会混淆研究结果的解释,并损害研究的有效性。
不建议在I/S 研究中包括多个候选阳性对照TDS 产品,并此后在统计分析中选择一个作为阳性对照TDS 与辅料TDS 比较。相反,建议在I/S 研究之前预先选择一个合适的阳性对照,作为阳性对照TDS。
4.4 部分(切割)TDS
如果安全问题不允许在21 d 的综合I/S 研究中,在同一受试者同时敷用2 种完整的TDS,则可以将原TDS 单元切割成更小尺寸的TDS 单元。在这种情况下,T 和R产品都应该有,可以非破坏性切割成较小贴片的设计。申请人不应为了在该研究中使用较小的TDS 而单独生产1 批产品。当使用切割TDS 时,该指导原则的第IV.A节和第IV.B节中提供的一般建议适用。
5、 不良事件数据的总体评估
申请人应在其分析中包括所有至少接受1 次给药的TDS 的受试者。该分析应包括所有TDS 单元(如T产品和R产品)有关任何敷用部位不良事件的比较。申请人应报告所有不良事件,包括全身不良事件。对于任何与敷用部位相关的不良事件,申请人都应报告不良事件是否与T 产品或R 产品有关。
申请人应在其研究报告中记录所有敷用部位反应(包括受试者主诉,如干燥、瘙痒、烧灼感、疼痛或酸痛),与“皮肤反应”和“其他效应”评分分开。此外,申请人应详细说明主诉适用的任何敷用部位。研究报告还应包括频率表,该表应列出敷用部位反应,并比较T 产品和R 产品之间敷用部位反应的严重程度。
6、 提交数据的格式
申请人应查阅提交给CDER 研究数据的网页,了解有关数据标准的信息。
申请人应提供规定文件的XPT 格式的SAS 传输数据集。如果申请人采用估算,则应在估算后提交原始数据和分析数据。
7、 结语
FDA的“评估简化新药申请仿制透皮和局部给药系统可能的刺激性和致敏性的供企业用的指导原则草案”全面而又具体地阐明了,FDA 对仿制透皮和局部给药系统可能的刺激性和致敏性人体内研究的设计和实施的建议。其中包括一般原则(一般考虑)、研究设计和实施、统计分析(刺激性分析和致敏性分析)、辅料TDS 和阳性对照TDS 以及部分(切割)TDS 等。该指导原则草案启发最大的有下列两个方面。
7.1 中国有必要制定仿制透皮和局部给药系统对人体刺激性和致敏性研究的指导原则
FDA该指导原则草案是其2018 年发布的“评估ANDA 仿制透皮和局部给药系统的可能的刺激性和致敏性的指导原则草案”[2]修订版。5 年后的第1次修订版内容更趋完善和实用。
而中国目前还没有类似的指导原则,国家药品监督管理局药品审评中心2021 年3 月发布的“皮肤外用化学仿制药研究技术指导原则(试行)”[11],提出了对这类仿制药开发过程中药学研究、非临床研究和生物等效性研究的技术要求,但没有涉及人体刺激性和致敏性研究要求。国家药品监督管理局药品审评中心2022 年5 月发布的“局部给药局部起效药物临床试验技术指导原则”[12]的“结语”中,虽然提及局部给药局部起效药物的临床试验中,应特别关注对局部药代、局部药效、局部安全性、耐受性等的充分探讨。但该文件也并未涉及具体的人体刺激性和致敏性研究。因此,我国有必要制定和发布仿制透皮和局部给药系统对人体刺激性和致敏性研究的指导原则,以便使其研究和监管规范化。
7.2 在仿制透皮和局部给药系统的刺激性和致敏性研究中应特别注意的事项
FDA的“评估简化新药申请仿制透皮和局部给药系统可能的刺激性和致敏性的供企业用的指导原则草案”[1],对仿制透皮和局部给药系统的人体刺激性和致敏性研究,提出了许多有意义的研究建议。其中有些对我国这方面的研究和监管有重要参考价值,应特别关注,尤其是在我国还没有类似指导原则的情况下。下面列举一些内容(实际工作中不限于此):(1)在1 项研究中包括评价皮肤刺激性和致敏性;(2)皮肤反应评分的两个量表—皮肤反应量表和其他效应量表;(3)每个方案人群中至少包括200 例可评价的受试者;(4)应尽量确保所有观察都采用同一评分者。应对皮肤反应的评估采用盲法;(5)T 产品和R产品的MIS 总平均数差值的NI 界值为0.20。










