本通则与《欧洲药典》和/或《日本药典》的相应文本相一致。这些药典承诺不对本统一章节进行任何单方面更改。
本通用章文本中属于USP国家文本的部分,因此不是协调组织文本的一部分,用符号(◆ ◆)来说明这一事实。
本试验旨在确定是否符合溶出度要求◆ 个别专论中所述◆ 用于口服给药的剂型。在本通用章中,剂量单位定义为1片或1粒或指定的量。◆在本文所述的器械设计类型中,请使用单独专论中指定的器械设计。如果标签上注明某物品是肠溶的,而溶出或崩解试验没有明确说明它将用于缓释物品,并且包含在各论中,则适用缓释剂型的程序和解释,除非在各论中另有规定。◆
◆用于含有明胶或涂有明胶的剂型
如果含有明胶的剂型由于存在交联的证据而不符合相应验收表中的标准(见释义、速释制剂、缓释制剂或延释制剂),则应按照下文所述,在介质中加入酶,重复溶出过程,并从相应验收表的第一阶段开始评估溶出结果。如果在第一阶段的测试中没有达到标准,并且观察到交联的证据,则没有必要继续测试到最后阶段(最多24个单位)。
明胶在某些化合物存在和/或在某些储存条件下,包括但不限于高湿度和高温度,可能存在交联。明胶胶囊外壳的外表面和/或内表面或剂型上可能会形成薄膜,以防止药物在溶出度测试过程中释放(更多信息请参阅《胶囊-溶出度检测和相关质量属性》〈1094〉)。
[注意:所有对〈1000〉以上章节的引用仅用于提供信息,并作为一种有用的资源使用。这些章节并不是强制性的,除非明确要求用于此用途。]
pH≤4.0的溶出介质
酶:胃蛋白酶,通过试剂规格部分中纯化胃蛋白酶的程序确定的活性。
用量:胃蛋白酶的量,其活性不超过750000单位/L的溶出介质。
pH>4.0和<6.8的溶出介质
酶:木瓜蛋白酶,通过木瓜蛋白酶专论中的含量测定试验测定其活性;或菠萝蛋白酶,通过试剂规格章节中菠萝蛋白酶的程序确定其活性。
用量:木瓜蛋白酶的活性不超过550,000单位/升溶出介质的数量,或菠萝蛋白酶的活性不超过30明胶消化单位(GDU)/升溶出介质的数量。
pH≥6.8的溶出介质
酶:胰蛋白酶,蛋白酶活性通过胰蛋白酶专论中蛋白酶活性(酶蛋白消化能力)测定程序测定。
用量:使蛋白酶活性不超过2000单位/L溶出介质的胰酶数量。
含有表面活性剂或已知能使酶变性的其他成分的溶出介质
如果溶出介质含有表面活性剂或已知能使所用酶变性的其他成分,则可以在剂型的溶解测试中进行预处理步骤。该预处理步骤使用不含表面活性剂或成分的特定溶出介质,并根据介质pH添加适量的酶。添加的酶的量与预处理中使用的溶出介质的体积相适应。为了达到用于最终溶解测试的指定介质体积,可以用较小体积的不含成分的介质进行预处理步骤,这样在预处理步骤结束时加入成分就可以得到最终体积。试验的所有其他条件(仪器、旋转或流速)应保持如方法或专论中所述。通常,预处理步骤的持续时间不超过15分钟。所需的预处理时间应根据具体情况进行评估,并应具有科学依据。该时间应包含在测试的总时间中。例如,如果测试的总时间为45分钟,并且在预处理步骤中使用了15分钟,则在添加成分后,测试将继续30分钟。◆
更改为:
仪器
第1法(篮法)
组件由以下部分组成:有盖或无盖的溶出杯,由玻璃或其他惰性透明材料1制成;电动机;转轴;转篮。溶出杯部分浸没在合适大小的水浴中,或通过合适的装置(例如加热套)加热。水浴或加热装置允许在试验期间将容器内的温度保持在37±0.5°,并且容许杯内液体保持恒定、平稳的运动。整个仪器包括放置的环境,除了平稳转动的搅拌部件,不得有明显的运动、搅拌或振动。仪器最好能允许在检测过程中能够观察到检品和搅拌部件。溶出杯为圆柱形,底部为半球形◆具有以下尺寸和容量:◆ 容量为1L,高度为160–210 mm,内径为98–106 mm;对于2L的容量,高度为280–300 mm,内径为98–106 mm;和◆ 对于4 L的容量,高度为280–300 mm,内径为145–155 mm◆. 它的侧面在顶部有凸缘。安装好的盖子可以用来延缓蒸发。转轴与溶出杯的垂直轴线在任何点处都不相差超过2 mm,并且转动平稳,不会出现可能影响结果的明显摆动。使用调速装置,可选择轴转速并将其保持在规定的转速上◆ 在个别专论中给出◆ 的±4%范围以内。
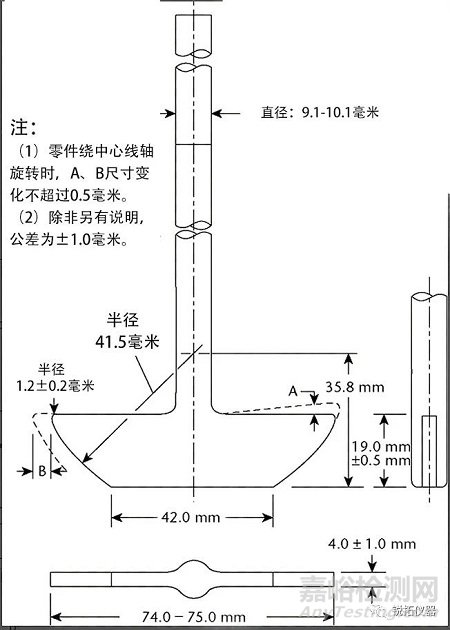
转轴和转篮部件由316型不锈钢或其他惰性材料制成,规格如图1所示。可以使用具有约0.0001英寸(2.5µm)厚的镀金篮子。在每次测试开始时,将一剂药品放置在干燥的篮子中。试验期间,溶出杯底部和篮子底部之间的距离保持在25±2 mm。


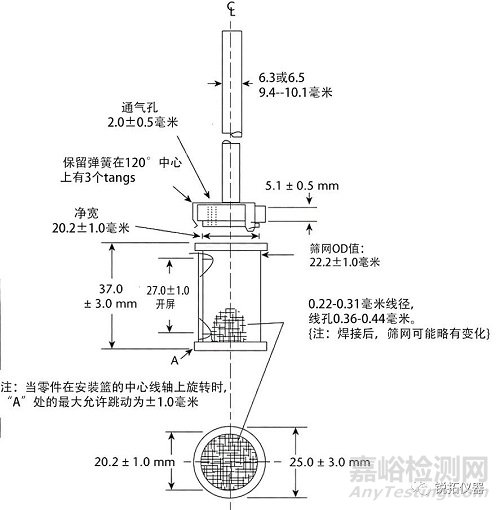
图1.转篮组成
第2法(桨法)
除了使用由叶片和轴形成的桨叶作为搅拌元件外,使用装置1的组件。轴的位置应确保其轴线在任何点与溶出杯垂直轴线的距离不超过2 mm,并且旋转平稳,不会出现可能影响结果的明显摆动。叶片的垂直中心线穿过轴的轴线,使得叶片的底部与轴的底部齐平。桨叶符合图2所示的规格。试验期间,叶片底部和溶出杯底部之间的距离保持在25±2 mm。金属或适当惰性的刚性叶片和轴组成一个整体。可以使用合适的两部分可拆卸设计,前提是组件在测试过程中保持牢固接合。桨叶和轴可以涂上合适的涂层,以使两者都是惰性的。在叶片开始旋转之前,允许一剂药品下沉到容器底部。一小块松散的非反应性材料,例如不超过几圈的螺旋线,可以连接到本来会漂浮的一剂药品上。另一种下沉装置如图2a所示。也可以使用其他经过验证的沉降片装置。
图2.搅拌桨组成

图2a.可选的沉降篮。所有尺寸均以毫米表示

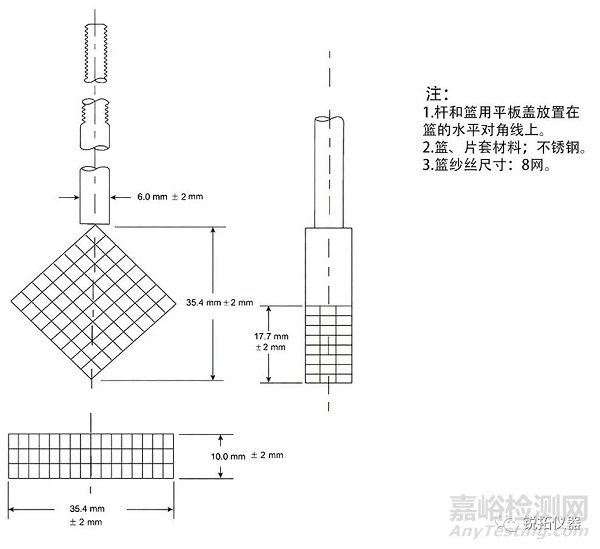
◆沉降蓝的另一种选择是吊篮。药品被放置在一个由不锈钢丝网制成的四边形篮子中,焊接在其上窄边之一,并连接到不锈钢连杆的末端(见图2b)。盖子放置在篮子的水平对角线上。杆组件通过可调节螺纹钢杆连接到溶解容器的盖子上,并通过两个聚四氟乙烯螺母固定,距离容器中心约3.2厘米,或通过其他适当的方式固定。将吊篮底部的下角调整到桨叶顶部上方约1cm处(见图2c)。连接杆的轴线沿着连接杆的垂直长度平行于桨轴的轴线,并且吊篮的最大面位于垂直于溶出杯圆柱体半径的垂直平面内。
图2b.固定吊篮
图2c.溶出杯中吊篮的位置
第3法(往复筒法)3
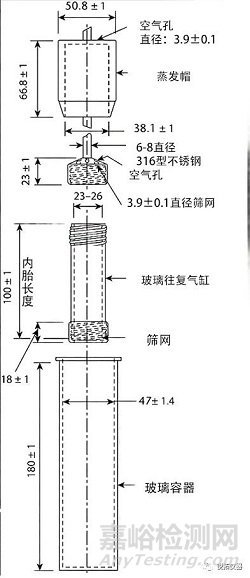
该组件包括一组圆柱形平底玻璃容器;一组玻璃往复缸;惰性配件(316型不锈钢或其他合适的材料),以及由合适的非吸收性和非反应材料制成并设计成适合往复缸的顶部和底部的筛网;以及马达和驱动组件,使缸体在容器内垂直往复运动;如果需要,将往复缸水平地分度到另一排容器上。将容器部分浸入任何方便尺寸的合适水浴中,以便在试验期间将温度保持在37±0.5°。仪器的任何部分,包括仪器放置的环境,都不能产生显著的运动、搅动或振动,而这些运动、搅动和振动是由于光滑的垂直往复气缸造成的。使用一种装置,允许选择往复率并将其保持在个别专著中规定的浸透率◆的±5%范围内。最好使用能够观察试样和往复式圆筒的设备。容器配备有蒸发帽,在试验期间保持在原位。除非另有规定,否则部件应符合图3所示的尺寸◆在个别专论中◆。
图3.第3法(往复筒法)设备.(所有测量值均以毫米为单位,除非另有说明。)
第4法(流通池)
该组件包含一个用于溶出介质的储液器和相应的泵;流通池和将溶出介质保持在37±0.5°的水浴。使用◆如个别专论所述◆中规定的尺寸。
泵推动溶出介质向上通过流通池。该泵的输送范围在240至960毫升/小时之间,标准流速为4、8和16毫升/分钟。泵必须提供恒定的流量(额定流量的±5%以内);流量分布为正弦曲线,脉动为120±10脉冲/min。也可以使用无脉冲的泵。使用流通池的溶出试验程序必须在速率和任何脉动方面进行表征。
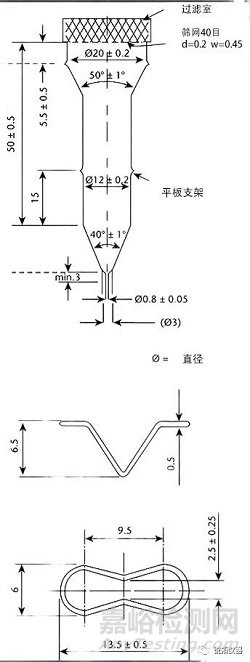
由透明和惰性材料制成的流通池(见图4和图5)垂直安装有过滤系统(在个别专论中有规定),防止未溶解的颗粒从池顶部逸出;标准流通池直径分别为12毫米和22.6毫米;底部锥体通常填充有直径约为1mm的小玻璃珠,其中一个约为5mm的玻璃珠位于顶部以保护液体进入管;片剂支架(见图4和图5)可用于特殊剂型的定位,例如泡腾片。将流通池浸入温度保持在37±0.5°的水浴中。
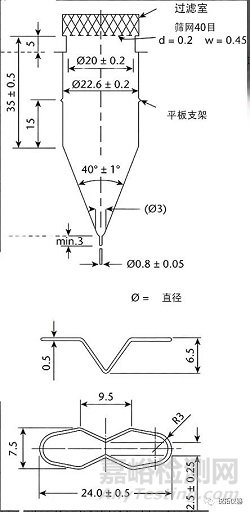
图4.第4法设备:用于片剂和胶囊的大流通池(上);大流通池的片剂支架(下)。(除非另有说明,否则所有测量值均以毫米为单位。)
图5.第4法设备:片剂和胶囊的小流通池(上);小流通池的药片支架(下)。(除非另有说明,否则所有测量值均以毫米为单位。)
该装置使用一个夹紧机构和两个O形环来组装测试池。泵与溶出单元分开,以保护溶出单元免受来自泵的任何振动的影响。泵的水平位置不应高于溶出介质容器。管线连接应尽可能短。使用适当的惰性管道,如聚四氟乙烯,内径约为1.6毫米,用具有化学惰性的法兰盘连接。
设备适用性
确定设备是否适合进行溶出度测试必须包括是否符合上述仪器的尺寸和公差。此外,在使用过程中必须定期监测的关键测试参数包括溶出介质的体积和温度、转速(第1法和第2法)、浸没频率(第3法)和介质的流速(第4法)。
定期确定溶出试验设备的性能。◆性能验证试验证明了单个设备的适用性。
✦美国药典参考标准〈11〉:
美国药典泼尼松片RS▲, USP溶出性能验证标准泼尼松RS▲ (IRA 2022年1月1日)
性能验证试验,装置1和装置2:试验USP泼尼松片RS▲或USP溶出性能验证标准泼尼松RS▲ (IRA 1-Sep-2022)根据规定的操作条件。如果获得的结果在所用批次和测试设备的技术数据表中规定的可接受范围内,则该设备是合适的。
性能验证测试,装置3:[即将推出]
性能验证测试,装置4:[即将推出]◆
程序
第1法和第2法
速释制剂
将◆在个别专论中给出◆ 的溶出介质(±1%)放入指定仪器的容器中, 组装仪器,将溶出介质平衡到37±0.5°,然后取下温度计。在仪器中放置1个单位剂量的药品,注意避免表面产生气泡,并立即以◆在个别专论中规定◆的速率操作仪器. 在规定的时间间隔内,或在规定的每个时间,从溶出介质表面以下的旋转篮或叶片顶部之间的中间区域取出样品,且距离容器壁不小于1cm。
[注:如果规定了多次取样时间,则将取出进行分析的等分试样更换为37°下等体积的新鲜溶出介质,或者,如果可以证明不需要更换介质,则校正计算中的体积变化。在试验期间,将容器盖上,并在适当的时间验证试验混合物的温度]
进行◆如个别专著中所述◆分析使用合适的测定方法。4使用额外的剂型单位重新进行试验。
如果使用自动化设备进行采样或对仪器进行其他修改,则有必要验证修改后的仪器将产生与本通用章所述标准仪器相同的结果。
溶出介质:使用合适的溶出介质。使用◆ 在个别专论中◆指定的溶剂。指定的体积是指在20°到25°之间进行的测量。如果溶出介质是缓冲溶液,则调整溶液,使其pH值在◆在各论中给出◆ 规定pH值的0.05以内。[注意:溶解气体会导致气泡形成,这可能会改变测试结果。如果溶解气体影响溶出结果,则应在测试前清除溶解气体。5]
时间:在给出了单一的时间规定的情况下,如果满足最低溶解量的要求,则可以在更短的时间内完成测试。只能在规定的时间内,在±2%的时间误差范围内取出试样。
◆速释剂型的合并样品的程序:如果各论中规定了合并样品的步骤,则使用该程序。按照程序部分第1法和第2法中的速释制剂的指示进行操作。将取出的6个或12个单独样本的等体积过滤溶液合并,并将合并的样本用作试样。测定合并样品中的活性成分的平均溶出量。◆
缓释制剂
按照速释制剂的方法进行操作。
溶出介质:按照速释制剂的方法进行制备。
时间:测试时间点,通常为三个,以小时为单位。
迟释制剂3
使用方法A程序或方法B程序以及◆个别专论中◆规定的仪器。除另有规定外所有试验时间与规定时间相差不超过±2%。
方法A程序◆(除非个别专论另有规定)◆
✦酸阶段
在容器中放入750 mL 0.1 N盐酸,然后组装仪器。使介质平衡到37±0.5°。在仪器中放置1剂量单位的药品,盖上容器,并以◆个论中规定◆的速率操作仪器。
在0.1N盐酸中搅拌2小时后,提取液体的等分试样,并按照缓冲液阶段的说明继续操作。
使用合适的分析方法对等分试样进行分析。◆该方法在各论中有详细说明。◆
✦缓冲液阶段
[注:在5分钟内完成添加缓冲液和调节pH的操作。]仪器以◆在个论中◆规定的速率运行, 向容器中的液体中加入250 mL已平衡至37±0.5°的0.20 M磷酸钠。如有必要,用2 N盐酸或2 N氢氧化钠将pH调节至6.8±0.05。继续操作设备45分钟或◆ 在个别专论中给出◆指定时间。在该时间段结束时,取出一份试样溶液,并使用合适的分析方法进行分析。◆该程序在各论中有详细说明。如果在较早的时间满足最低溶出量的要求,则试验可以在比缓冲液阶段规定的更短的时间内结束。◆
方法B程序◆ (除非个别专论另有说明)◆
✦酸性阶段
在容器中放入1000 mL 0.1 N盐酸,然后组装仪器。使介质平衡至37±0.5°的温度。在仪器中放置1剂量单位药品,盖上容器,并以◆ 在专著中◆ 规定的速率操作仪器。在0.1N盐酸中操作2小时后,提取液体的等分试样,并按照缓冲液阶段的说明继续进行。
使用合适的分析方法对等分试样进行分析。◆该方法在各论中有详细说明。◆
✦缓冲液阶段
[注:在此阶段,使用之前已平衡到37±0.5°温度的缓冲液。]从容器中排出酸,并向容器中加入1000mL pH 6.8磷酸盐缓冲液,该缓冲液是通过将0.1N盐酸与0.20M磷酸钠(3:1)混合制备的,如有必要,用2 N盐酸或2 N氢氧化钠将pH调节至6.8±0.05。[注:这也可以通过从设备中移除含有酸的容器,然后用另一个含有缓冲液的容器替换,并将药品转移到含有缓冲液的容器中。]
继续操作设备45分钟或◆ 在个别专论中给出◆指定时间。在该时间段结束时,取出等分的试样,并使用合适的分析方法进行分析。◆该程序在各论中有详细说明。如果在较早的时间满足最低溶解量的要求,则试验可以在比缓冲阶段规定的更短的时间内结束。◆
第3法(往复桶法)
速释制剂3
在仪器的每个容器中放入规定体积的溶出介质,组装仪器,将溶出介质平衡至37±0.5°,然后取下温度计。在六个往复圆筒中的每个圆筒中放置一剂量药品,注意将气泡从每个药品的表面排除,并立即按照◆在个别专论中◆ 的规定操作设备。在向上和向下的冲程中,往复式圆筒移动了9.9–10.1cm的总距离。在规定的时间间隔内,或在规定的每个时间,升起往复式圆筒,并从溶出介质液面至每个容器底部的中间区域提取一部分待测溶液。按照◆ 在个别专论中◆的规定进行分析。如有必要,使用更多的剂型单位重复测试。
溶出介质:按照第1法和第2法中速释制剂的说明进行制备。
时间:按照第1法和第2法中速释制剂的说明进行。
缓释剂型
按照第3法中速释制剂的说明进行操作。
溶出介质:按照第1法和第2法中缓释剂型的说明进行制备。
时间:按照第1法和第2法中缓释剂型的说明进行。
迟释制剂
按照第1法和第2法中迟释制剂方法B程序的说明进行操作,使用一排容器用于酸性阶段介质,下一排容器用作缓冲液阶段,并使用规定体积的介质(通常为300 mL)。
时间:按照第1法和第2法中速释制剂的说明进行。
第4法(流通池)
速释制剂
根据◆在专著中◆的规定将玻璃珠放入流通池。将1单位剂量药品放在珠子上,或者,如果◆ 在专著中◆另有规定, 也可置于载具上。组装过滤头,并使用合适的夹紧装置将零件固定在一起。用泵将加热至37±0.5°的溶出介质引入流通池,以获得◆ 在个别专论中◆ 规定的流速并且流速精度为5%。在每个规定的时间收集浸出液。按照◆ 在个别专论中◆规定进行分析。使用额外的剂型单位重复测试。
溶出介质:按照第1法和第2法中的速释制剂的说明进行制备。
时间:按照第1法和第2法中的速释制剂的说明进行。
缓释剂型
按照第4法中速释制剂型的说明进行操作。
溶出介质:按照第4法中速释制剂的说明进行制备。
时间:按照第4法中速释制剂的说明进行操作。
迟释制剂
按照第1法和第2法中迟释制剂的说明,使用指定的介质进行操作。
时间:按照第1法和第2法中迟释制剂的说明进行操作。
解释
速释制剂
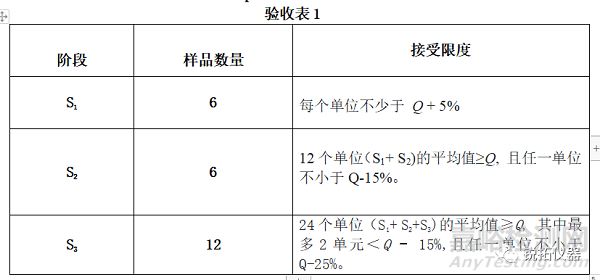
除非◆在个别专论中◆另有规定,如果从测试的剂量单位中溶出的活性成分的量符合验收表1,则满足要求。继续进行三个阶段测试,除非结果符合S1或S2。数量(Q)指◆在个别专论中规定◆活性成分溶解量,以标示量的百分比表示;验收表1中的5%、15%和25%的值是指标示量的百分比,因此这些值和Q是相同的。
速释制剂汇集样品
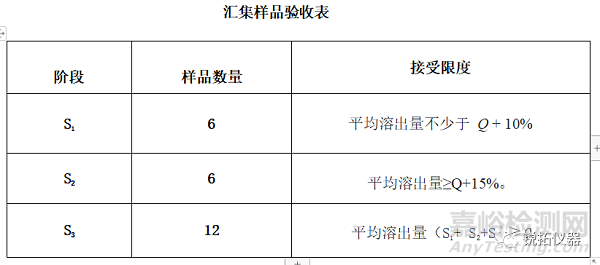
除非个别专论中另有规定,否则如果从混合样品中溶出的活性成分的数量符合所附的混合样品验收表,则满足要求。通过三个阶段继续测试,除非结果符合S1或S2。数量(Q)是专论中规定的活性成分的溶解量,以标示量的百分比表示。
缓释制剂
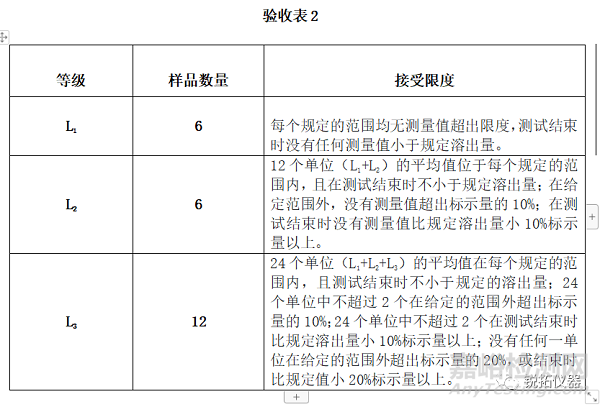
除非◆在个别专论中◆另有规定, 如果从测试的剂量单位中溶出的活性成分的量符合验收表2,则认为合格。继续进行三个级别的测试,除非结果符合L1或L2的限度。活性成分溶解量的限制以标示量的百分比表示。极限包括Qi的每个值,即在每个指定的给药间隔溶出的量。如果◆在个别专论中◆指定了多个范围, 验收标准将单独适用适用于每个范围。
迟释制剂3
酸阶段
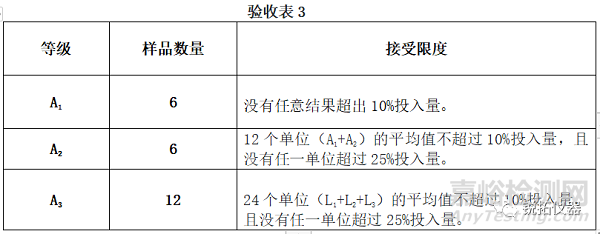
除非◆在个别专论中◆另有规定,如果从测试单元中溶出的活性成分的数量(基于标示量的百分比)符合验收表3,则认为此阶段结果合格。除非酸阶段和缓冲液阶段的结果都符合早期水平,否则连续测试全部等级。
缓冲液阶段
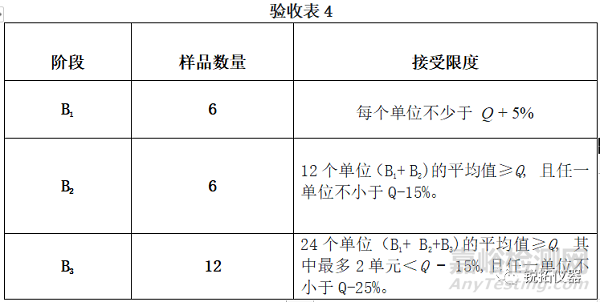
除非◆在个别专论中◆另有规定, 如果从测试的单元中溶出的活性成分的量符合验收表4,则满足要求。连续进行三个级别的测试,除非两个阶段的结果均符合更早的等级。除非◆在个别个人专论中◆另有规定,否则验收表4中的Q值为75%。◆ 在个别专论中规定◆ 数量(Q)是溶解在酸性阶段和缓冲液阶段中的活性成分的总量,以标示量的百分比表示。验收表4中的5%、15%和25%值是标示量的百分比,因此这些值和Q是相同的。
1.材料不应吸附、反应或干扰被测样品。
2.如果使用盖子,须有开口,以便随时插入温度计和取出样品。
3.未被日本药典接受。
4.试样取样后应立即过滤,除非证明不需要过滤。使用不会导致活性成分吸附或含有会干扰分析的可提取物质的惰性过滤器。
5.一种脱气方法如下:在轻轻搅拌的同时,将介质加热至约41°,立即使用孔隙率为0.45µm或更小的过滤器在真空下过滤,剧烈搅拌,并在真空下继续搅拌约5分钟。可以使用其他经验证的脱气技术来去除溶解气体。