摘 要 Abstract
近年来,随着各种病原体全基因组测序工作的完成以及生物信息学在疫苗方面的革命性进展,反向疫苗学技术成为一种新兴的疫苗开发方式。该技术省时经济,为传统疫苗学无法研制的疫苗领域提供一种新的思路。迄今为止,研究者已经多次运用反向疫苗学技术研究多种细菌或病毒类疾病,本文主要对反向疫苗学技术在细菌、病毒和寄生虫疫苗研发中的应用进展进行全面概述。
In recent years, with the completion of whole genome sequencing of various pathogens and revolutionary advances in bioinformatics for vaccines, reverse vaccinology technology has emerged as a new approach to vaccine development.The technology is time-saving and economical and offers a novel idea in the field of vaccines that cannot be developed by conventional vaccinology. To date, researchers have repeatedly used reverse vaccinology techniques to study a variety of bacterial or viral diseases. This paper provides a comprehensive overview of the progress of reverse vaccinology techniques in the development of bacterial, viral and parasitic vaccines.
病原体持续变异和新型突发传染病的出现使疫苗的需求日益增长,随着测序技术和生物信息学技术的快速发展,反向疫苗学技术扩大了病原体抗原筛选范围,提高了抗原识别效率,加快了疫苗的研发进程。因此,相较传统疫苗学而言,反向疫苗学技术弥补了其不足之处,在细菌、病毒和寄生虫疫苗研发中逐渐得到更加广泛的运用。
1、 在细菌疫苗研发中的应用
1.1 脑膜炎奈瑟菌
脑膜炎奈瑟菌(Neisseria meningitidis) 又称为脑膜炎球菌,是流行性脑脊髓膜炎的病原菌,脑膜炎球菌是引起儿童和青少年急性化脓性脑膜炎的主要病因,致死率高,严重威胁人类健康。脑膜炎球菌菌株有多个血清型,但多数病例常由A、B、C、W135、Y 群血清型引起[1]。通过传统疫苗学已成功开发出针对A、C、W135、Y 血清型的传统多糖疫苗,有效降低了相应血清群的流行性脑脊髓膜炎发病率和死亡率,但是无有效的B 血清型疫苗。原因主要有两点:一是由于B 群脑膜炎球菌(group Bmeningococcus)的荚膜多糖与其他几个血清型的菌株不同,免疫原性较低,与人体神经组织存在交叉反应,易产生自身免疫,阻碍B 群脑膜炎球菌疫苗的开发。二是B 群脑膜炎球菌菌体表面蛋白容易突变,利用该蛋白做疫苗只对同源菌株提供保护作用,而对异源菌株则没有明显的保护效果[2]。
皮扎(Pizza) 团队[3] 首次将反向疫苗学技术的研究思路和技术应用到B 群脑膜炎球菌疫苗的研究,发现该疫苗具有很好的保护效果[4-5]。该团队研发的具体技术路线是:利用基因组数据库和生物信息学软件对B 群脑膜炎球菌的MC58 这一菌株进行全基因组分析[6],从2158 个开放阅读框(Open Reading Frames,ORFs)中筛选出600 个潜在的候选抗原基因。这些候选抗原多为分泌蛋白、外膜蛋白、脂蛋白和毒力因子等[7]。通过聚合酶链反应(PCR)技术扩增候选基因并分别克隆到表达载体中,其中有350 个编码基因在大肠杆菌中成功表达,表达产物是与组氨酸(His)或谷胱甘肽硫转移酶(GST)标签的融合蛋白[8]。将表达产物纯化后免疫小鼠,应用多种免疫学检测技术来评价抗原的免疫原性和免疫保护性。在所表达的91 种候选蛋白中,有29 种蛋白能诱导产生杀菌抗体[9]。研究者进一步研究发现,其中2 个蛋白所产生的血清杀菌抗体滴度与外膜囊泡(OMV)诱导的B 群脑膜炎球菌相似,已知OMV 只对人类的同源菌株提供保护。为了测试这些蛋白质作为候选抗原是否适合于其他B 群脑膜炎球菌菌株,应用生物信息学软件对另外31 株B 群脑膜炎球菌的基因组序列进行保守性分析,筛选出有代表性的血清型B 群脑膜炎球菌候选抗原, 发现5 个候选蛋白抗原在序列上是保守的,分别是GNA33、GNA1162、GNA1220 、GNA1946 和GNA2001,它们诱导产生的杀菌抗体能抵抗大多数B 群脑膜炎球菌菌株的感染[10]。因此,该研究团队证明利用基因组信息筛选鉴定有效的保护性抗原是可行的,从而推动反向疫苗学技术的发展。
OMV 疫苗已被有效地用于应对古巴、挪威和新西兰的特定流行性B 群脑膜炎球菌菌株引起的疾病暴发[11]。OMV 疫苗的免疫原成分主要是针对B 群脑膜炎球菌菌株所表达的PorA 蛋白,由于PorA 蛋白保守性低,不具备普遍保护力,OMV 疫苗预防感染B 群脑膜炎球菌的能力仅限于表达相同PorA 蛋白变体的菌株[12]。为了应对不同菌株之间的广泛变异性,人们一直在寻求新的候选疫苗。近些年,有研究者根据所选蛋白在脑膜炎球菌自然群体中的变异程度以及它们对不同菌株诱导杀菌活性的能力,选择了3种最有潜力的抗原,分别是H 因子结合蛋白(factor H-bindingprotein,FHbp)[13]、奈瑟菌肝素结合抗原(Neisseria heparin binding antigen,NHBA )、奈瑟菌黏附素A(Neisseriaadhesion A,NadA)[14-15], 与OMV 联合制成B 群脑膜炎球菌四价疫苗4CMenB(Bexsero®)[16-18]。此外,还有一款含有2 种FHbp的B 群脑膜炎球菌疫苗, 即二价rLP2086(Trumenba®)。通过加速批准, 二价rLP2086 和4CMenB 在美国获得许可, 其中二价rLP2086 被批准用于10~25 岁个体[19]。
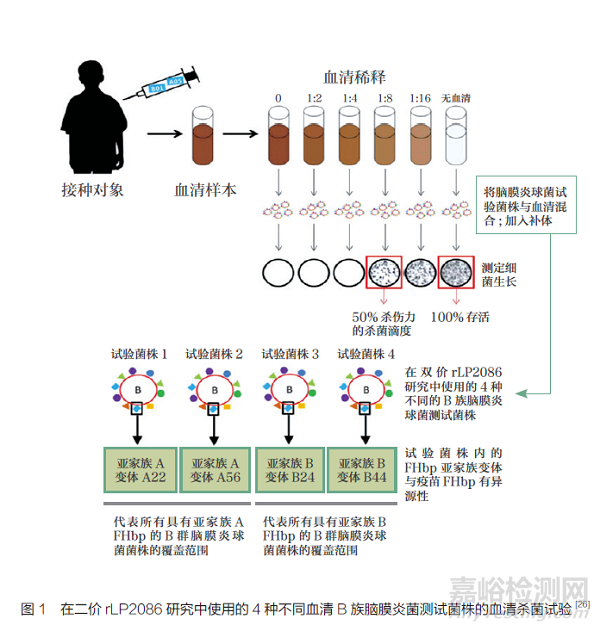
已证明三剂量的4CMenB疫苗接种程序和额外加强剂量对婴儿具有免疫原性, 而两剂量的4CMenB 疫苗接种计划对1~10 岁儿童、青少年和成人均具有免疫原性[20]。2015 年,4CMenB 首次纳入英国的国家免疫计划(National Immunization Program,NIP),在婴儿中使用减少剂量的2+1(2、4 和12个月)计划[3]。继英国之后,其他一些国家包括安道尔[21]、爱尔兰[22]、意大利[23] 和立陶宛[24]也批准了4CMenB。二价rLP2086 由应用反向疫苗学技术筛选出的FHbp 重组而成,能够刺激强烈的抗体反应,杀死各种血清B 型菌株[25]。更重要的是,在16~23 岁人群中进行的两项Ⅲ期临床研究表明,对4 个主要的(图1)和额外10 个异源的B 群脑膜炎球菌测试菌株进行人体血清杀菌抗体检测,在2 次或3 次免疫后引起机体保护性免疫反应[26]。尽管婴儿是美国侵袭性脑膜炎球菌病(IMD)发病率最高的人群之一,且大部分病例是由B群脑膜炎球菌引起的[27],但是二价rLP2086 和4CMenB 目前在美国都没有获得用于婴儿的许可。
1.2 肺炎链球菌
肺炎链球菌(Streptococcus pneumoniae)在免疫力低下的人群中可引起肺炎、鼻窦炎、中耳炎,甚至导致败血症和化脓性脑膜炎等严重疾病[28-29],主要影响5 岁以下儿童和老年人,多重耐药临床分离株的出现以及高致死率引起了研究者对该疫苗开发的关注。目前的疫苗是基于选定的荚膜类型与载体蛋白结合,以实现对儿童和成人的保护。然而,这类疫苗有几个局限性:首先,已报道的荚膜多糖有100 多种,疫苗所包含的血清型只占现有血清型的一小部分[29] ;其次,结合疫苗的成本高,在低收入家庭或国家中难以推广。为解决这些问题,研究者们正在利用反向疫苗学技术着力寻找以表面保守的蛋白质为基础的候选抗原[30-31]。
自2001 年以来,通过测序技术已经获得几株肺炎链球菌的全基因组数据,并且对其表面毒力因子有了丰富的认识。为了确定潜在的候选疫苗抗原, 维茨曼(Wizemann) 等[32] 利用生物信息学技术分析了肺炎链球菌的全基因组数据,并对该基因组所有的2687 个ORFs 进行了综合评估,最终筛选出位于细菌表面的130 个ORFs, 其中只有108 个ORFs 能够成功克隆和表达,将这些蛋白纯化后,通过小鼠模型评价其免疫保护效果。结果表明, 有6 种蛋白(Sp36、Sp46、Sp91、Sp101、Sp128和Sp130)能够使机体产生抗肺炎链球菌感染的有效抗体。通过流式细胞荧光分选技术(FACS)分析证明这6 种抗原定位在细菌表面,并且都在不同菌株中广泛分布[33-34]。为了评估这些抗原在人类宿主感染期间的表达情况,应用免疫印迹试验检测了17 名细菌性肺炎恢复期患者血清与5种重组肺炎链球菌抗原的反应性。结果表明,17 名患者中的15 名在肺炎链球菌感染期间产生的免疫血清可以识别Sp36 蛋白。此外, 大多数患者血清都能识别Sp91、Sp128 和Sp130 蛋白( 识别率分别为76%、82% 和94%)。71% 患者的恢复期血清不能识别Sp46 蛋白,表明该蛋白可能在这种临床疾病中的表达水平很低,或者在自然环境中的免疫原性很差。由于恢复期抗血清的数量有限,Sp101 蛋白没有以这种方式进行检测。虽然对这些抗原的免疫反应本身并不能预测其保护能力,但这些数据确实表明它们在体内表达,在宿主感染期间具有免疫原性。此外,在感染败血症小鼠模型中发现Sp91蛋白既没有免疫原性,也没有保护性[35]。由于鉴定出可用的候选蛋白数量太少,因此研究者仍在积极利用反向疫苗学技术寻找新的候选抗原,使其成为新型肺炎链球菌疫苗的组分[36-37]。
近两年, 马丁· 加利亚诺(Martín-Galiano) 等[31] 基于之前的研究,应用反向疫苗学技术探究出新一代基于蛋白质的肺炎链球菌疫苗的抗原候选物。DiiA 是一种由sp_1992 基因编码的表面蛋白,包含几个保守的B 细胞表位,与细菌定植和致病机制有关,在小鼠模型中,该蛋白可产生强烈的免疫反应,与佐剂对照组相比,接种DiiA 可促进细菌清除并加强对机体的保护,使小鼠感染后48 小时的存活率提高70%,证实该蛋白可能成为降低肺炎链球菌感染的候选抗原。
1.3 结核分枝杆菌
结核分枝杆菌(Mycobacterium tuberculosis)是一种古老的病原体,通过其复杂的机制来逃避免疫监视并获得在宿主中建立持续感染的能力,是引起肺结核的致病菌。目前,全球估计有1/3 的人口携带结核分枝杆菌,而其中3%~10% 的人群在其一生中有发生活动性结核病的风险[38-39]。由于人类免疫缺陷病毒的并发感染、抗生素滥用导致耐药株增加等,肺结核的发病率呈回升趋势[40]。在世界卫生组织(World Health Organization,WHO) 扩大免疫接种计划指导下, 卡介苗(Bacillus Calmette-Guérin,BCG)是全球广泛使用的唯一结核病疫苗[41],全球大约有40 亿人进行接种,对结核病的预防作出了很大贡献。随着医疗水平的不断提高,虽然BCG 对控制儿童结核病具有一定效果,但对于成人结核病预防效果在不同地区存在一定的差异[42],其效力不稳定,不能完全解决预防和控制问题,因此研发新型预防和控制结核病疫苗非常有必要。
之前用传统方法研发结核病疫苗的最大困难是所鉴定的抗原在动物模型中提供的保护力比BCG低,而且结核菌培养周期长[43]。研究者利用反向疫苗学技术对结核分枝杆菌全基因组序列进行分析,发现一组被称为PE_PGRS基因家族的基因,在该病原体的致病过程中发挥着作用[44-45]。穆德利(Moodley) 等[46-47] 利用生物信息学分析PE_PGRS 家族的4 个基因(PE_PGRS17、PE_PGRS31、PE_PGRS50和PE_PGRS54) 的结构和功能, 发现PE_PGRS17 具有很好的免疫原性,通过算法工具预测T 细胞和B 细胞表位来构建多表位疫苗(multiple epitope vaccines,MEV)候选体,用于疫苗的开发,但需要进一步的试验验证[48-50]。
1.4 牙龈卟啉单胞菌
牙周炎是侵犯牙龈和牙周组织的慢性炎症,是一种破坏性疾病,也是导致成人牙齿缺失的主要原因,目前尚无理想的治疗方法, 只能减缓或者抑制病情发展,我国成人牙周炎的发病率约为50%。一些动物模型研究表明,牙龈卟啉单胞菌(Porphyromonas gingivalis)是导致成人慢性牙周炎的一种主要致病菌,需开发一种能够有效预防牙龈卟啉单胞菌感染继而引发慢性牙周炎的疫苗。
罗斯(Ross)等[51] 应用反向疫苗学技术共筛选到120 个基因,有107 个成功表达,对表达产物用大鼠、小鼠以及人类的抗牙龈卟啉单胞菌血清做免疫学分析,获得了40 个阳性结果,表明这40 个基因的编码产物能够在机体中诱导产生抗体。随后进行的动物实验中,发现PG32、PG33 基因编码的蛋白具有良好的保护性与保守性,可以被用来作为慢性牙周炎疫苗的候选抗原。纳西里(Nasiri)等[52] 利用反向疫苗学技术得到12 种可作为新型牙周疾病疫苗的候选抗原。汗(Khan) 等[53] 也发现3 种具有抗原性且对病原体的生存至关重要的蛋白, 分别为Q7MWZ2、Q7MVL1 和Q7MTY1,推测可用于疫苗设计。
1.5 金黄色葡萄球菌
金黄色葡萄球菌(Staphylococcus aureus) 是常见的食源性致病菌,广泛存在于自然环境中,在适宜条件下,能够产生肠毒素,引起人类食物中毒。由该菌引起的食物中毒占食源性微生物食物中毒事件的25%左右。因此,金黄色葡萄球菌成为仅次于沙门菌和副溶血弧菌的第三大致病菌。研究者们[54-56] 应用反向疫苗学技术发现有12 种蛋白可作为研发金黄色葡萄球菌疫苗的候选抗原,其中已有3 个基本的毒力因子和抗原蛋白在大肠杆菌中成功表达,包括糖基转移酶、弹性蛋白结合素和葡萄球菌分泌抗原。近两年, 瑙蕾姆(Naorem)等[57] 通过反向疫苗学技术又确定了4 个潜在的候选蛋白,其中PrsA 蛋白和EssA 蛋白被认为是有希望的疫苗候选分子。
1.6 布鲁氏菌
布鲁氏菌(Brucella)是能引起全球性人畜共患传染病的病原体,其引起的疾病涉及范围非常广,特别是在亚洲、非洲、南美洲和地中海地区[58],造成严重的公共健康威胁,人布鲁氏菌病临床表现为各种类型,包括波动热、关节炎、心内膜炎、脑膜炎等[59-60]。我国目前唯一批准人用布鲁氏菌疫苗为减毒活疫苗104M 株[61],由于布鲁氏菌保护性抗原谱复杂,单一抗原很难起到完全的保护作用。宰(Zai)等[62] 建立了蛋白质组学与生物信息学联用的保护性抗原筛选新策略,获得多个新的潜在保护性抗原;对其中4 个候选抗原进行免疫动物试验验证,证明Omp19、VirB8 和HlyD 能使小鼠产生较强的免疫反应,并且在攻毒试验中有较好保护效果,为新型人用布鲁氏菌疫苗设计奠定了基础[63-64]。
1.7 幽门螺杆菌
幽门螺杆菌(Helicobacter pylori)是一种可导致消化性溃疡等胃部疾病的致病菌,被WHO列为一级致癌因子[63]。由于抗幽门螺杆菌治疗中使用抗生素的耐药性菌株不断增加,开发有效的疫苗迫在眉睫。应用反向疫苗学技术优化幽门螺杆菌疫苗设计,可能加快这一目标的实现。哈斯(Haas) 等[65] 用阳性患者血清对幽门螺杆菌菌株进行免疫印迹分析,将检测得到的抗原识别谱进行系统分析,发现7 个蛋白质只对阳性患者血清有免疫反应,其中HtrA(HP1019)、Cag3(HP0522) 和HP0231 蛋白是新发现的特异性抗原。纳兹(Naz)等[66] 采用反向疫苗学技术对幽门螺杆菌基因组中所有候选蛋白的表面抗原表位进行预测和分析,预测出可能的候选表位包括vacA、babA、sabA、fecA 和omp16,为开发多组分幽门螺杆菌疫苗奠定了基础。马(Ma)等[67]对幽门螺杆菌的381 个蛋白质序列通过生物信息学的方法构建免疫原性评分模型,并对排名靠前的部分蛋白质的免疫原性进行测试。将UreB、PLA1 和Omp6三个表现良好的蛋白的B 细胞表位和T 细胞表位以随机顺序组装成6 个MEV。通过结构预测和分子对接模拟试验分析,选择构建S1 结构,它具有结合TLR2、TLR4 和TLR9 的潜力,最终形成稳定的复合物,刺激机体产生强烈的免疫反应。该研究应用反向疫苗学技术为构建MEV 的表位组装提供了很好的策略。
1.8 肺炎衣原体
肺炎衣原体(Chlamydia pneumoniae) 是专性细胞内寄生的病原体, 感染后不仅能引起肺炎, 还能导致动脉粥样硬化和心血管疾病等。蒙蒂贾尼(Montigiani) 等[68] 应用反向疫苗学技术鉴定肺炎衣原体的表面抗原,首先通过分析肺炎衣原体的基因组序列,预测出157 个可能暴露在其表面的蛋白质。将这些蛋白质在大肠杆菌中克隆、表达、纯化,然后免疫小鼠制备抗血清,应用免疫学技术评价各个蛋白的免疫原性,并成功地定位肺炎衣原体原体时期的表面蛋白。这一研究开辟了确定肺炎衣原体表面蛋白的新途径,为研发新型肺炎衣原体疫苗奠定基础。努尔(Noor)等[69] 在研究中共发现了4754 个核心蛋白,随后应用蛋白质组学技术,从4754 个核心蛋白中获得4 个目标蛋白。最后通过对其进行免疫信息学分析来构建MEV,对MEV 中密码子进一步优化,并克隆到大肠杆菌表达宿主中,以确保疫苗蛋白的最大表达。
1.9 梅毒螺旋体
梅毒螺旋体(Treponema pallidum)是引起梅毒的病原体。该病原体在实验室条件下不能培养,不宜用传统方法研究疫苗[29]。之前有研究者通过兔体培养梅毒螺旋体,已鉴定了20 多种疫苗候选抗原,但没有进行深入的研究。近些年,研究者首次应用反向疫苗学技术开展梅毒疫苗研究,通过对梅毒螺旋体进行全基因组预测,筛选出潜在的抗原候选分子,并以重组蛋白或DNA 的形式表达[70],可加快该疫苗的研发进程。库马尔·贾伊斯瓦尔(KumarJaiswal)等[71] 按照反向疫苗学技术路线来确定候选抗原,最终鉴定出15 个潜在的抗原蛋白,可作为未来梅毒螺旋体疫苗研发的候选抗原。
2、 在病毒疫苗研发中的应用
2.1 新型冠状病毒
新型冠状病毒(Severe Acute Respiratory Syndrome Coronavirus 2)感染后会引起轻度至中度呼吸道疾病,较严重可导致肺炎、严重急性呼吸综合征、肾衰竭甚至死亡。截至2023 年3月7 日,全球已有7 亿多例感染病例,其中包括680 多万例死亡病例[72]。接种疫苗能有效阻断病毒感染,截至2022 年初,全球已有9 款疫苗列入紧急使用清单,57 个国家的70% 人口接种了新冠疫苗[73]。但新型冠状病毒易变异,目前已有11 种变异毒株,基于原始毒株序列设计的疫苗针对变异毒株可能无法提供完全保护。因此,在新型冠状病毒疫苗研发工作中需要充分考虑变异毒株。
新型冠状病毒由刺突蛋白(S)、膜蛋白(M)、包膜蛋白(E)和核衣壳蛋白(N)4 个结构蛋白组成。病毒进入宿主细胞由S 蛋白介导,该蛋白由2 个功能亚基(S1 和S2)组成,S1 亚基由N端结构域(NTD)和受体结合域(RBD)组成,新型冠状病毒通过S1 亚基上的RBD 与细胞表面受体血管紧张素转换酶2(ACE2)相结合感染宿主细胞;S2 亚基由融合肽(FP)、七肽重复序列1(HR1)、中心螺旋(CH)、连接结构域(CD)、七肽重复序列2(HR2)、跨膜结构域(TM)和细胞质尾部(CT)组成,主要负责病毒与宿主细胞的膜融合[74]。
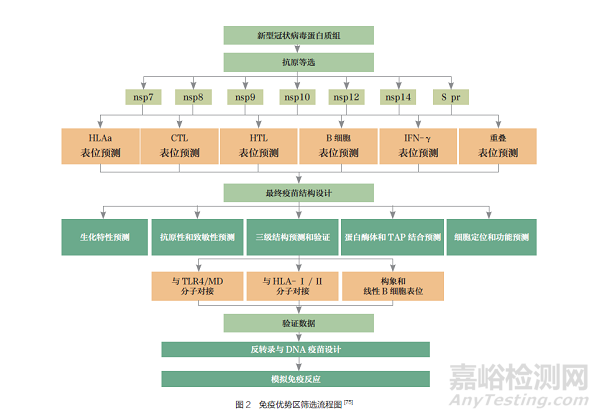
研制新型冠状病毒这种突发且易突变病原体的疫苗,利用反向疫苗学技术可以大大缩短其抗原筛选验证过程,及时确定可能有效的免疫抗原。萨法维(Safavi)等[75] 利用多种免疫学工具筛选出新型冠状病毒非结构蛋白上(nsp7、nsp8、nsp9、nsp10、nsp12 和nsp14)能激发T 细胞免疫应答的免疫优势区(图2),并选择S 蛋白400~510 位片段(S pr)作为诱导产生中和抗体的免疫优势区,将这两部分免疫优势区组合成新型冠状病毒疫苗候选抗原。该疫苗由3 个区域组成,包括β- 防御素(TLR4 激动剂)、B 细胞反应诱导域和T 细胞反应诱导域, 并在疫苗的N 端连接TLR4/MD 复合物,C 端同时连接CD4+T 辅助性表位PADRE。该疫苗具有多个CD8+T 和CD4+T 重叠表位、IFN-γ 诱导表位和线性B 细胞表位, 经过理化性质、抗原性和群体覆盖率等多个项目验证,该疫苗可与TLR4/MD 复合物形成稳定的相互作用,并经过计算机模拟该疫苗HLA- Ⅰ 和HLA- Ⅱ 表位的全球人口覆盖率约为96.2% 和97.1%。
斯利瓦斯塔瓦(Srivastava)等[76] 对免疫表位数据库中新型冠状病毒蛋白质组中11 个ORFs进行抗原区域筛选, 将重叠的表位簇命名为抗原补丁(Ag-patches),并利用识别出的Ag-patches设计多补丁疫苗(multi-patch vaccines , MPVs ),MPVs 相较于MEV 能覆盖更多的重叠表位以及HLA 等位基因。该研究从新型冠状病毒蛋白组中共鉴定出73 个CTL 表位和49个HTL 表位,这些Ag-patehes包含针对55 种HLA 等位基因的768 个抗原表位,覆盖全球99.98% 的人口且高度保守,并与先天免疫受体TLR3 形成稳定的复合物。该研究从整个新型冠状病毒蛋白组中识别出高免疫原性的抗原区域, 具有高特异性和全面的人口覆盖率,是一种极具潜力的新型冠状病毒候选疫苗。
塔希尔· 卡玛尔(Tahir UlQamar)等[77] 利用多种生物信息学软件对新型冠状病毒S、E和M 蛋白表面的B 细胞表位进行预测, 共筛选到23 个线性表位、9 个MHC- Ⅰ 类和7 个MHC- Ⅱ 类表位。最终选取3个CTL、6 个HTL 和4 个BCL表位构建一种基于多表位的亚单位疫苗(multiepitope-based subunit vaccine,MESV), 通过计算机模拟预测该疫苗可覆盖全球88.4% 的人口,并且可与先天免疫受体TLR3 稳定结合,使其可能被引入宿主免疫系统。通过计算机模拟,该疫苗能引起强烈的免疫反应且不产生过敏反应,同时也可在E.coli K-12 系统中表达。但该研究依赖计算机模拟以及免疫信息学,需要进一步的体内外实验验证其预测的准确性,为所设计的MESV 提供更加全面的数据基础。
2.2 流行性感冒病毒
流行性感冒病毒(influenza virus),简称流感病毒,分为甲(A)、乙(B)、丙(C)和丁(D)四型,感染流感病毒后可引起人禽畜等多种动物发病。其中,人流感病毒主要由甲、乙和丙三型组成,人感染后可引起季节性流感、禽流感和人畜共患型流感。流感病毒在全球范围内广泛传播,可感染任何年龄段的人群,甲型流感病毒(influenza A virus)曾多次引起世界性大流行,严重的可造成重大疾病甚至死亡,预防流感病毒感染最有效的办法就是接种疫苗。
流感病毒结构由包膜、基质蛋白和核心三部分组成,包膜上含有2 种非常重要的糖蛋白:血凝素(HA)和神经氨酸酶(NA),基质蛋白构成了病毒的骨架,核心包含了病毒的遗传物质和酶。流感病毒HA 蛋白具有免疫原性,抗HA 抗体可中和流感病毒,NA蛋白切断流感病毒与宿主细胞的联系,可作为流感治疗药物的靶点。流感病毒不同基因组之间易发生基因重组,主要为抗原转变和抗原漂移。流感病毒的高度变异性导致人们无法预测即将流行的病毒株,随即无法针对性地进行疫苗接种。因此,WHO 全球流感监测和应对系统(Global Influenza Surveillance and Response System,GISRS)持续监测人类中流行的流感病毒,并每半年更新一次流感疫苗组分。
夏尔马(Sharma)等[78] 选取1918 年、1957 年、1968 年和2009 年引起流感大流行以及世界范围内不同地区季节性流感流行病毒株,共50 株甲型流感病毒, 这些毒株来自5 种甲型流感病毒亚型(H1N1、H2N2、H3N2、H5N1 和H7N9), 并利用多种生物信息学软件对其HA、M1 和NP 蛋白上的CTL、HTL和BCL 表位进行预测,每种蛋白选取4 种MHC- Ⅰ类表位(A1、A2、A3 和B7)。该研究在HA蛋白上识别到18 个CTL 表位、25 个HTL 表位和5 个BCL 表位;M1 和NP 蛋白上均识别到4 个CTL 表位、5 个HTL 表位和1 个BCL 表位。结合每一类蛋白的保守性和HLA 等位基因覆盖率等因素,最后构建一个含有26 个CTL 表位、9 个HTL 表位和7 个BCL 表位的通用流感亚单位疫苗。利用RaptorX 预测到该疫苗具有高度稳定的三级结构,并与TLR3、TLR7、TLR8、MHC- Ⅰ 和MHC- Ⅱ 能形成稳定的复合物,通过计算机模拟可知该疫苗具有一定免疫原性。
2.3 呼吸道合胞病毒
呼吸道合胞病毒(respiratory syncytial virus)是导致细支气管炎和肺炎的主要病原体,其中6个月以下婴儿为高风险人群,同时呼吸道合胞病毒也可导致老年人以及免疫缺陷人群发生严重的呼吸道疾病[79]。1 岁以下婴儿因感染呼吸道合胞病毒导致死亡的病例占急性呼吸道感染死亡病例的1/3,每年有多达20 万儿童死于呼吸道合胞病毒感染[80]。由于呼吸道合胞病毒在进化过程中形成了多种免疫逃逸机制,目前尚无呼吸道合胞病毒疫苗上市。
呼吸道合胞病毒基因组主要编码3 种跨膜蛋白(F、G 和SH)、2 种基质蛋白(M1 和M2)、3 种核衣壳蛋白(N、P 和L)以及2 种非结构蛋白(NS1和NS2)。多项研究结果表明,呼吸道合胞病毒的F 和G 蛋白在促进细胞感染和调节宿主免疫反应等方面起到重要作用[81-82],可作为呼吸道合胞病毒疫苗研发的重点[83-85]。
孙誉芳等[86] 将呼吸道合胞病毒胞外区第64~298 位氨基酸作为目标区域, 利用多种生物信息学软件对该区域进行B、Th 和CTL 细胞表位预测, 综合预测分值并选取共有序列,最终确定呼吸道合胞病毒G 蛋白的5 个B 细胞表位、10 个Th表位和9 个CTL 表位。预测到的B 细胞表位分别位于85~90、142~147、227~231、250~258和280~295 区段, 其中第250~258 位和第280~295 位氨基酸可与呼吸道合胞病毒感染者血清发生反应[87], 第142~204位氨基酸与乙肝病毒嵌合的病毒样颗粒疫苗免疫小鼠可诱导产生呼吸道合胞病毒特异性中和抗体IgG,并对呼吸道合胞病毒感染具有保护作用[88]。有研究采用HLA-A3 型多肽( 第184~198位氨基酸)免疫小鼠后,可诱导产生Th1 型细胞因子,且小鼠体内嗜酸性粒细胞增多[89],与孙誉芳等[86] 研究预测的第188~197位氨基酸相似。第130~230 位氨基酸串联在复制缺陷型腺病毒载体上,可在小鼠体内诱导强烈的CD4+T 细胞反应[90]。该研究综合多种预测结果,筛选出呼吸道合胞病毒G 蛋白上的多个抗原表位,其中有部分抗原表位已被证实能诱导小鼠体内细胞免疫和体液免疫,并且对呼吸道合胞病毒感染具有保护作用,为呼吸道合胞病毒疫苗的研发提供了理论依据。
2.4 人类免疫缺陷病毒
人类免疫缺陷病毒(human immunodeficiency virus) 又称艾滋病病毒,感染人类免疫缺陷病毒后会引起危害性极大的传染病──艾滋病(acquired immunedeficiency syndrome,AIDS)。人类免疫缺陷病毒主要破坏人体自身免疫系统,致使人体丧失免疫功能。人类免疫缺陷病毒感染者进入艾滋病期后会引起各种机会性感染和肿瘤的发生,甚至威胁生命,迄今为止人类免疫缺陷病毒仍然是全球公共卫生问题之一[91]。目前,全世界范围内尚无可以有效预防人类免疫缺陷病毒感染的疫苗上市,且人类免疫缺陷病毒易发生变异和免疫逃逸,急需能够解决以上问题的有效疫苗。
人类免疫缺陷病毒基因组包含3 个结构基因(gag、pol 和env)、2 个调节基因(tat 和rev)以及4 个辅助基因(vif、vpr、vpu 和nef)[92]。其中,Vpr 蛋白具有免疫抑制作用,可以作为治疗人类免疫缺陷病毒感染的一个重要靶点[93-96]。萨巴赫(Sabbah)等[97] 证实了抗Vpr 抗体的免疫原性,证明Vpr 作为人类免疫缺陷病毒治疗靶点的重要意义,但未能阐明该抗体在Vpr 蛋白上的结合位点。
孙俊等[98] 将人类免疫缺陷病毒数据库中所有中国来源的人类免疫缺陷病毒1 型 B 亚型和CRF07_BC 重组型毒株的Vpr 蛋白序列生成共享序列,利用多种生物信息学软件分析和预测Vpr 蛋白共享序列潜在的B 细胞表位, 确定Vpr 蛋白N 端的第3~19 位氨基酸和C 端的第82~95 位氨基酸为Vpr 蛋白共享序列的B 细胞抗原表位。分别合成肽段并与载体蛋白血蓝蛋白(keyhole limpet hemocyanin,KLH)偶联后免疫家兔,纯化得到Vpr 蛋白多肽特异性抗体。体外验证实验表明,该抗体可以识别不同亚型人类免疫缺陷病毒1型的Vpr 蛋白,并且能特异性识别天然状态和变性状态下的Vpr蛋白。该研究成功利用反向疫苗学技术制备出具有较好特异性和通用性的Vpr 多肽抗体,为人类免疫缺陷病毒疫苗的研制提供了理论基础。
方塞卡(Fonseca) 等[99]筛选人类免疫缺陷病毒1 型 B 亚型全基因组序列中最保守区域的CD4+T 细胞表位, 得到一组多个HLA-DR 结合的CD4+T 细胞表位。随后,利用32 位人类免疫缺陷病毒1 型感染者的外周血单个核细胞(peripheral blood mononuclear cell,PBMC) 对合成多肽进行识别, 其中高达91% 患者的PBMC 可识别这些表位,同时该方法还鉴定出大多数未知的CD4+T 细胞表位。此外,这些表位也能被CD8+T 细胞识别,并且与人类免疫缺陷病毒1型的A、C、D 和F 分离株序列有50% 以上的重合。该研究利用反向疫苗学技术预测得到的抗原表位,理论上可覆盖多种毒株且可能引起跨分支保护,可用作人类免疫缺陷病毒疫苗的候选抗原分子。
2.5 登革病毒
感染登革病毒(dengue virus)后会引起登革热(dengue fever,DF)、登革出血热(dengue hemorrhagic fever,DHF) 和登革休克综合征(dengue shock syndrome,DSS)。登革病毒含有4 种血清型,感染一种血清型康复后,对该血清型终身免疫,但对其余血清型只有部分短暂的交叉保护,若后续再次感染其他血清型,可能会引起抗体依赖性增强效应(antibody dependent enhancement,ADE) 从而导致更加严重的临床表现。目前全球范围内已有两款针对登革病毒的疫苗获批上市。第一款是于2015 年获批的重组四价减毒活疫苗CYD-TDV,该疫苗对接种前已感染者(血清阳性)具有一定的保护效力,但未感染者(血清阴性)在接种该疫苗后反而增加了患登革热的风险[100]。针对已批准该疫苗上市的国家,WHO 建议仅对有既往登革病毒感染人群进行接种[101]。第二款是于2022年在印度尼西亚获批的四价减毒活疫苗TAK-003,不论先前是否暴露于登革病毒,在接种该疫苗后的3 年内,TAK-003 持续保护接种者避免登革病毒感染,但保护效果因血清型而异,并随着时间的推移而下降[102]。整体来说,目前虽然已有两款获批上市的登革病毒疫苗,但适用范围、安全性及保护持久性仍待考察。
登革病毒基因组编码3 个结构蛋白(C、prM 和E) 和7个非结构蛋白(NS1、NS2A、NS2B、NS3、NS4A、NS4B和NS5)。登革病毒E 蛋白上的抗原决定簇可以诱导宿主产生中和抗体和血凝抑制抗体[103],NS1和NS3 蛋白具有免疫原性和免疫反应性[104-105]。
胡云章团队[106] 检索了中国分离的155 株登革病毒(4 个血清型)的NS5 蛋白序列,利用dbMHC 数据库检索中国人群HLA Ⅰ类(HLA-A、HLA-B 和HLA-C)等位基因的分布,分析筛选到116 个与HLA Ⅰ类等位基因相互作用的CD8+T 细胞表位,利用计算机预测并分析候选表位的抗原性、保守性及种群覆盖率。筛选到14 个高度保守表位, 其中NS592-99、NS5200-210、NS5362-369 和NS5514-524 4个表位组合可对我国90% 以上个体进行免疫。
曹虹团队[107] 利用多种生物信息学软件预测分析了登革病毒1 型夏威夷株E 蛋白Ⅱ区和登革病毒2 型NGC 株E 蛋白Ⅲ区的B、T 细胞表位,发现登革病毒1 型ED Ⅱ 281-295 和登革病毒2 型ED Ⅲ 345-359、ED Ⅲ 383-397 可能为登革病毒潜在的B、T 细胞表位。该团队[108] 后续在体内外均验证ED Ⅲ 345-359 和ED Ⅲ 383-397具有良好的免疫原性。并再次利用生物信息学工具设计将筛选到的B、T 细胞表位(ED Ⅲ 345-359、ED Ⅲ 383-397) 和泛DR 表位(PADRE)串联构建成一个多表位肽疫苗,随后免疫小鼠评价其诱导体液、细胞免疫应答效果和免疫保护性,体内实验结果检测到该多表位肽疫苗诱导小鼠产生了高水平抗体。
2.6 狂犬病毒
人类因被患病兽抓伤或咬伤而感染狂犬病毒(rabies virus),狂犬病毒进入人体后先感染肌细胞,随后侵入末梢神经,最后随血液扩散至脑干和小脑处神经元从而导致疾病。感染狂犬病毒后会引起高致死性人畜共患病──狂犬病,一旦发病即为100% 死亡,严重威胁到人畜的健康。目前对于狂犬病缺乏有效的治疗手段,但可通过疫苗进行预防。现有的狂犬病毒疫苗可以提供一定的保护,但其存在免疫程序繁琐、细胞免疫反应较弱、抗体水平不持久等问题。
狂犬病毒基因组含5 个ORFs,编码5 种结构蛋白(N、P、M、G 和L)。其中,G 蛋白和N蛋白是狂犬病毒的主要抗原,可诱导机体细胞免疫和体液免疫[109-113]。G 蛋白可诱导产生中和抗体和血凝抑制抗体,N 蛋白可诱导产生补体结合抗体和沉淀素。
胡晓波等[114] 利用反向疫苗学技术对狂犬病毒G、N 蛋白的CTL 细胞和Th 细胞表位进行预测分析, 选取了4 条针对MHC- Ⅰ类分子的候选多肽,4条针对MHC-Ⅱ类分子的候选多肽。分别合成多肽后免疫小鼠,G367-381 和G333-341 均可诱导分泌IL-4 和IFN-γ, 其中G367-381主要诱导分泌IL-4,G333-341 主要诱导分泌IFN-γ。G367-381 主要诱导产生以CD4+T 细胞增殖为主的Th 型免疫应答,而G333-341则主要诱导产生以CD8+T 细胞增殖为主的CTL 型免疫应答。该研究结合生物信息学技术和免疫学实验,筛选并验证了2 条狂犬病毒G 蛋白的多肽,分别是潜在的Th 表位和CTL 表位。
狂犬病毒P 蛋白不仅可作为分子伴侣促进病毒RNA 的合成,还可抑制干扰素信号转导[115],是先天免疫反应的关键调控因子。张金阳等[116] 利用生物信息学软件对狂犬病毒Flury-HEP 株P蛋白的二级结构进行预测,并分析狂犬病毒P 蛋白的表面可及性、柔性、亲水性和抗原性,最终筛选出11 个潜在的B 细胞抗原表位。再将合成的狂犬病毒P 基因与真核表达载体pCI-neo 连接,后转染成神经瘤细胞并用狂犬病毒多抗血清进行免疫荧光检测,证实其在体外成功表达,并被狂犬病毒标准阳性血清识别。该研究中狂犬病毒P 蛋白真核表达验证了生物信息学分析预测的可靠性,为进一步狂犬病毒单克隆抗体、抗病毒活性多肽以及疫苗研制奠定了理论基础。
2.7 丙型肝炎病毒
感染丙型肝炎病毒(hepatitis C virus)后会引起急性或慢性肝炎,甚至发展为肝硬化和肝细胞癌。抗病毒药物可使95% 以上的丙型肝炎感染者得到治愈,但若后期再次暴露在高风险环境中,会有重新感染的风险[117]。因此,预防性丙型肝炎病毒疫苗对阻断丙型肝炎病毒传播十分重要。但由于丙型肝炎病毒基因组具有显著异源性和高度可变性[117-118],基因组各部分的变异程度也并不一致,研发针对某一靶点的疫苗无法起到完全的保护作用。另外, 丙型肝炎病毒在体外很难感染和培养, 几乎无法开展减毒和灭活疫苗的研发工作, 同时缺乏合适的动物模型, 进一步限制了丙型肝炎病毒疫苗的研发工作。目前尚无有效的丙型肝炎病毒疫苗问世。
万祥辉等[119] 采用单参数方案, 利用反向疫苗学技术对我国丙型肝炎病毒主要流行基因型1b、2a 和6a 型的B 细胞、CTL 细胞和Th 细胞的抗原表位分别进行预测和筛选,设计了一种能有效诱导体液免疫和细胞免疫的多抗原表位串联疫苗。并利用不同的组合方式联合免疫小鼠,联合免疫和单独免疫均诱导了小鼠体内特异性免疫应答。当效靶比为25 ∶ 1 和50 ∶ 1 时,HCV-(CTL+B+Th) 联合免疫激活的CTL 活性高于HCVCTL单独免疫;HCV-(CTL +B + Th)联合免疫诱导小鼠产生分泌IFN-γ 的细胞数明显高于HCV-CTL 单独免疫及HCV-(B + Th)联合免疫后产生的细胞数;HCV-(CTL + B + Th)联合免疫与HCV-(B + Th)免疫均诱导了强烈的体液免疫。体内实验证明,该研究筛选到的抗原表位可有效诱导小鼠的体液免疫和细胞免疫,且持续保护效果良好。
皮什拉夫·萨比特(Pishraft Sabet)等[120] 利用多种生物信息学软件对丙型肝炎病毒HLA-A2限制性表位进行筛选,随后利用肽结合建模优化了表位排列,分别设计了丙型肝炎病毒多表位DNA 疫苗和丙型肝炎病毒多肽疫苗, 包含CD8+T 细胞、CD4+T细胞、Th 细胞及B 细胞表位。多肽疫苗免疫小鼠后产生的IgG、IFN-γ 水平明显高于多表位DNA 疫苗,而多表位DNA 疫苗可诱导小鼠产生更高的Th1 免疫应答。该研究利用小鼠模型评价了筛选表位的免疫原性,并且根据实验结果合理预测,多表位DNA 疫苗配合强佐剂可能提高疫苗的保护效果,为进一步优化HLA-A2 限制性表位疫苗提供了方案和依据。
2.8 埃博拉病毒
埃博拉病毒(Ebola virus)是一种非常罕见的病毒, 是世界上最高级别的病毒之一, 生物安全等级为4 级, 目前已确定5 个埃博拉病毒亚型。感染埃博拉病毒后会引起人类和灵长类动物患埃博拉出血热(Ebola hemorrhagic fever,EBHF),病死率为50%~90%。埃博拉病毒仅在个别国家和地区间歇性流行, 在时空上有一定的局限性。但为防止更大规模的传播流行,采取一定预防措施十分重要。目前,一款实验性疫苗(rVSV-ZEBoV)仅在2018~2019 年刚果(金)发生埃博拉疫情期间得到使用。
埃博拉病毒基因组编码7 个结构蛋白和2 个非结构蛋白。其中,糖蛋白、核蛋白、基质蛋白(VP40)在埃博拉病毒的感染、增殖和生命周期中发挥重要作用,是埃博拉病毒疫苗研制的潜在靶点[121-123]。
陈薇团队[124] 对EBO-Sudan和EBO-Zaire 株GP 蛋白上小鼠H-2d MHC- Ⅰ 类限制性表位进行预测,再将各生物信息学软件排名前五的预测结果进行汇总,最终选定了12 个多肽。随后利用表达埃博拉病毒GP 复制缺陷型腺病毒载体免疫小鼠进行评价,体内实验结果表明,RPHTPQFLF(EBO-Sudan)、GPCAGDFAF 和LYDRLASTV(EBO-Zaire)能刺激小鼠脾细胞产生大量的IFN-γ,这3 个多肽可作为埃博拉病毒GP 上的T细胞表位,可成为埃博拉病毒疫苗研发的候选位点。
邦茨( Bounds) 等[125] 对EBO-Sudan 和委内瑞拉马脑炎病毒(Venezuelan equineencephalitis virus) 的NP 和GP 蛋白中HLA- Ⅱ类限制性T细胞表位进行预测,筛选了44 个表位进行体外结合分析,其中有21 个多肽与HLA-DR 表位强烈结合,最后选取17 个可与小鼠的MHC- Ⅱ类等位基因结合的表位免疫小鼠。普通小鼠在接种该疫苗后体内产生委内瑞拉马脑炎病毒抗体,但没有检测到埃博拉病毒抗体;HLA-DR3 转基因小鼠在接种该疫苗后,有4 个多肽产生了明显的细胞免疫反应,并产生了埃博拉病毒和委内瑞拉马脑炎病毒抗体,但随后的攻毒实验中发现该候选疫苗并不具备保护效果。
3、 在寄生虫疫苗研发中的应用
3.1 疟原虫
疟原虫是通过按蚊叮咬进行传播,寄生于人类的疟原虫有4种,分别是恶性疟原虫、间日疟原虫、三日疟原虫和卵形疟原虫,感染后分别引起恶性疟、间日疟、三日疟和卵形疟。恶性疟可发展为严重疾病, 甚至死亡。2021年10 月,WHO 建议生活在恶性疟原虫中高度传播地区的儿童使用RTS,S/AS01 疟疾疫苗[126],但该疫苗伴有严重的不良反应(24.2%~28.4%)[127]。目前还没有一种有效的人类疟疾疫苗为疟疾流行地区人口提供保护。
恶性疟原虫编码的多肽家族(RIFIN)、亚端粒变异开放阅读框(STEVOR)和恶性疟原虫红细胞膜蛋白1(PfEMP1)分别存在于寄生虫感染红细胞的表面[128]。
普里塔姆(Pritam) 等[129]对疟原虫基因组中保守的5 种同源抗原进行抗原表位预测,筛选到82 个连续B 细胞表位,这些连续B 细胞表位共包含433个T 细胞表位, 其中有142个HLA- Ⅰ 类表位和291 个HLA- Ⅱ类表位。根据不同的佐剂和连接子组合筛选到的表位集合,共设计了15 个多肽疫苗。利用软件预测了15 个多肽疫苗的三级结构, 并利用ClusPro2.0对该多肽疫苗与受体分子TLR2和TLR4 的对接进行模拟,结果显示有12 个多肽疫苗能与受体分子对接。接着利用VaxiJen、ANTIGENPro 和Secret-AAR等工具预测到有2 个肽段具有诱导体液和细胞免疫反应的能力。但该研究需要进一步体内外实验进行验证,以评估多肽疫苗的有效性。
马哈拉杰(Maharaj)等[130]利用生物信息学软件对恶性疟原虫共751 条序列进行初步筛选,对48 个满足抗原性的序列进行进一步抗原表位筛选,最初筛选到77 个CD8+T 细胞表位、177个CD4+T 细胞表位。经过致敏性等性质评估,最终保留10 个CD8+T 细胞表位、12 个CD4+T细胞表位和1 个B 细胞表位。经过计算机模拟可知,这些表位均可与相应的HLA 等位基因结合,并且能与TLR4形成稳定的结合物。
3.2 血吸虫
人体一般通过皮肤接触含尾蚴的水而感染血吸虫,感染后会引起血吸虫病。该疾病导致的残疾病例多于死亡病例,对经济发展造成严重影响。据WHO 估计,2019 年至少有2.366 亿人需要获得血吸虫病预防性治疗[131]。目前,预防性治疗血吸虫病的措施是对目标群体进行吡喹酮治疗,但没有适合学龄前儿童的吡喹酮配方,且吡喹酮可得性有限,极大影响了血吸虫病防控工作。同时,目前尚无可用于预防血吸虫病的疫苗。
拉赫玛尼(Rahmani)等[132]选择了曼氏血吸虫不同株间保守的7 种蛋白作为候选抗原,预测到12 个CTL 表位、14 个针对MHC- Ⅱ等位基因的HTL 表位,随后构建了一个含有617 个氨基酸的嵌合疫苗。利用Mfold 对候选序列的mRNA 二级结构进行预测,结果显示该mRNA 具有较好的稳定性。并且MD 建模结果表明,该候选疫苗能与TLR4 产生良好的相互作用,具有诱导T 细胞和B 细胞免疫应答的潜力。
桑奇斯(Sanches) 等[133]以曼氏血吸虫的跨膜蛋白为目标,利用生物信息学工具对584 个序列进行筛选,将候选抗原减少到37 个质膜蛋白,并设计了两组抗原表位,一组为CTL 与B 细胞重叠表位, 另一组为HTL 与B细胞重叠表位,经过抗原性分析后最终确定了19 个表位作为疫苗的组成。经过计算机模拟预测得知,该MEV 具有诱导持久体液免疫和细胞免疫的潜力,并能与细胞表面受体TLR4 稳定结合。
3.3 利什曼原虫
利什曼原虫通过沙蝇为媒介进行传播,感染后会引起人畜共患病——利什曼病,其中最严重的为黑热病,患病后若不进行治疗会导致超过95% 的死亡率。据估计,全球每年有70 万~100 万利什曼病新发病例出现[134]。目前,尚缺乏安全有效的利什曼病疫苗。
德布里托(De Brito)等[135]将婴儿利什曼原虫9 种已知具有免疫原性的蛋白作为候选抗原, 利用多种生物信息学软件预测了候选抗原中MHC-Ⅰ、MHC-Ⅱ 类表位, 并根据这些表位对人类和小鼠MHC 等位基因的亲和力确定了12 个候选表位,构建2 种嵌合体疫苗。利用RaptorX 进行预测发现,这2 种嵌合体分别能与TLR3 和TLR4相结合,并能触发免疫反应。嵌合体免疫小鼠后可以诱导小鼠体内多功能T 细胞增殖并产生IFN-γ 和IFN-α, 还能诱导T淋巴细胞的记忆效应,降低小鼠脾脏中的寄生虫载量。
塞西尔(Cec í lio)等[136] 将疫苗设计策略转向传播媒介沙蝇,选取2 种具有免疫原性潜力的沙蝇唾液蛋白PdSP15 和LJL143组成融合蛋白,使宿主产生抗媒介唾液免疫反应。利用反向疫苗学技术对融合蛋白进行CD4+T、CD8+T 细胞表位预测, 并结合人和小鼠MHC-Ⅰ、MHC-Ⅱ等位基因进行筛选,设计了一种DNA 疫苗。该疫苗免疫小鼠后可诱导小鼠体内T 细胞增殖,验证了融合蛋白的免疫原性。
3.4 隐孢子虫
隐孢子虫是一类体积微小的球虫类寄生虫,广泛存在于脊椎动物体内,感染后引起以腹泻为主要临床表现的人畜共患病——隐孢子虫病。免疫功能低下患者病情会相对严重,甚至威胁生命。
潘达(Panda) 等[137] 采用比较基因组学和免疫信息学预测筛选到7 个可通过阻断酶活性而抑制病原体的蛋白质, 其中cgd3_1400 作为疫苗候选蛋白,利用ABCpred 和CTLpred 预测到疫苗候选蛋白上存在3 个B细胞表位和3 个CTL 表位, 并利用ClusPro 预测了候选表位与MHC-Ⅰ、MHC-Ⅱ 类等位基因对接结果。该研究结果为有效应对隐孢子虫病提供了疫苗候选分子。
哈桑(Hasan) 等[138] 利用生物信息学软件在6 种隐孢子虫蛋白中筛选到13 个MHC-Ⅰ类特异性CTL 表位,6 个HTL 表位和6 个B 细胞表位,并构建一种MEV。通过软件模拟分析可知,该疫苗具有稳定的结构,并且与TLR2 形成稳定的复合物,能在体内引起明显的免疫反应。
4、 展望
反向疫苗学技术的高速发展得益于相关技术的进步。随着测序技术的迭代更新,流行株的全基因组序列信息可在短时间内获取,病原体基因组信息库得到不断扩容和丰富,目前已有上百种病原体全基因组信息被全面解析。泛基因组学和比较基因组学的发展,帮助我们快速了解病原体流行株抗原突变的信息和趋势,筛选新的抗原分子或优化已有的疫苗分子序列,以获得更有效的针对性疫苗和通用疫苗。不仅如此,越来越多的新型技术应用于反向疫苗学技术,可补充和完善疫苗设计过程中的缺陷和不足,最终设计或改良出更加高效安全的新型疫苗。
反向疫苗学技术作为新型疫苗研发工具,其发展时间相对短暂,本身还存在着一些不足之处。但是,目前已通过反向疫苗学技术针对B 群脑膜炎球菌、呼吸道合胞病毒、人类免疫缺陷病毒、新型冠状病毒和多种寄生虫等病原体,筛选出候选疫苗分子。其中,针对B 群脑膜炎球菌的二价rLP2086(Trumenba®) 和4CMenB(Bexsero®)疫苗已完成临床学阶段研究,并获批上市。反向疫苗学技术的迅猛发展,在未来能够不断攻克复杂病原体的检测和防疫难点,为人类健康事业保驾护航,为全球公共卫生事业贡献一份力量。