您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-11-18 05:02
本文主要介绍了安徽达健医学科技有限公司研发的医疗器械“人Twist1基因甲基化检测试剂盒(荧光PCR法)”的临床前研发实验。
一、人Twist1基因甲基化检测试剂盒(荧光PCR法)产品的主要组成成分
试剂盒 I:亚硫酸氢盐转化试剂盒(离心柱型)
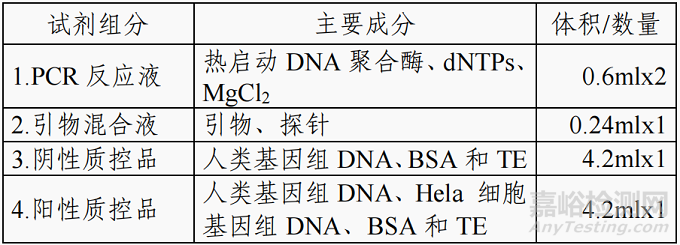
试剂盒 II:PCR 扩增试剂盒
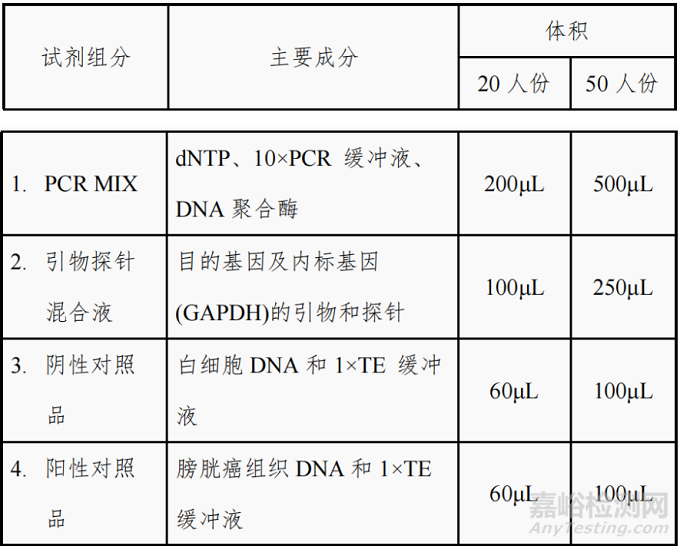
注:不同批号的试剂盒中各组分不可以互换使用。具体内
容详见产品说明书。
二、人Twist1基因甲基化检测试剂盒(荧光PCR法)产品的预期用途
本试剂盒用于体外定性检测尿脱落细胞中膀胱癌相关Twist1基因甲基化状态。本产品用于初诊膀胱癌的辅助诊断。
膀胱癌是世界上常见的恶性肿瘤之一,也是引起泌尿系统肿瘤患者死亡的第二大肿瘤,早期发现膀胱癌可以增加手术保留膀胱的机会并提高患者总体生存率。研究发现可以在膀胱癌组织和患者尿液中检测到膀胱癌相关Twist1基因存在过度甲基化,检测 Twist1 基因甲基化状态可以用于初诊膀胱癌的辅助诊断。本试剂盒采用甲基化特异性实时荧光 PCR 法检测尿脱落细胞中膀胱癌相关 Twist1 基因的甲基化状态,是一种初诊膀胱癌辅助诊断方法。本试剂盒适用于血尿、尿频、尿急和尿痛等临床上疑似膀胱癌、临床诊断建议进行膀胱镜检查患者的辅助诊断。本产品仅作为现有诊断方法的补充和辅助,供临床医师参考。
三、人Twist1基因甲基化检测试剂盒(荧光PCR法)产品的包装规格
20 人份/盒、50 人份/盒
四、人Twist1基因甲基化检测试剂盒(荧光PCR法)产品的检验原理
本产品包括两个步骤:
步骤I,用试剂盒I将提取的基因组DNA进行亚硫酸氢盐转化,未发生甲基化的胞嘧啶被转化为尿嘧啶,而甲基化的胞嘧啶不变。
步骤II,将亚硫酸氢盐转化的DNA(Bis-DNA)做PCR扩增,试剂中含有膀胱癌相关Twist1基因甲基化特异性引物探针和内标基因(GAPDH)引物探针。甲基化特异性引物探针能与膀胱癌相关甲基化Twist1基因序列特异性结合,可以在PCR反应中特异地检测出甲基化序列。同时,内标基因(GAPDH)可监控每个样本的提取及PCR反应管的扩增情况,从而避免假阴性或部分抑制结果的发生。另外,试剂盒还提供了阳性对照品和阴性对照品,需在每一次检测中同时加入。
五、人Twist1基因甲基化检测试剂盒(荧光PCR法)产品的主要原材料选择
本产品的主要原材料包括 dNTP、Taq 酶、亚硫酸氢盐、引物和探针。这些原材料均是通过外购的方式获得。
其中引物、探针的序列由达健医学自行设计,由合成公司经过合成、修饰、纯化方式获得;Taq 酶由原材料供应商克隆表达后获得;dNTP、亚硫酸氢盐由供应商化学合成获得。
达健医学对主要原材料进行了供应商的选择,通过功能性试验筛选出合格供应商,制定了主要原材料的技术要求和质量标准并经检验合格。
六、人Twist1基因甲基化检测试剂盒(荧光PCR法)产品的企业参考品和质控品设置情况
本产品企业参考品包括阳性参考品、阴性参考品、精密度参考品以及检出限参考品。
企业参考品包括 Twist1 基因相应位点甲基化阳性的样本,这些样本Twist1基因的甲基化状态均经过数字PCR方法验证。
阳性参考品包括 3 种,分别命名为阳性参考品 P1-P3,为一定 DNA 浓度下 Twist1 基因不同甲基化比例的样本。阴性参考品包括 4 种,分别命名为阴性参考品 N1-N4,其中 N1 为一定浓度下含有低于检出限的甲基化 Twist1 基因样本,N2-N4 为一定浓度下分别含有其它不同肿瘤相关的基因甲基化的样本。
精密度参考品包括 3 种,分别命名为 J1-J3,其中 J1 为非膀胱癌患者样本,J2 和 J3 为一定 DNA 浓度下 Twist1 基因不同甲基化比例的样本。
检出限参考品包括 3 种,分别命名为 L1-L3,为一定低甲基化比例下不同浓度的样本。
本试剂盒同时设置了阳性对照和阴性对照,用于检测过程中的试剂和仪器的质量控制。此外,每个样本均检测内参基因GAPDH,用于结果的判读及评估样本的质量。
七、人Twist1基因甲基化检测试剂盒(荧光PCR法)产品的生产工艺及反应体系研究
达健医学对试剂盒反应体系的研究包括引物探针浓度的确定、DNA 聚合酶用量的确定、PCR 缓冲液用量的确定、镁离子浓度的确定、dNTP 浓度的确定、PCR 反应体积的确定、PCR 模板体积的确定、转化液用量的确定、缓冲液浓度的确定、结合液浓度的确定、脱磺液浓度的确定等;对 PCR 反应条件的研究包括退火温度及时间、预变性温度及时间、变性时间、循环数等。通过功能性实验,最终确定了最佳反应体系。
达健医学根据试剂盒中试剂及组件的主要生产工艺的研究结果,确定了最佳的生产工艺。
八、人Twist1基因甲基化检测试剂盒(荧光PCR法)产品的分析性能评估研究
本产品分析性能评估内容包括准确度、精密度、检出限、分析特异性、企业参考品的符合性、不同规格性能研究、亚硫酸氢盐转化效率等研究。
准确度研究中,达健医学选择了若干临床尿液样本对试剂盒的检测准确性进行研究,研究结果显示试剂盒检测结果与测序结果阳性符合率为100%、阴性符合率为96.67%。
精密度研究中,达健医学使用精密度参考品,分别用三批次试剂盒由两位操作者在 20 天进行连续的检测。结果显示试剂盒对精密度参考品的批内、日间、批间、仪器、人员和地点间的检测变异系数均小于等于 5%。
检出限研究中,以阴性尿液样本为基质,采用不同浓度、不同甲基化比例的模拟样本,每个浓度梯度的样本检测 20 次进行检出限的确认。使用连续生产的三个批次的试剂盒,用多例真实临床样本在检出限浓度水平上进行检出限的验证。明确了试剂盒的检出限为 5ng/uL 的野生型 DNA 背景下,5% 的 Twist1 甲基化 DNA。
分析特异性研究包含交叉反应和干扰研究,交叉反应研究包括其它基因甲基化的样本、转化前尿液样本、常见尿道微生物样本,均无交叉反应;用三批试剂盒检测其它恶行肿瘤患者尿液样本,包括肝癌、胃癌、肾细胞癌、前列腺癌,结果显示均无交叉反应。在上尿路肿瘤特异性研究中,检测结果显示试剂盒对上尿路肿瘤(输尿管癌、肾盂癌)有一定的阳性检出率,试剂盒检测结果与测序结果完全一致。
干扰试验结果显示,尿液中分别含有以下干扰物:尿酸(1.4mmol/L)、葡萄糖(55mmol/L)、抗坏血酸(170μmol/L)、白蛋白(60g/L)、酮体(12mmol/L)、尿胆原(10.65μmol/L)、亚硝酸盐(120mg/L)、pH 为 8.0、氨(107μmol/L)、甘油三酯(37mmol/L)、血红素(2g/L)、维生素 C(170μmol/L),常用药物如盐酸左氧氟沙星(1.08g/L)、四环素(780mg/L)、青霉素(27g/L)、头孢克肟(426.6mg/L)、布洛芬胶囊(478.8mg/L)、感冒灵胶囊(9g/L)对检测结果无影响。膀胱癌常用灌注治疗药物卡介苗(360mg/L)、丝裂霉素(120mg/L),表柔比星(150mg/L)会影响检测的敏感性,因此接受化疗药物治疗后 1 个月内勿留样检测。
企业参考品的符合性研究中,达健医学分别使用三批试剂盒对阳性参考品和阴性参考品进行检测,检测结果显示阳性符合率、阴性符合率均为 100%。
达健医学采用临床尿液样本进行了核酸提取试剂盒性能研究,并根据与该产品的组合性能研究结果,确定推荐的核酸提取试剂符合检测要求。
九、人Twist1基因甲基化检测试剂盒(荧光PCR法)产品的阳性判断值或参考区间研究
本产品阳性判断值的研究采用真实尿液样本。阳性判断值研究入组(包括建立和验证)有效样本数共计 164 例,样本来源包括膀胱癌患者、肾细胞癌患者、前列腺癌患者、输尿管癌患者、肾盂癌患者、输尿管炎、尿路上皮增生、膀胱无病变人群等。
采用百分位数法确定内标基因的 Ct 值的范围,内标基因 Ct 值≤25 时判定样本合格。采用 ROC 曲线法和约登指数确定试剂盒阳性判断值为10。当ΔCt值≤10时判断为阳性,ΔCt 值>10 时判断为阴性。
十、人Twist1基因甲基化检测试剂盒(荧光PCR法)产品的稳定性研究
达健医学对该产品的稳定性研究包括货架效期稳定性、运输稳定性、使用稳定性(包括开瓶稳定性、冻融稳定性)及样本稳定性(包括尿液、尿液提取 DNA 及尿液提取转化后 DNA的稳定性)。
货架有效期稳定性:将三批试剂盒置于规定储存条件下放置 0、2、4、6、8 个月,每到一个时间节点使用企业参考品对试剂盒的性能进行检测,结果显示试剂盒在生产后保存至 8 个月各项性能指标均符合产品技术要求,产品有效期可达 6 个月。
此外,达健医学对产品的运输稳定性、使用稳定性和样本稳定性分别进行了研究。结果显示,产品的性能均能满足产品说明书的声称。

来源:嘉峪检测网


