您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-05-18 02:53
摘要ABSTRACT
4月15日,国家市场监督管理总局国家标准化管理委员会发布公告,批准了多项推荐性国家标准,其中包括《医疗器械生物学评价 第1部分:风险管理过程中的评价与试验》,标准编号GB/T 16886.1-2022。据悉,该标准将于2023年5月1日正式实施,代替现行标准GB/T 16886.1-2011。
新标准的诞生
现行的推荐性国家标准GB/T 16886.1-2011《医疗器械生物学评价 第1部分:风险管理过程中的评价与试验》发布于2011年6月,并于当年12月1日正式实施,至今已经运行了10余年时间。
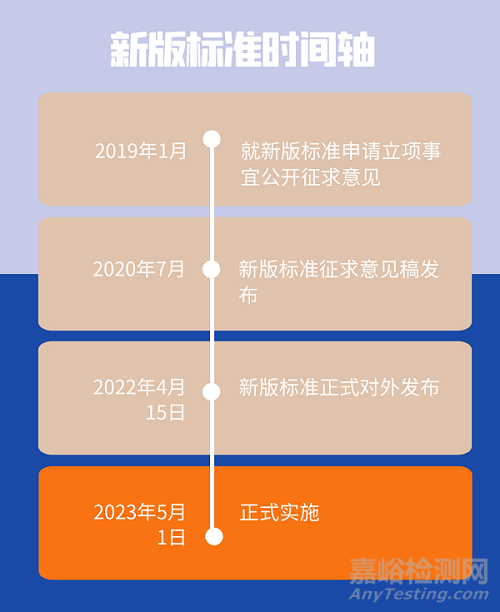
为进一步做好医疗器械国家标准立项工作,根据《医疗器械标准制修订工作管理规范》的要求,于2019年1月就新版标准申请立项事宜公开征求意见。随即由山东省医疗器械和药品包装检验研究院及国家药品监督管理局医疗器械技术审评中心作为主要起草单位进行新版标准制定工作。2020年7月,新版标准进入征求意见阶段。经过周密审核后,新版标准在今年4月15日正式发布,并计划于2023年5月1日实施。
技术要点更新
参照GB/T 16886.1-2022《医疗器械生物学评价 第1部分:风险管理过程中的评价与试验》前言,本文件与GB/T 16886.1-2011相比,主要技术变化如下:
a)增加了进行生物学危险(源)评估的适用和不适用范围(见第1章);
b)增加了GB/T 16886中使用的部分术语和定义(见第3章);
c)增加了纳米材料(见3.15、4.3、6.1、6.3.2、6.3.2.13、6.3.2.14、6.3.2.15、B.3.1.2、B.4.1.4)和可吸收材料评价信息(见B.4.3.3、B.4.4.2);
d)增加了医疗器械的生物学评价程序[见4.1a)];
e)增加了医疗器械总体生物学评价的内容[见4.3c)];
f)增加了“医疗器械全生命周期”和“可重复使用的医疗器械”的生物学安全评价要求(见4.7、4.8);
g)更改了“作为风险管理组成部分的医疗器械生物学评价的系统方法框图”(见图1,2011年版的 图1);
h)增加了当本文件版本更新时,对已上市医疗器械进行生物学风险评价的要求(见4.11);
i)增加了“非接触医疗器械”的评价信息(见5.2.1)和“瞬时接触医疗器械”的评价信息(见5.3.2);
j)更改了与组织、骨或牙髓/牙本质系统接触医疗器械的描述[见5.2.3b),2011年版的5.2.2 b)];
k)增加了“差距分析和生物学评估终点的选择”(见6.2);
l)增加了选择生物学试验应考虑的程序[见6.3.1列项b)中5)];
m)增加了进行急性全身毒性试验或风险评定的要求(见6.3.2.6);
n)增加了使用动物试验进行生物学终点研究的原则(见6.3.2.9);
o)更改了考虑生物降解试验的情况(见6.3.2.13,2011年版的6.2.2.13);
p)更改了考虑毒代动力学研究的情况(见6.3.2.14,2011年版的6.2.2.14)。
新版标准详情


来源:微谱医疗器械技术服务


