您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-11-17 21:35
1 手性杂质研究目标和风险分析
手性杂质作为有机杂质的一种,其质控的基本思路与有机杂质相似,在进行研究时,首先应该进行杂质溯源的分析,确定各手性异构体的风险程度,并制定相应的控制策略。
依据来源手性杂质可分为工艺杂质和降解杂质。其中工艺杂质包括从原料药制备过程中引入的手性原料、手性拆分剂、反应副产物等; 降解杂质主要指原料药不稳定在存放过程中因构型发生翻转而形成的立体异构体。不同来源的杂质,通常需要在药品生产的不同阶段进行控制。
手性中心的个数也是需要考虑的问题,对于仅含一个手性中心的药物,一般需要在生产过程和终产品中监控对映异构体杂质的含量; 而对于含多个手性中心的药物,在终产品中控制多个手性杂质通常存在困难,因此通常分阶段进行控制,还应考虑到非对映异构体杂质产生的概率比对映异构体更大,除监测对映异构体外,还应研究和监控非对映异构体。
替格瑞洛主要由五元环、硫醚嘧啶和三元环3个主要片段组成。目前文献报道了该品种的多种合成路线,共同点是合成过程中均无手性中心的构建,6 个手性中心全部由起始物料引入。本文以原研企业阿斯利有限公司在2001 年5 月公开的替格瑞洛的改进工艺为例( 见图2) ,来探讨手性杂质的引入方式及控制策略。
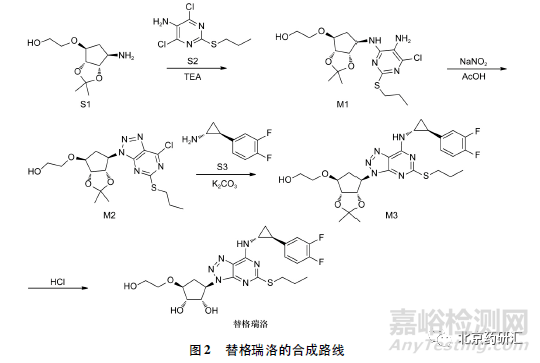
该合成路线先以起始物料S1 和S2 进行偶联,然后在亚硝酸钠和乙酸条件下重氮化关环,再与起始物料S3 偶联,最后脱去叉酮保护得到替格瑞洛成品。由上述合成路线可知,替格瑞洛的6 个手性中心由起始物料S1( 五元环部分) 引入4 个,由起始物料S3( 三元环部分) 引入2 个,在合成的过程中不涉及手性中心的构建,因此光学纯度的控制应该以源头( 起始物料) 控制为主,成品中手性杂质控制为必要的补充,同时关注合成过程和稳定性存放中是否存在构型转化的风险。
1.1 起始物料S1 的立体异构体的引入
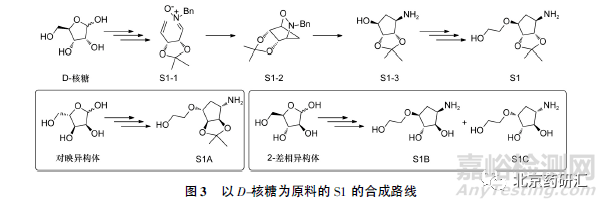
1.1.1 以D-核糖为合成原料的S1 合成路线
图3显示了以D-核糖为合成原料的S1 合成路线。D-核糖经过多步官能团转换合成[3 + 2]偶极环加成反应前体S1-1。随后以DMF 为溶剂, 130 ℃加热条件下得到环化产物S1-2。钯碳氢化条件下断裂碳氧键的同时脱除苄基保护得到化合物S1-3。随后通过3 步反应引入羟乙基侧链,得到起始原料S1。基于合成方法的差异,D-核糖中可能带有如L-核糖( 对映异构体) 、D-阿拉伯糖( 2-差相异构体) 等异构体杂质,这些杂质可能参与后续反应形成S1 异构体杂质,进而衍生为成品异构体杂质。由于D-核糖异构体参与的反应立体选择性较为复杂,在成品中进行控制难度较大,因此在D-核糖中进行异构体的研究和控制是较为理想的选择。通常结合具体的D-核糖的生产工艺对可能存在的立体异构体进行分析,建立适宜的分析方法对多批D-核糖的异构体进行检测,根据检测结果及异构体传递情况拟定合理的杂质限度。
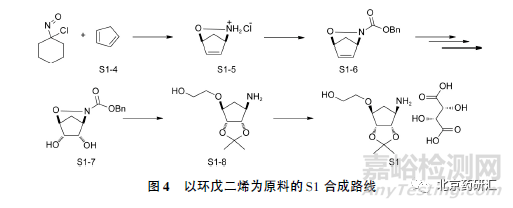
1. 1. 2 以环戊二烯烃为合成原料的S1 合成路线
图4 显示了以环戊二烯烃为合成原料的S1 合成路线[16]。环戊二烯与原位生成的亚硝基发生环化反应生成双环化合物S1-5,N 原子上引入苄氧羰基后进行立体选择性的双羟基化反应。由于立体位阻影响,生成的羟基与氮氧桥处于五元环的异侧。后续经过多步官能团转化,得到丙酮叉化合物S1-8。应该说明的是,从S1-5 至S1-8 均为外消旋化合物,且无非对映异构体产生。消旋化合物S1-8 经酒石酸进行拆分得到单一构型的S1。对于此种S1 合成路线,S1 中通常仅需考虑对映异构体杂质,可不对其非对映异构体进行研究。
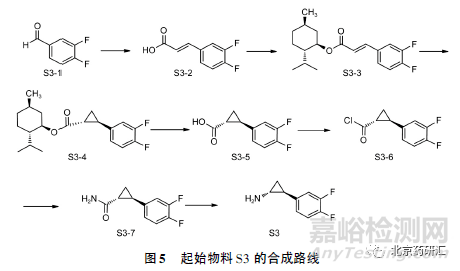
1.2 起始物料S3 的立体异构体的引入
起始物料S3 的合成路线见图5,起始物料二氟苯甲醛首先与丙二酸发生Knoevenagel 缩合得到中间体S3-2,然后与L-薄荷醇发生酯化反应进行顺反异构的选择主要得到反式酯化物S3-3,再发生Corey-Chaykovsky 环丙烷化反应得到高纯度的手性化合物起始物料S3。由于Corey-Chaykovsky 环丙烷化反应是反式共平面消除,加之手性辅基具有较大的空间位阻,理论上可以得到高纯度的起始物料S3,其中含有少量的对映异构体( 氨基与二氟苯基在三元环异侧) ,而非对映异构体( 氨基与二氟苯基在三元环同侧) 生产的可能性较小,见图6。
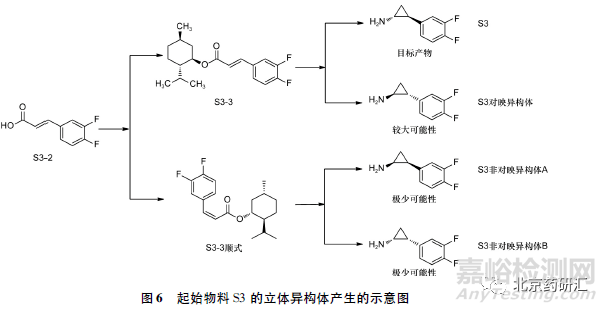
因起始物料结构中存在苄位手性碳,在光照下,苄位碳原子的构型可能发生翻转,产生非对映异构体A 和非对映异构体B,故仅在起始物料S3 质量标准中控制S3 对映异构体恐不足以保证最终产品的光学纯度,一般需在终产品进行补充研究和控制。
1.3 终产品中的立体异构体风险分析
根据起始物料S1( 五元环部分) 的手性中心构建机理分析,起始物料S1 如选择了以环戊二烯烃为合成原料或类似的路线,其中主要的手性杂质为对映异构体,非对映异构体产生的概率较小。另一引入手性中心的起始物料S3( 三元环部分) 不仅含有对映异构体,在物料存放及后续反应过程中遇光易构型转化产生另外2 个非对映异构体。
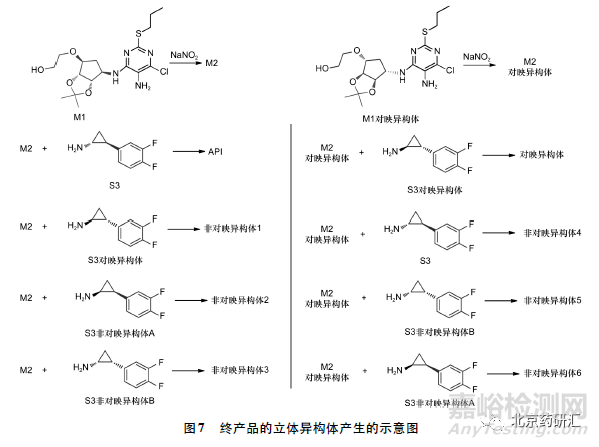
进一步结合产品的合成路线分析,终产品中产生风险较高的潜在的立体异构体杂质见图7,起始物料S1( 五元环部分) 及其对映异构体与起始物料S2 反应生产中间体M2 及其对映异构体,后续分别与起始物料S3( 三元环部分) 及其3 个异构体反应,共生成8 个异构体,其中1 个为目标产物,1个为对映异构体,6个为非对映异构体。
2 基于风险分析制定控制策略
在上述风险分析的基础上,可以进一步结合各片段的结构特点,分析检测方法建立的难度,制定具体的过程控制策略。
2.1 起始物料S1 的控制
基于起始物料S1 引入光学杂质的风险分析,以D-核糖为起始物料的合成路线中可能由D-核糖引入如L-核糖( 对映异构体) 、D-阿拉伯糖( 2-差相异构体) 等异构体杂质; 而以环戊二烯烃为合成原料的S1 合成路线仅需控制对映异构体杂质。考虑到起始物料S1 的环戊烷的构型稳定,在后续反应和稳定性存放过程中一般不会发生构型反转,在起始物料S1 中进行异构体控制是更为合理的选择。
通常而言,应该在起始物料S1 的内控标准中设定相应的手性杂质的检测方法和限度。但是,本品的特殊之处在于起始物料S1 及其异构体均无紫外吸收,需要先进行衍生化处理得到有紫外吸收的产物,再采用手性HPLC 法进行检测。因衍生化HPLC法的反应条件选择是否合适对检测准确度和灵敏度等影响较大,且操作繁琐,故在起始原料S1 中控制对映异构体的难度较大,方法学验证的要求高。因此,也可以考虑尝试另一种控制思路即在后续反应中( 如中间体M1 中) 控制该对映异构体的转化物。但这并不意味着起始物料S1 中完全不考虑纯度和手性杂质的问题,为确保投料准确,仍应尝试建立合理的GC 法测定起始物料S1 的纯度和其他非手性杂质含量,积累多批次数据,在此基础上拟定合理的比旋度限度,作为手性杂质的初步控制。
起始物料S1 及其对映异构体经下一步反应生成具有紫外吸收的中间体M1 及其对映异构体,且该步反应不涉及手性中心的构建及已有手性中心的变化,故可以在中间体M1 中采用经验证可行的手性HPLC 控制中间体M1 的对映异构体,并依据该杂质的转化、清除能力及多批中间体M1 的检测结果拟定合理的限度。
另外,上述控制方法的前提是不同批次间的起始物料的质量稳定且均一,否则也会给质量控制带入风险,因此起始物料供应商的控制也是必要的。目前多数供应商未将起始物料的生产纳入GMP 管理,为确保供应商能够按照约定的工艺在良好的生产与质量控制体系下生产出质量符合要求的起始原料,需要对供应商进行较详细、全面的质量审计,并要求供应商若进行合成路线、生产工艺的变更应及时通知,以便及时完成相应的质量研究和评价工作。
综上,基于手性杂质产生机理分析的基础上,结合起始物料的自身特点和后续反应的转化情况,采用分阶段、粗细结合的控制方法可准确、有效地控制起始物料S1 引入的手性杂质。
2.2 起始物料S3 的控制
前面已经讨论,起始物料S3 的构型可能产生翻转,但是,这并不代表不需要在起始物料中控制手性杂质。起始物料S3 具有环丙烷警示结构,且在倒数第2 步参与反应,自身残留及潜在杂质很容易带入成品中,而且基于源头和过程控制原则,应考察起始物料S3 的构型在生产过程及稳定性存放过程中受光照影响的具体情况,如光照强度、光照时间及构型转化率等,根据研究结果及手性杂质在后续反应中转化、消除能力拟定合理的限度,这种控制思路降低了成品光学纯度不合格的风险,比最终仅在成品控制异构体含量更科学、合理。
在建立方法时应注意起始物料S3 结构中有2个氟和1 个氨基,极性大,可考虑采用手性正相色谱法以实现异构体间良好的分离。起始物料S3 在光照条件下可能发生转化,应根据溶液稳定性研究结果,在质量标准中规定是否需要避光操作。
2.3 终产品中异构体的控制
由上述手性杂质产生的风险评估结果可知,本品可能存在7 个异构体,仅通过在终产品中建立分析方法控制多个异构体难度较大。本品的手性中心全部由起始物料引入,采用前面讨论过的源头控制,再结合生产过程和终产品的控制,才能达到全面、有效控制产品的光学纯度的目的。
若起始物料S1 引入的对映异构体已经在在起始物料S1 或中间体M1 中的到了充分的控制( 如控制0.15%以下) ,终产品中非对映异构体4 /5 /6 及对映异构体之和就不会增加,在终产品即使不控制非对映异构体4 /5 /6,质量风险也较小。基于杂质转化能力和工艺清除能力的研究结果,若能使终产品中各对映体含量均控制在合理限度内,也可适当放宽起始物料S1 中对映异构体的限度,但这种控制方法给终产品中异构体分析方法的建立增大了难度。
手性药物在一定条件下,已有的手性中心的构型也可能发生转化,故终产品的光学纯度的控制还需要考察后续反应和稳定性存放过程对已有的手性中心的构型转化的影响。三元环构型可能在光照条件下发生转化,故在起始物料S3( 三元环部分) 手性杂质控制的基础上,还需在终产品中控制三元环带入或转化产生的非对映异构体,即终产品中应该研究非对映异构体1 /2 /3,根据研究结果酌情订入质量标准。
手性杂质是贯穿产品整个生命周期的关键属性,工艺研究和放大过程中根据后续反应的机理和工艺条件,充分分析后续反应是否会影响已有手性中心的构型,如可能会产生影响时,应研究与优化工艺条件,尽量避免或减少构型变化的产生。稳定性考察过程中应注意采用立体专属性与准确度等验证均可行的分析方法监控各手性中心的构型稳定,还应关注考察条件应包括但不局限于现行稳定性研究指导原则规定的影响因素试验条件、各种可能的强制降解试验条件。根据手性杂质在各种环境因素的影响下,以及放置过程中是否稳定,从而确定是否需在质量标准中控制这些手性杂质。
2. 4 制剂的异构体控制
物态( 固态和液态) 、pH 值、光、热、空气等因素都可能使手性药物构型产生转化,除在手性原料药中应进行全面的构型稳定性研究外,手性药物制剂的异构体控制建立在原料药构型稳定性研究结果的基础之上,重点关注可能造成构型转化的影响因素。
根据前面的分析,替格瑞洛在光照条件下可降解产生非对映异构体,因此制剂中也需要关注相应的手性杂质问题。构型稳定性研究可在2 个阶段进行研究: ① 在处方筛选和工艺开发研究过程中增加异构体考察。② 在处方和工艺基本确定的阶段,在影响因素、强降解试验中进行构型稳定性研究,稳定性条件可根据手性药物的特点增加必要的特殊条件考察。在原料药手性杂质控制的基础上,根据制剂构型稳定性研究结果,酌情制订入手性制剂的质量标准。
3 结构确证研究
由于手性药物具有立体结构,其结构确定具有特殊性。同时,在非手性条件下,2个对映体一般具有相同理化性质( 熔点、溶解度) 、红外光谱、核磁共振谱和色谱保留行为,这也给结构确证带来一定的难度。手性药物结构确证的总体原则是确证各手性中心的绝对构型是R 还是S。构型的确证方法主要分为直接法与间接法两大类,如单晶X 射线衍射法就属于直接法,该方法能直接确证手性中心的构型,不需要其他的辅助方法。但是,并非所有的手性药物均适合采用直接法确证构型,如某些手性药物的单晶难以培养,或者仅靠分析待测物无法准确确证构型,这时就可采用间接法进行构型确证,如与其他异构体的检测数据进行对比分析。对于复杂的多手性中心药物,也可采用化学相关法佐证构型确证,即通过分析起始物料的构型、化学合成方法的立体选择性及中间体的构型控制等间接获得终产品的构型信息。其他常用的间接法还有比旋度、手性色谱、核磁共振以及旋光光谱、圆二色谱等。
上述手性药物结构确证的方法及原则同样适用于手性杂质对照品,同时还应该注意: 一般2 个对映异构体的核磁共振图谱中有重叠,图谱解析难度大,为准确确证构型,最好获得纯度较高的单一异构体进行构型确证研究; 对多手性中心异构体杂质进行构型确证难度较大,应注意在主成分构型确证研究基础上,善用间接法,对多种检测数据进行对比分析和详细的确证解析,以便准确确证构型,进而为后续方法学验证的准确性打下基础。
4 方法选择及验证
上述控制策略的实施,需要有效的分析方法的支持,因此,在生产过程各步骤建立合理的起始物料、中间体和终产品的分析方法,拟定合理的限度,也是控制的关键。
4.1 方法筛选
光学纯度分析方法的筛选同其他杂质分析方法的选择原则基本一致,应关注方法的专属性、灵敏度及准确性。通常而言,光学纯度分析方法除比旋度外,一般多采用手性分离色谱法,如HPLC、GC、毛细管电泳法( CE) 等。比旋度测定时影响因素较多,该法的灵敏度和准确度均不高,通常仅采用比旋度作为光学纯度的辅助质控指标。要准确、有效地控制产品的光学纯度,还要选择立体专属性更强、灵敏度更高的手性分离色谱法。目前随着手性色谱柱的商业化发展,更易获得,且该色谱系统稳定性、重现性和可操作性均良好,故在手性药物的研究中应用较多。同时,手性流动相法、手性试剂衍生化法也有一定的应用。
手性分析方法筛选时应关注以下问题:
① 首先应结合制备工艺过程,分析手性中心引入方式、化学反应的立体选性等确定要检测的立体异构体。理论上讲非对映异构体可以通过普通色谱法进行分离检测,只有对映异构体才需要选择立体专属性的手性色谱法。如替格瑞洛中非对映异构体1 /2 /3 可考虑在有关物质分析方法中控制。
② 结合对映异构体的自身结构特点,如极性大小、紫外吸收强弱、衍生化反应的活性基团( 如氨基、醇基) 等,综合考虑采用GC 法还是HPLC 法,手性固定相法、手性流动相法、手性试剂衍生化法等。如替格瑞洛的起始物料S1 无紫外吸收,可先进行柱前衍生化生产具有紫外吸收的对映异构体,然后再采用手性固定相法进行检测。
③ 手性试剂衍生化法需要供试品的化学转化和分离等预处理过程,有时可引起某一对映体组分的消旋化、损失或富集,且手性衍生化试剂的光学纯度及衍生化反应的条件、收率等都会影响分析结果的准确性,分析方法筛选时应进行关注。
4.2 方法学验证
多手性中心药物的光学纯度控制是源头、过程及终产品控制一系列相辅相成的控制方法的综合,其前提是各个阶段的分析方法都能满足准确性要求[19]。如果起始物料中异构体分析方法仅进行专属性、检测限和定量限验证,则无法保证方法的准确度,因此无论是起始物料、中间体,还是终产品的光学纯度分析方法均应参照分析方法验证的技术指导原则进行全面的验证,其中立体专属性是考察重点,除考察多个异构体间分离度,还应考察其他有关物质( 中间体、反应副产物等) 及强制降解产物( 酸、碱、光、热、氧化等) 对异构体检测的影响。如果可能,尽量使用单一的异构体对照品而非消旋体或者异构体混合物进行方法学验证,以确保检测方法的准确性。
5 结语
在《手性药物质量控制研究技术指导原则》的在《手性药物质量控制研究技术指导原则》的指导下,本文以替格瑞洛为例,讨论了多手性中心药物的手性杂质的控制思路。对于多手性中心的原料药,应在对制备工艺、反应机理及稳定性等充分研究的基础上,根据手性中心的个数、引入方式等不同,综合考虑采用过程控制和终产品控制相结合的控制策略,同时根据手性杂质的安全性、杂质研究指导原则等拟定合理的限度,有效地控制原料药的光学纯度。相应的制剂中,则根据制剂过程、贮运过程中手性药物构型稳定性研究结果,酌情增订鉴别或立体异构体的检查项目。

来源:Internet


