您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-11-16 16:51
基因治疗产品、细胞治疗产品和组织工程产品等先进疗法药物(ATMPs)有潜力为一些罕见病、恶性肿瘤、遗传性疾病等重大难治性疾病的治疗提供开创性解决方案,在一定程度上改变当今医疗卫生服务模式。本文从全球 ATMPs 的发展现状和趋势着眼,基于欧美经验浅析ATMPs 发展面临的挑战,以期为我国同类产业的监管和发展提供启示与借鉴。
现如今,大多数传统药物是为“一般患者”而设计,用药也是“一刀切”,对于某一特定病情,采用标准化的治疗方式。先进疗法药物(advanced therapy medicinal products,ATMPs)包括基因治疗产品、细胞治疗产品和组织工程产品,这些高度复杂的治疗产品无论是生产和给药途径,还是临床疗效均不同于传统药物。一些基因治疗产品可以解决疾病的病因,为患者提供一次性用药治愈的前景,也有一些细胞治疗产品和组织工程产品是专门为特定患者而生产的,形成个体化定制药物 [1]。2001 年,第一个细胞治疗产品——用于治疗膝关节软骨缺损的自体人软骨细胞(商品名:Chondron®)在韩国获批上市,次年韩国批准了第一个组织工程产品(商品名:Holoderm®),用于治疗大面积深度二、三级烧伤。2004 年,用于治疗头颈癌的重组人 p53 腺病毒注射液(商品名:今又生)在中国获得上市许可,是世界上第一个被批准上市的基因治疗产品 [2]。欧盟于 2009年批准了第一个 ATMP ChondroCelect®,一种用于治疗软骨缺损的组织工程产品。一年后,ATMP PROVENGE® 在美国上市,它是一种治疗激素难治性晚期前列腺癌的体细胞疗法 [3]。从 ATMPs理论概念的提出,到第一次临床试验的授权开展和新疗法的获批上市,这中间的时间跨度之大与ATMPs 的特殊性、复杂性和新颖性有关,这些性质也影响患者获得治疗的机会。为促进创新、提高 ATMPs 的可及性,美国食品药品监督管理局(U.S. Food and Drug Administration,FDA)和欧洲药品管理局(The European Medicines Agency,EMA)分别于 1991 年、1999 年开始对 ATMPs 实施科学监管,从法律、法规到行业指南三个层级实现系统管理,涵盖研发阶段 ATMPs 的分类程序和科学建议、临床前研究和临床试验的指导、激励政策、注册阶段的上市许可程序以及上市后的生产要求、真实世界数据(real-world evidence,RWE)收集和药物警戒。
1 ATMPs 的概述
1.1 ATMP 的分类(见表 1)
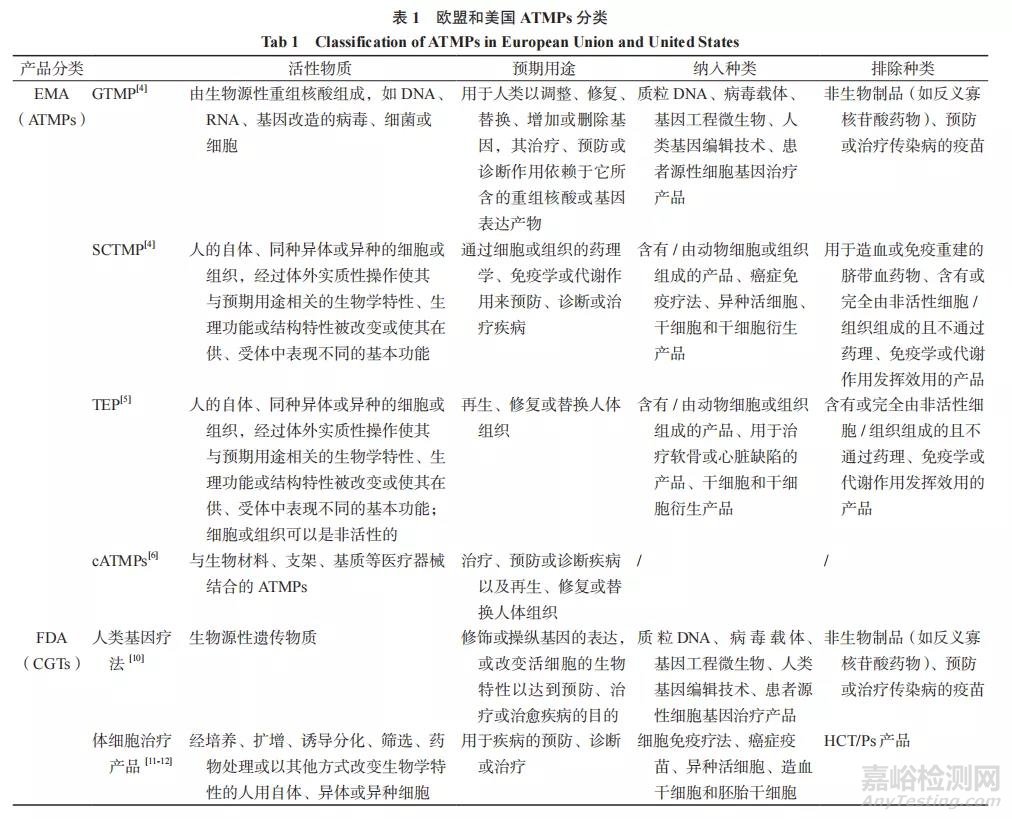
欧盟的人用医药产品主要受指令 Directive 2001/83/EC 和法令 Regulation(EC)No 726/2004的约束,在此基础上 EMA 针对 ATMPs 颁布了专门的法令 Regulation(EC)No 1394/2007,于 2008年 12 月 30 日生效,该法令建立了对此类产品进行监管和上市许可程序的总体框架,并成立负责评估 ATMPs 的质量、有效性和安全性的先进疗法委员会(CAT)。其后 EMA 又出台指令 Directive 2009/120/EC 进一步更新先进疗法的定义和详细的科学技术要求 [3-5]。Regulation(EC)No 1394/2007 将 ATMP 分为三类:① 基因治疗产品(gene therapy medicinal product,GTMP);② 体细胞治疗产品(somatic cell therapy medicinal product,SCTMP);③ 组织工程产品(tissue-engineered product,TEP)。此 外,ATMPs 可 与 生 物 材 料、支架、基质等医疗器械结合形成组合的 ATMPs(Combined ATMPs,cATMPs)[6]。EMA 强调出于安全的考虑,可能属于 GTMP、SCTMP 及 TEP定义范围内的产品应被视为 GTMP,同时符合SCTMP 和 TEP 定义的产品优先被视为 TEP[7]。
与欧盟一样,美国也将 ATMPs 视为生物制品,由 FDA 的生物制品评价与研究中心(Center for Biologics Evaluation and Research,CBER)负责审评和监管。FDA 主要依据法律《美国食品药品和化妆品法案》和《公共卫生服务法案》第 351部分以及法规《美国联邦法规集》第 21 部分的600 ~ 680 号(针对生物制品的规定)和 1271 号(《人体细胞和组织产品的管理规定》)对这些药物进行监管 [3,8]。“ATMP”这一术语在美国的法律法规监管文件中并不常用,FDA 将这些产品统称为“细胞和基因疗法”(cellular & gene therapy products,CGTs)。应该明确的是,CGTs 不应与“人体细胞、组织以及基于细胞和组织的产品”(human cells,tissues,and cellular and tissuebased products,HCT/Ps) 混 淆,HCT/Ps 被定义为“旨在用于植入、移植、输注或转移至患者的人体细胞或组织”,FDA 仅根据 PHSA 第 361 部分和 21 CFR 1270 & 1271 号对 HCT/Ps 进行管理,由此可见,HCT/Ps 不属于药品或生物制品的范畴 [3,9]。CGTs 包括两个子分类:① 人类基因疗法(human gene therapy);② 体细胞治疗产品(somatic cell therapy products,SCT)。
欧盟和美国在 ATMPs 的定义、分类方面的异同见表 1。对于 GTMP,欧盟和美国的纳入标准相似,产品要求是由包含重组核酸 / 遗传物质的活性成分组成的生物制品,且重组核酸 / 遗传物质须是生物源性,由化学合成的重组核酸 / 遗传物质组成的产品将被作为化学药进行管理,如反义寡核苷酸药物。其次 FDA 和 EMA 均明确将旨在治疗或预防传染病的基于基因的产品排除,如疫苗。对于基于组织和细胞的 ATMPs,欧盟和美国的产品分类存在明显差异。一方面,欧盟认为 SCTMP 和 TEP两者在产品的预期用途有所区别,而在美国基于细胞和组织的 ATMPs 没有细分类别,均属于 SCT。如在欧美均获批上市的 MACI®,是由接种在猪的胶原蛋白膜上的自体软骨细胞组成,用于成年患者膝盖症状性全层缺损修复 [3]。在美国,MACI® 被认为是一种基于治疗目的的生物制品 - 医疗器械组合的细胞治疗产品。另一方面,在美国,用于造血或免疫重建的骨髓祖细胞或外周血细胞被认为是 SCT,FDA 已批准了多种脐带血药物上市;而EMA 认为,当这些细胞用于造血或免疫重建时,其没有受到实质性操作且在供、受体中表现的是相同的细胞基本功能,因此不被视为 ATMPs,只有当它们用于治疗心肌梗死或其他血管疾病则可归类为 ATMPs[7,13]。
1.2 ATMP 的特点
ATMPs 具有区别于传统药物的独特属性 [1]:
① 治愈潜力:ATMP 的设计更多针对的是疾病的生物学机制,而非症状,这意味着这些创新性疗法可能为难治性疾病患者提供“治愈性”解决方法,有效改善患者的生活质量并延长寿命。
② 一次性治疗:ATMP 通常只使用一次,即“一针给药,终身受益”,因此,不会出现慢性病患者在服用传统药物时面临的依从性挑战,同时可以显著减轻慢性病患者对常规治疗和日常护理的需求,从而节省卫生系统的长期成本。
③ 高额的前期费用:由于 ATMPs 的研发难度大、生产成本高、目标人群小等特点导致其药价高昂,而这些变革性疗法通常要求一次性预付费用,这可能带来支付方面的挑战。
④ 复杂的生产过程:ATMP 是复杂的产品,需要高度专业化的生产设备、生产工艺和技术要求。例如,基于病毒载体的基因疗法,不同的病毒在不同的环境下表现各异,往往需要高度一致的反应条件和生产过程,才能保证放大和纯化后得到的产品符合质量控制标准。确保起始物料、生产工艺、生产设备等的一致性和稳定性是ATMPs 生产商共同面临的挑战。
⑤ 储存和运输 [14]:一些 ATMPs 是活细胞,有效期很短,需要制订确保产品稳定性和质量可控性的储存条件,这也在一定程度上导致其运输困难。
2 全球先进疗法药物的发展现状和趋势
2.1 临床试验开展情况
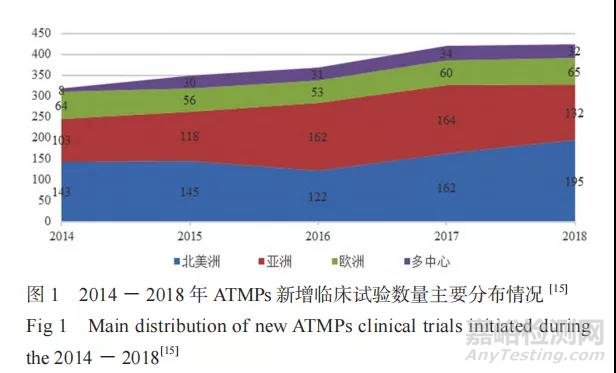
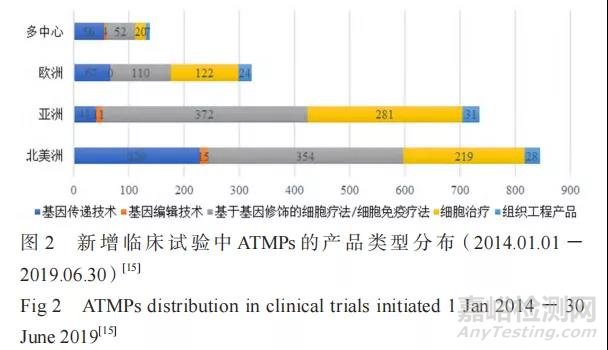
据 统 计 显 示,2014 年 1 月 至 2019 年 6 月,全球范围内共新增 2097 项 ATMPs 临床试验,主要分布在北美洲(845 项)和亚洲(736 项),其次是欧洲(323 项)、南美洲(26 项)、大洋洲(17 项)和非洲(11 项),还有 139 项跨国家、多中心的临床试验。与 2014 年相比,2018 年 ATMPs 的临床试验数量总体上涨 32%,北美洲(上涨 36%)和亚洲(上涨 28%)增长明显,而欧洲(< 2%)相对稳定(见图 1)。约 63% 的临床试验处于Ⅱ / Ⅲ期阶段 [15]。在产品类型上,GTMP[ 包括利用基因传递技术、基因编辑技术和基于基因修饰的嵌合抗原受体 T 细胞(CAR-T)疗法等 ] 占新增临床试验的 63%,其次是 SCTMP(占 32%)[15](见图 2)。自 2013 年以来,CAR-T 疗法临床试验数量在全球范围内呈爆发式增加,中国(119 项)于 2017 年超过美国(112 项)成为注册 CAR-T疗法临床试验最多的国家。截至 2020 年 6 月 30日,在“clinicaltrials. gov”上登记的 CAR-T 临床试验数量已超过 600 项,中国和美国分别登记357 项和 256 项 [16]。在疾病类型上,正在研发的ATMPs 中有 50% 以上针对肿瘤学开展,包括白血病、淋巴瘤、脑癌等,其次是心血管疾病,此外还包括许多罕见病,涉及肌肉骨骼、中枢神经系统、内分泌、皮肤病等各方面 [17]。
2.2 临床应用研究进展
ATMPs 经历了十几年的螺旋式发展,至今在多种遗传性和获得性疾病中取得了令人兴奋的研究成果,已有多个 GTMP 被批准上市用于治疗脂蛋白脂肪酶缺乏症(LPLD)(Glybera®)、腺苷脱氨酶缺乏型重度联合免疫缺陷病(ADA-SCID) (Strimvelis®)、RPE65 型遗传性视网膜营养不良(Luxturna®)、非β0/β0 基因型输血依赖性β-地中海贫血(TDT)(Zynteglo®)、脊髓性肌萎缩症(SMA)(Zolgensma®)等罕见病 [18]。实际上,ATMPs 也有望用于治疗患者人群规模较大的疾病。基因编辑技术是基因治疗的一种形式,通过对多能干细胞衍生的细胞进行改造,为患者带来独特的治疗益处,从而解决一些难治疗的慢性疾病,如糖尿病。2018 年,ViaCyte 公司与基因编辑上市公司 CRISPR Therapeutics 达成协议合作开发能够有效治愈 1 型糖尿病的干细胞衍生胰岛素替代疗法。ViaCyte 开创了一款由人胚胎干细胞(hESCs)定向分化为胰腺内胚层细胞的疗法PEC-Encap(Vc-01),该疗法使用 Encaptra® 免疫保护装置进行包装,通过皮下植入患者体内,一旦植入成功,这些细胞就会成熟发展为能分泌胰岛素的β 细胞和其他正常的胰岛细胞来调节血糖水平,同时 Encaptra® 装置通过使用半透性保护膜包围 PEC-01 细胞来防止免疫排斥,消除了其他移植治疗方法的免疫抑制,此疗法有可能为 1 型糖尿病患者提供功能性治愈方法 [19]。目前 PECEncap(Vc-01)已进入临床研究,在美国、加拿大和欧洲的不同中心进行临床试验以评估安全性和有效性。
另一方面,SCTMP 将在慢性疼痛的治疗中扮演越来越重要的角色。美国 DiscGenics 开发了一种名为 IDCT 的新型、同种异体、可注射的细胞疗法,利用椎间盘组织中提取的椎间盘细胞,为治疗轻度至中度退行性椎间盘疾病提供一种非手术的、潜在组织再生的解决方案。该产品已获得FDA 的快速通道资格认定,目前在美国和日本进行多中心临床试验以评估其减少与退行性椎间盘疾病相关的疼痛和残疾的药效 [20-21]。
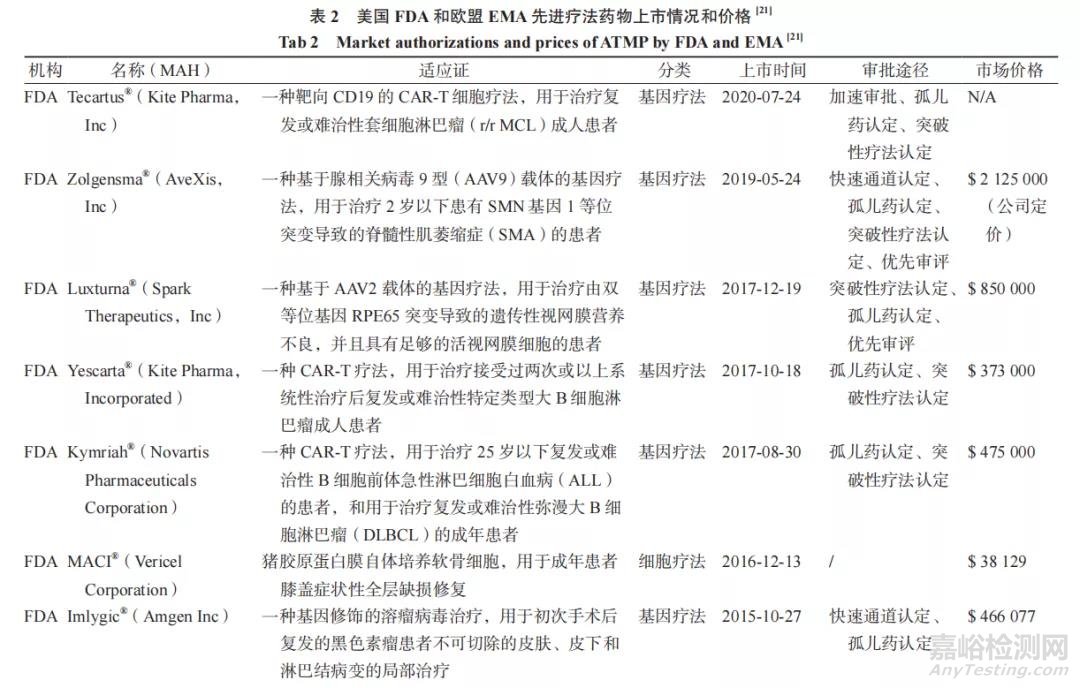
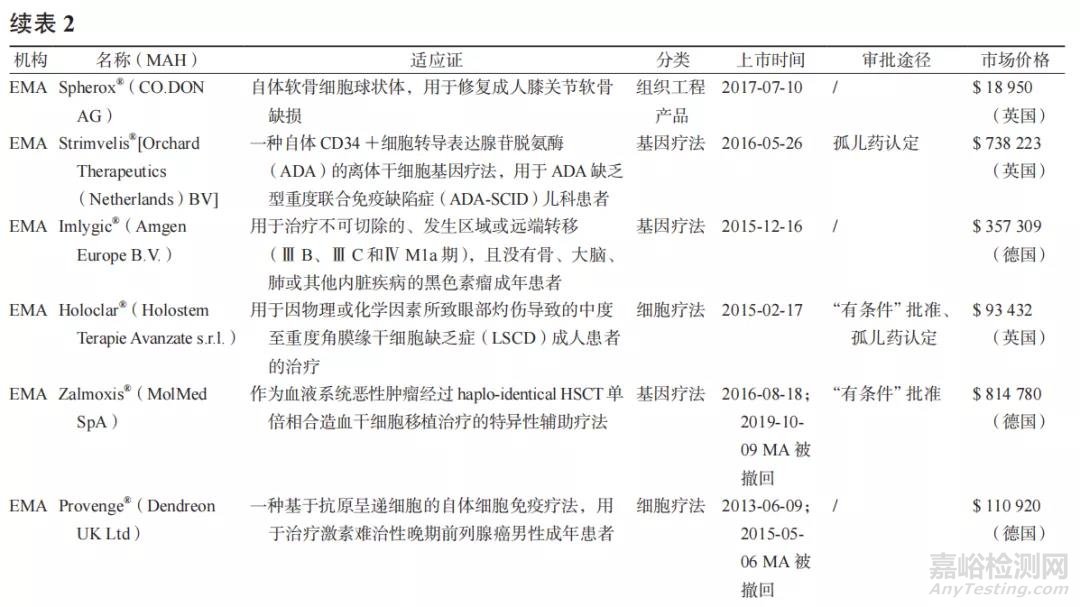
2.3 上市药物市场动态(见表 2)
在基因组学、精确的基因编辑工具以及分子和细胞生物学的快速发展推动下,学术界、非营利性组织、生物技术和制药行业等相关利益者对ATMPs 的研究更加深入,越来越多的 ATMPs 被批准上市。截至 2020 年 12 月 31 日,FDA 已批准 18个 ATMPs,包括 6 个基因治疗产品和 12 个 SCT(其中有 8 个是脐带血药物);EMA 已批准 16 个ATMPs,其中有 10 个 GTMP,3 个 SCTMP 和 3 个TEP;同时在美国和欧盟两个地区上市的 ATMPs有 7 个。另外也有一些候选产品已向 FDA/EMA提交上市许可(MA)申请,如有望成为全球首个治疗血友病的基因疗法 ValRox(BioMarin)、治疗一种罕见的中枢神经系统疾病芳香族 L- 氨基酸脱羧酶缺乏症(AADC)的基因疗法 GT-AADC(PTC Tx)、治疗儿童类固醇难治性急性移植物抗宿主病(SR-aGVHD)同种异体细胞疗法 Ryoncil(Mesoblast)、治疗小儿先天性无胸腺引起的原发性免疫缺陷的组织工程产品 RVT-802(Enzyvant Tx)等 [17]。遗憾的是,由于 ATMPs 的定价高、报销难、市场需求低等复杂因素,有几个产品被迫退出欧洲市场。由于生产基地的关闭,MACI® 的MA 被暂停,直至 MA 到期后其药品上市许可持有人(MAH)未续签选择撤出市场 [22];EMA 批准的首个基因治疗产品 Glybera® 由于患者需求和成员国医保支付意愿不及预期,其 MAH 同样选择不续签 MA[23];Provenge® 由于其 MAH 破产而放弃欧洲市场 [24],后 ChondroCelect® 和 Zalmoxis® 的MAH 由于商业原因主动要求撤回 MA 并永久终止产品在欧盟地区的销售 [25-26]。



3 欧美先进疗法药物的挑战及应对
3.1 ATMPs 的支付与报销
实际上,药物的上市并不意味着患者可以立即获得相应的治疗方法。在欧美,药物经药品监管机构批准上市后,要基于卫生技术评估(health technology assessment,HTA)进行后续的药品定价和报销谈判 [27]。已上市的 ATMPs 药物定价在两万至两百万美元不等,GTMP 的价格明显高于SCTMP 和 TEP。如此高昂的价格无疑会影响患者获得创新疗法的机会,也会对医疗财政系统造成重大影响。支付创新疗法的费用需要从医疗保障预算中分配资源,因此可能会对一些现有的治疗方法,特别是效率和成本效益较低的药物 / 技术进行更严格的预算限制,这意味着 ATMPs 将推动医疗资源的重新分配,也可能会对医疗保障体系的可负担性和可持续性造成负面影响 [28]。虽然这些并不是评估一种新药价值的关键要素,但却是一些国家制定药品准入政策的重要标准。由于 ATMPs 技术的特殊性,如自体细胞治疗、伦理道德、复杂给药过程以及疾病的罕见性等因素,使用金标准“随机对照试验”(randomized controlled trial,RCT)评估药物的疗效和安全性的适用性不强,因此产品可能基于有限的安全性和有效性数据而获得上市批准,这导致一些以临床证据为导向的 HTA 机构和医保支付方不愿意根据上市前的短期研究数据来提供相应 ATMPs,因而患者无法及时获得新的治疗方法,Glybera® 和ChondoCelect® 正是由于临床疗效数据不足,在法国被拒绝报销 [1]。
针对部分已上市的 ATMPs,欧洲一些国家已制定相应的报销策略。在英格兰,Imlygic® 通过患者用药可及性方案(Patient Access Scheme,PAS)获得报销 [29-30],在 PAS 中,制药公司根据使用该药物的患者数量、患者对药物的临床反应或收集的新证据(结果)提供折扣、返款等形式 [31]。Strimvelis® 根据国家卫生与临床优化研究所的高 度 专 业 化 技 术(highly specialized technology,HST)评估,认为其成本效益是合理的,因此被推荐进入国民健康保障体系进行报销。此外,两个 CAR-T 产品 Yescarta® 和 Kymriah® 可以通过癌症药物基金获得资助治疗,这种机制下的报销是临时性的,并以收集进一步的真实世界证据为依据来支撑未来药价的重新谈判 [29-30]。在德国,新药上市后的头 12 个月内企业可以自主定价,在这期间,德国联邦联合委员会会进行疗效评估并推荐报销办法以供国家法定健康保险基金协会的后续价格谈判参考,该协会旗下有上百个健康保险公司。2019 年 3 月,诺华与德国法定健康保险联盟 GWQ ServicePlus 签订了基于疗效的支付协议,根据该协议,如果患者生存率无法达到约定的界限,诺华将向保险公司偿还部分 Kymriah@的药费 [1]。还有基于疗效的分期付款方式,对于Zynteglo®,Bluebird 提供了一项为期 5 年、以结果为导向的分期付款计划。
3.2 临床试验的设计和开展
在欧盟,ATMPs 申请 MA 失败的主要因素是临床疗效证据不足以及安全性问题,其次是质量或非临床研究的问题 [32]。针对目前无治疗方法的疾病或罕见病而开发的 ATMPs,通常是基于短期临床数据而被批准的,这些数据来源于单臂、开放标签、观察性研究,随访时间短,患者人数少,关键性临床试验方法学应用的局限性是导致 ATMPs 长期疗效和安全的不确定性的主要原因 [30]。寻找直接反映患者感觉、功能或生存的特性或变化的临床终点指标 [33] 来评估疗效也是ATMPs 临床试验设计的一个重要障碍。评价基因治疗产品的有效性有时依赖于替代终点而非临床终点或临床结果,例如针对肿瘤,使用无进展生存期的数据作为替代终点,而不是将总体生存期的数据作为临床终点,因为这样可以实施较短的试验并有助于加快上市许可的监管评估。然而选择替代终点需要谨慎,一方面是经过验证的替代终点较少,当使用新的替代终点时,需要使用有限的数据和时间来开发和验证这些终点,另一方面是存在相当大的不确定性,因为替代终点可能无法准确体现某种治疗的综合收益风险曲线,不能真正地预测疾病转归以及定量地反映该治疗真正的临床获益。与此同时,患者诊断、招募、以及持续的医学随访,也是阻碍 ATMPs 临床试验顺利开展的重要因素 [34]。
对于 ATMPs 这一复杂的产品的评估,无论是药品监管部门还是 HTA 机构,都需要在临床证据要求方面表现出更大的灵活性。产品的开发研究者需加强替代终点的使用和验证,如应用生物标志物、患者报告结局或观察性试验结局作为试验完成的终点 [35],以尽早发现和临床相关的显著治疗效果,对于无法进行对照试验的适应证,应增加间接比较试验以增强说服力。针对人数较少的小样本临床试验的设计与研究,EMA 和FDA 均有出台指导原则 [36-37]。HTA 机构在进行技术评估时应做出一定让步,如美国临床与经济评估研究所认为对于超罕见病治疗可考虑采用历史对照的方法评估其药效 [38]。真实世界证据的发展有助于解决长期疗效、安全性、健康相关生活质量和医疗资源使用方面的不确定性,因此也需要结合真实世界人群的数据进行综合评估。
3.3 立法与监管障碍
首先,ATMPs 的定义和范围缺乏监管上的统一。在欧盟,虽然法令 Regulation(EC)No 1394/2007 明确了 ATMP 的定义,但每个成员国可能会对同一产品进行不同的分类,这不利于产品在欧盟市场的流通 [39]。其次,由于缺乏对 MA程序的监管统一,不同地域的 ATMP 上市数量不同。FDA 已批准 18 个 ATMPs,而 EMA 已批准16 个 ATMPs,这导致由于地理区域的不同使患者获得治疗的水平不一 [40]。此外,与药品监管机构之间缺乏互动或沟通有限也可能降低 ATMPs获得 MA 的机会 [39]。
为了促进患者尽早获得 ATMPs,EMA 已制定一些监管策略,以支持新 ATMPs 的早期开发。CAT的其中一个职责就是为 ATMPs 的分类提供建议,尤其是当产品可能属于两个不同类别时 [41]。申报者还可通过科学建议或协议援助寻求药物开发早期试验设计和研究的帮助 [42]。与此同时,EMA 制 定 了 优 先 药 物 制 度(PRIority Medicines scheme,PRIME),以促进有关药物疗效和安全性的可靠数据的生成,并加快对药品上市的评估,受益于 PRIME 的申报者可以在申请 MA 时获得加速审评的资格 [43],还有其他加快新药审评审批的途径,如“有条件批准”“特例批准”[44]。同样地,FDA 也鼓励新药研发者在药物开发早期增加与评审中心的互动,CBER 推出了 INTERACT 会议计划 [45],旨在为因使用复杂制造技术、创新设备或先进测试方法而产生未知安全性问题的新型产品提供药物开发的化学、生产和控制、药理毒理学或临床研究方面的早期、不具约束力的建议,通过提供专家建议的流程,有助于申报者应对科学和监管方面的挑战,加快产品开发。FDA 目前已建立“优先审评”“快速通道”“突破性疗法认定”以及“加速审批”4 个快速审评审批途径,对药物从开发到上市的不同阶段给予支持,此外还为治疗罕见病的“孤儿药”研发开辟特别通道,获得孤儿药认定身份的药物将享有税费减免、研究资助、协议辅助、快速审评以及上市后 7 年的市场独占权 [46]。此外,EMA 与 FDA 已意识到各自在积极支持 ATMPs 的研发中面临着类似的监管挑战,双方已达成共识,尽早提供平行的科学咨询意见,并进一步加强现有的 ATMPs 团队合作,以期就这些药物的监管制定共同的科学方法,最有效地促进其临床前和临床开发以及上市后的数据收集 [47]。
3.4 ATMPs 的生产和操作实施
大多数的 ATMPs 的生产和质量控制过程是漫长而复杂的,GTMP 面临难以大规模生产临床级载体的困难,SCTMP 也存在特定细胞亚型的筛选问题,GMP 合规性在一定程度上增加了生产成本和复杂性 [39]。在运输和供应方面也存在薄弱环节,某些 ATMPs 的保质期较短,在急需治疗的情况下难以保证及时提供。一些 ATMPs 要求在特定的医院或研究中心进行管理,如 Strimvelis®仅在意大利一个研究中心进行给药,这意味着患者必须前往特定的临床环境接受治疗,这种方式所产生的额外时间和资源成本可能成为限制患者获得治疗机会的因素 [48],也对医疗保健专业人员素养以及用药前检查和用药后医疗监测这些方面的医疗基础设施提出更高的要求。此外,ATMPs需要有适当的、经监管机构批准和充分验证的配套诊断测试,而这一测试的可及性因不同国家、地区而异 [49]。
研究表明,实施个性化和精准医疗需要对卫生系统进行重大变革,包括采用信息技术处理数据,并为临床使用信息引入支持工具 [50]。其次,应从国家层面重视并解决 ATMPs 的研发、生产、成果转化面临的挑战。美国国国立卫生研究院(NIH)下属的国家转化科学促进中心(NCATS)牵头主持了针对罕见病基因疗法的技术平台构建的 PaVe-GT(The Platform Vector Gene Therapy)试点项目,关注基因疗法制药工艺中的共同问题如基因载体放大生产、剂量的选择、将转基因递送到正确组织的递药机制研究等,其目标是通过开发和测试多种罕见病基因疗法以提高临床试验启动的效率,并与公众共享科学结果、经验和监管文件为未来的基因治疗开发项目“铺路”[51]。
4 结语
ATMPs 有望为患者、社会和医疗系统带来巨大的临床价值。迄今为止,只有少数 ATMPs 获得了 FDA 和 EMA 的批准,还有更多的疗法正在进行临床前 / 临床开发,预计在未来将进入市场。目前欧美的监管政策和措施侧重于鼓励创新和加快对 ATMPs 的审批,而不是促进这些新疗法的可负担性和可及性。我国是世界上第一个完成GTMP 商业化的国家,也是 ATMPs 临床研究最活跃的地区之一,但总体上,国内患者的临床获益和产业发展状况与欧美仍有明显差距,一是由于我国 ATMPs 的监管体系建设滞后,尚未针对这类新型药物确定顶层框架并建立分级分类管理和技术评价体系,行政管理、注册审批、伦理审查的监管部门职责划分不清晰;二是临床研究的科学性和规范性不足,重复研究多,研发品种较为单一,如存在靶向 CD19、CAR-T 研究扎堆的现象,因此需要将研究方向更多地引导到 CD19以外的靶点和 CAR-T 疗法以外的先进疗法上,将 CRISPR 基因编辑和诱导多能干细胞等新技术整合到先进疗法开发中,可能会带来新的研究突破;三是在产品应用转化和产业化存在较大的瓶颈,至今未有新的产品上市。总而言之,ATMP的蓬勃发展需要持续的科学监管、创新的支付与报销机制、优质高效的医疗卫生服务体系和广泛的全球合作多管齐下。


来源:中南药学


