您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-05-25 08:56
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:17条资讯,阅读时长约:3分钟 」
今日头条
康希诺新冠疫苗获欧盟GMP认证。康希诺生物日前宣布获得匈牙利国家药品与营养研究院(OGYÉI)颁发的重组新冠病毒疫苗(5型腺病毒载体)(Ad5-nCoV,克威莎)欧盟GMP证书,成为国内首个创新疫苗技术路线在欧盟获得GMP认证的新冠疫苗生产企业。据悉,这款疫苗除了在国内获批附条件上市外,还先后在墨西哥、巴基斯坦、匈牙利、智利获得紧急使用授权,用于18岁及以上成人提供快速有效的免疫保护,预防新冠病毒的的感染。
国内药讯
1.康方生物PD-1单抗在美报BLA。康方生物与中国生物制药共同开发的派安普利单抗(AK105)已向FDA提交生物制品许可申请(BLA),用于三线治疗转移性鼻咽癌。AK105是一款具有差异化的潜在“best-in-class” PD-1创新单抗,此前已获FDA授予上述适应症的的突破性疗法认定、快速通道资格和孤儿药资格。该BLA将在实时肿瘤审评(RTOR)新政下进行审评。
2.江苏艾迪抗HIV新药在华报NDA。艾迪药业抗艾滋病1类新药ACC008片(复方ACC007片)的上市申请获CDE受理(CXHS2101016 )。艾迪药业在研的抗艾滋三联单片复方制剂ACC008是其在ACC007的基础上,联合2个核苷类逆转录酶抑制剂(拉米夫定和替诺福韦)开发的国产首款三合一单片复方创新药制剂。该项目曾于2019年12月被列入国家十三五「重大新药创制」科技重大专项。
3.上海亘喜双靶向CAR-T疗法I期临床积极。亘喜生物将在ASCO 2021年会上公布BCMA/CD19双靶向自体CAR-T细胞疗法治疗复发/难治性多发性骨髓瘤的I期临床最新数据。结果显示,早期客观缓解率(ORR)高达 94.7%(18/19);所有剂量组的数据均呈现出快速、深入、持久的治疗效果,其中最高剂量组全体患者(n=9)均取得微小残留病灶阴性-严格意义上的完全缓解(MRD- sCR);GC012F的安全性与此前观察结果一致。
4.亚盛药业Bcl-2抑制剂I期临床积极。亚盛药业宣布将在ASCO2021年会上公布Bcl-2抑制剂lisaftoclax(APG-2575)治疗复发/难治性(R/R)慢性淋巴细胞白血病/小淋巴细胞淋巴瘤 (CLL/SLL) 和其他血液恶性肿瘤患者的I期临床积极结果。在14例可评估的R/R CLL/SLL患者中有12例获得部分缓解(PR),ORR为85.7%,中位(范围)反应时间为3(2-7)个治疗周期。在APG-2575剂量低至20 mg/天时即可观察到淋巴细胞绝对计数(ALC)降低。APG-2575耐受性良好,不良事件可控。
5.四川百利EGFR/HER3双抗申报新临床。四川百利药业SI-B001双特异性抗体注射液的临床试验申请获CDE受理。SI-B001是四川百利药业子公司西雅图免疫(Systimmune)自主研发的一款EGFR/HER3特异性双抗,已于2019年11月获得CDE的Ⅰ期临床试验默示许可,拟用于局部晚期或转移性上皮肿瘤的治疗,包括食管鳞癌、肺鳞癌、三阴乳腺癌、头颈鳞癌、结直肠癌等。本次IND预计为相关适应症的进一步临床研究。
国际药讯
1.FDA加速批准杨森治疗NSCLC品种。杨森EGFR/MET双抗Rybrevant(amivantamab-vmjw)获FDA加速批准上市,用于治疗携带EGFR外显子20插入突变的非小细胞肺癌患者(NSCLC)。这是FDA批准用于这类患者的首款精准疗法。在中国,这款双抗已获CDE纳入突破性治疗品种,目前正在开展多项临床试验,其中包括与第三代EGFR酪氨酸激酶抑制剂lazertinib联用,一线治疗携带EGFR突变的局部晚期或转移性非小细胞肺癌。
2.欧盟推荐批准GSK/Vir的新冠中和抗体。葛兰素史克和Vir Biotechnology联合开发的COVID-19中和抗体sotrovimab获欧洲药品管理局(EMA)人用药品委员会(CHMP)推荐批准,用于治疗不需要补充氧气,但有发展为严重COVID-19潜在风险的成人和青少年患者。在一项在住院高风险成人中作为早期COVID-19单药治疗的Ⅲ期临床COMET-ICE中,与对照组相比,试验组患者因COVID-19进展导致住院或死亡的风险降低85%(p=0.002)。据悉,sotrovimab对多个受到关注的流行突变体仍保持活性。
3.强生公布新药Stelara的Ⅲ期数据。强生免疫学重磅药物Stelara在美国DDW会议上公布治疗克罗恩病(CD)头对头的Ⅲ期SEAVUE研究详细数据。与艾伯维Humira相比,Stelara治疗组52周时达到临床缓解的患者比例为64.9%,而Humira治疗组这一数值为61%,但差异没有统计学意义。SEAVUE研究中,Stelara的安全性更优,两组患者因副作用停止治疗的比例分别为6.3%和11.3%。
4.LAG-3组合疗法Ⅱ/Ⅲ期临床积极。百时美施贵宝(BMS)LAG-3抗体relatlimab联合PD-1抗体Opdivo(nivolumab)用于一线治疗转移性或不可切除的黑色素瘤的Ⅱ/Ⅲ期临床RELATIVITY-047达主要终点。与Opdivo相比,联合用药方案显著延长患者的无进展生存期,两组患者的中位PFS分别为10.12个月(95% CI: 6.37-15.74)和4.63个月(95% CI: 3.38-5.62)。详细结果将于ASCO2021年会上分享。据悉,这也是首个在转移性黑色素瘤中证明相对于PD-1抗体单药治疗具有统计学获益的治疗方案。
5.Opdivo+Yervoy治疗黑色素瘤长期疗效积极。百时美施贵宝将在ASCO2021年会上公布PD-1抑制剂Opdivo联合CTLA-4单抗Yervoy用于一线治疗晚期黑色素瘤的Ⅲ期临床CheckMate-067长期疗效数据。最少随访6.5年时,联合治疗组患者的中位OS为72.1个月(95%CI:38.2-NR),而Opdivo单药组以及Yervoy单药组的中位OS分别为36.9个月(95%CI:28.2-58.7)和19.9个月(95%CI:16.8-24.6);联合治疗组患者的6.5年疾病无进展生存率为34%(中位PFS为11.5个月),而Opdivo单药组以及Yervoy单药组这一数值分别为29%(中位PFS为6.9个月)和7%(中位PFS为2.9个月)。这是晚期黑色素瘤Ⅲ期临床报告中最长的OS数据。
6.诺华创新SHP2抑制剂早期临床积极。诺华“first in class”口服SHP2抑制剂TNO155将在ASCO2021年会上公布用于晚期实体瘤患者的剂量探索研究(CTNO155X2101)初步结果。经RECIST v1.1评估,有24例(20%)患者疾病稳定(SD),中位SD持续时间为4.9个月( 1.7–29.3);在接受TNO155(≥20mg/日)治疗的患者中,DUSP6表达下降25%患者比例为90%(38/42),下降≥50%的患者比例为60%(25/42);NO155具有良好的药代动力学特性,在靶向抑制剂量下也显示出潜在早期安全性和耐受性。
7.葛兰素史克出售Innoviva全部股票。葛兰素史克宣布将以每股12.25美元的价格向Innoviva出售全部Innoviva普通股,共3200万股,预期总收益将达到3.92亿美元。该公司计划调整“战略重点”业务,将业务重心转移到处方药、疫苗,以及非处方药上。Innoviva与GSK建立了长期的呼吸合作关系,GSK同意继续向该公司支付TRELEGY®ELLIPTA®等合作品种的特许权使用费。2021年第一季度,GSK获得特许使用权的产品带来的收入总额为8900万美元。
医药热点
1.北京给家庭医生更多转诊号源。北京市印发《关于做好基层医疗卫生机构预约转诊工作促进分级诊疗制度建设的通知》,赋予家庭医生等基层医务人员充足可调配的优质医疗卫生资源。通知要求,综合医联体内的核心医院和其他三级医院在医院常规放号前,应至少提前两周向区域内所有医联体内的基层医疗卫生机构预留30%以上的号源,其中专家号源应不低于50%。
2.广州本土确诊病例病毒属于印度变异株。广州市荔湾区新冠病毒肺炎疫情防控指挥部23日晚发布通报称,结合病例临床表现、流行病学调查、实验室检测和基因测序结果,经专家组综合评估,初步判断荔湾区锦龙社区郭某为境外输入关联确诊新冠肺炎病例,其病毒属于在印度出现的新冠病毒变异株,不排除是意外暴露造成偶发感染。
3.儿童青少年近视防控改革试验区名单公布。教育部近日发出《关于公布2020年全国儿童青少年近视防控试点县(市、区)和改革试验区遴选结果名单的通知》,认定并命名北京市西城区等58个地区为2020年全国儿童青少年近视防控试点县(市、区),天津市河北区等16个地区为2020年全国儿童青少年近视防控改革试验区,浙江省温州市为2020年全国儿童青少年视力健康管理先行示范区。
4.上海成立肛肠专委会。经两年筹备,上海市医师协会肛肠专委会日前在上海中医药大学附属龙华医院正式成立并召开首届年会,龙华医院肛肠科主任王琛当选为上海市医师协会肛肠专委会首届会长。据介绍,该专委会提倡个性化医学,精准医学及预测医学融合,提升临床诊治能力,由此整合沪上肛肠学科力量为患者谋福利。
审评动向
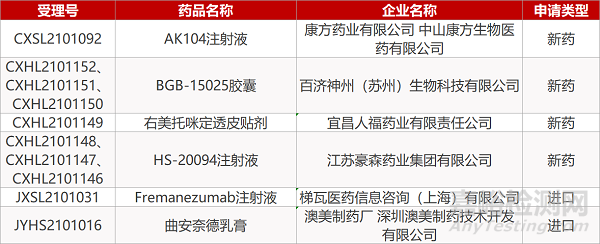
1. CDE新药受理情况(05月24日)
申请临床:
江苏豪森的HS-20094注射液(3个规格)、康方药业的AK104注射液、百济神州的BGB-15025胶囊(3个规格)、宜昌人福的右美托咪定透皮贴剂、梯瓦的Fremanezumab注射液。
申请生产:
澳美制药厂的曲安奈德乳膏。
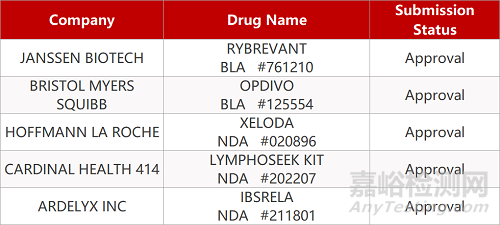
2. FDA新药获批情况(北美05月21日)

来源:药研发


