您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-03-08 23:53
人工血管移植物作为血管疾病的重要治疗方式而受到广泛关注,然而,小直径(<4 mm)的血管移植物存在血栓形成和内膜增生(IH)的高风险。本文总结了血管移植物中维持管腔长期通畅性面临的挑战,讨论了促血管祖细胞(EPC)以及内皮细胞(EC)的募集、粘附、增殖和激活方法,以及免疫调节策略,并对其研究前景进行了展望。
01、研究内容简介
血管疾病容易导致组织和器官缺血性坏死,甚至功能障碍和死亡。人工血管移植物作为重要治疗方式而受到广泛关注,然而,小直径(直径<4 mm)的血管移植物存在内皮化不足和血栓形成的高风险,这使得保持管腔的长期通畅十分困难。血管移植物在植入后数天,EC发生增殖,同时血细胞、血小板和纤维蛋白沉积在异物移植物周围;植入后数周,更多的EC在移植物表面增殖、黏附,但完整的内皮细胞层仍未形成,此时凝血级联反应可被激活,从而导致血栓形成;植入后数月,平滑肌细胞(SMC)从吻合部位向移植物表面迁移及病理性增殖,从而导致内膜增生(IH)。同时,炎症细胞,尤其是巨噬细胞,可以通过炎症因子调节EC和SMC的生物学行为(Figure 1)。
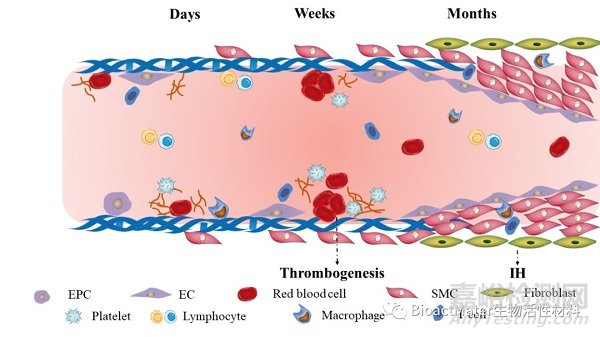
Figure 1. The challenges after vascular graft implantation. Days and weeks after implantation, insufficient endothelialization and thrombogenesis may happen. Months after implantation, uncontrollable proliferation of SMCs may lead to IH. Inflammatory cells play a role in regulating EC and SMC behavior.
内皮细胞(EC)形成内皮层,在抗凝和抗血栓形成中至关重要。因此,促进移植物表面的原位内皮化是当务之急,这要求EPC、EC的募集、粘附、增殖和活化;同时,可以采用多种策略以应对移植物血栓形成和IH的挑战(Figure 2)。为了促进原位内皮化形成,首先可通过趋化因子募集EPC至移植物表面,促进干细胞归巢,随后可利用表面改性捕获细胞,促进粘附;此外,还可以通过不同的支架形貌来调节细胞取向,以及通过生长因子和治疗基因来促进细胞的生物活性。为了减少血栓形成以及IH的发生,可以对移植物进行表面修饰、药物装载,用肝素或亲水性聚合物进行表面改性等来减少血栓形成,一些药物的释放亦可以抑制IH发生。
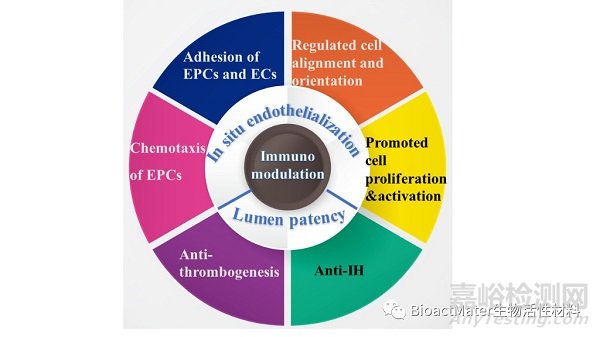
Figure 2. Schematic illustration for in situ endothelialization and lumen patency strategies.
促进移植物表面内皮化以及抗血栓及IH形成的主要策略,包括:
1. EPC和EC的归巢及粘附可促进原位内皮化
EPC是位于骨髓中的循环细胞,在外周血中少量存在,EPCs可分化为ECs。EPC已可用于细胞治疗,治疗严重的肢体缺血。大量研究表明EPC在血管移植物的内皮化中起关键作用。然而,募集至移植血管表面的EPC数量是有限的。因此,在原位内皮化中,EPC的归巢和EC的募集至关重要,这其中包括了对EPC和EC的趋化、捕获以及移植物表面促细胞粘附作用。多种趋化因子可用于EPC的趋化与募集,同时在促进细胞黏附中可采用纳米纤维结构,表面改性以增加生物活性结合位点以及特定分子修饰等策略(Figure 3)。
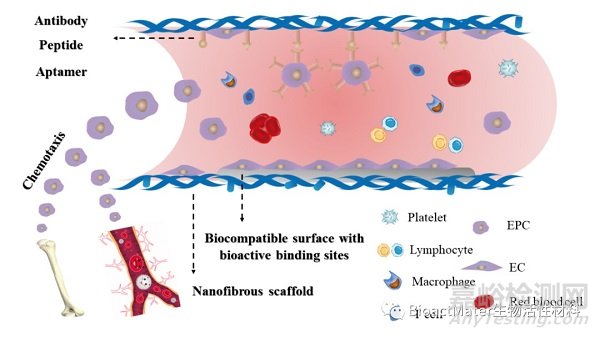
Figure 3. Recruitment and adhesion of EPCs and ECs. Chemokines can be utilized for EPC chemotaxis. Nanofibrous structure, biocompatible surface with bioactive binding sites and specific molecules modification can be applied for EPC and EC adhesion.
2. 调节细胞生物学行为以促进原位内皮化
理想的血管移植物还需要具有促进EPC和EC细胞活性的潜能。在成年人的正常生理条件下,干细胞处于静止状态,并在组织的生长和衰退中保持动态平衡。但是在病理条件或外部诱导下,可以激活分化,重新具备再生和更新的能力。因此,在募集循环的EPC后,受损的血管微环境可释放活性分子,并启动EPC向EC的定向分化。为了进一步增强EPC向EC的增殖和定向分化,以促进内皮化,可以采用材料结构调控,加入生物活性分子和治疗基因的策略来促进细胞活性。
多种分子具有刺激EC和EPC增殖,分化和激活的能力,其中包括生长因子,气体和microRNA等(Figure 4)。血管内皮生长因子(VEGF)在血管形成中至关重要,并且在调节EC行为中起关键作用。VEGF被负载并释放至缺损处,促进血管改建。microRNA能够通过与靶基因启动子区域结合而在调节血管形成中发挥作用。VEGF、FGF等蛋白递送可直接与靶细胞表面的受体结合,并通过信号传导途径调节血管生成相关基因的表达,但这其中存在蛋白质降解,失活以及逐渐消耗的风险。基因治疗可通过将基因转染至EC内,以促进内皮化,因为基因可被转染至细胞核中并翻译以得到相应蛋白,从而可能在体内维持较高的蛋白质浓度。VEGF、FGF和ZNF580等基因在血管移植中被广泛用于治疗性基因传递。
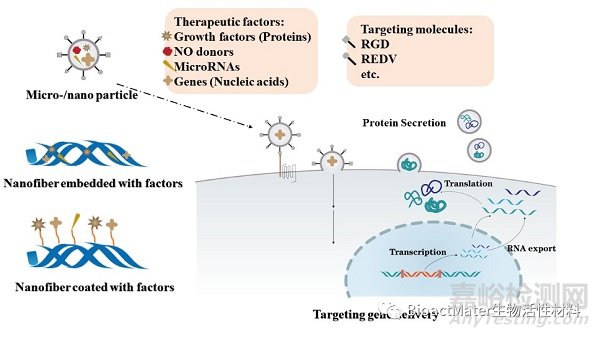
Figure 4. Bioactive molecules and therapeutic genes for enhanced in situ endothelialization. Strategies including micro/nano particle loading, nanofibers embedment or graft surface coating can be utilized to deliver therapeutic factors for promoted cell proliferation and activation. Furthermore, targeting molecules are used for more efficient gene delivery to targeted cells.
3. 维持长期管腔通畅
在血管植入后,血栓形成、IH和钙化可减小管腔直径,是威胁长期管腔通畅的主要潜在风险。预防血栓形成、IH和钙化对于血管移植物的存活十分重要。移植物表面缺乏EC,则易引起血栓形成,但是在早期愈合过程中,移植物表面还未聚集足够的EC以释放出用于血栓预防的生物分子。在植入初始,血管移植物作为异物,在体内容易导致血浆蛋白和血细胞的聚集,从而激活凝血级联反应。因此,减少蛋白质吸附的表面,如亲水表面和肝素涂层,一些药物或抗凝气体,如NO,是预防血栓形成的有效策略。
4. 血管移植后的免疫调节
移植物植入后引起的炎症反应影响着后续的血管改建与重塑。从免疫细胞释放的生物分子会影响EC和SMC的生物学行为,从而调节血管移植物的原位内皮化和管腔通畅性。巨噬细胞是先天性免疫系统中的关键细胞,可以由生物材料,药物或细胞外囊泡(sEV)诱导从M1向M2型极化,从而调节EC和SMC的生物学行为,以促进内皮化并抑制IH和钙化(Figure 5)。NK细胞在血管重塑中也起到一定的作用,丧失NK功能的BALB / c小鼠表现出的IH发生率明显降低,但尚无使用生物活性支架调节NK细胞功能的方法。此外,T细胞、B细胞和肥大细胞也发挥重要的免疫调节作用。
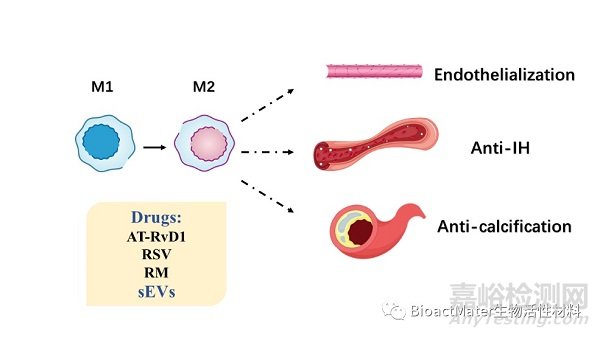
Figure 5. Macrophage performance in vascularization. Drugs or sEVs are utilized to promote the transition of M1 into M2 and regulate inflammation reactions for endothelialization enhancement, anti-IH and anti-calcification.
02、通讯作者简介
第一作者:庄瑜
上海交通大学医学院附属第九人民医院,口腔颅颌面科,2018级硕士研究生,研究方向为口腔颌面部组织发育及再生修复。
通讯作者:林开利研究员
上海交通大学医学院附属第九人民医院,博士生导师、科副主任、PI,入选中科院卢嘉锡青年人才奖、上海市优秀学科带头人培养计划、上海交通大学医学院双百人计划等。主要从事生物材料、3D打印与组织修复等基础和应用研究。历任RSC Advances, The Open Biomedical Engineering Journal副主编;Applied Sciences、无机材料学报、上海口腔医学、生物骨科材料与临床研究、骨科等杂志编委;担任国家医疗器械审评中心咨询专家、中国医药生物技术协会3D打印技术分会常委等20余个学会委员、副主任委员、常务委员、理事等。主持国家重点研发计划课题、国家自然科学基金(5项)、上海市科委项目(8项)、上海市卫健委重点项目等20余项。于Advanced Functional Materials, Biomaterials, Acta Biomaterialia, Bioactive Materials, Chemical Engineering Journal等专业期刊发表一作/通讯作者SCI论文90余篇(其中,封面10篇);授权10项发明专利;起草国家医疗器械行业标准3项。
通讯作者:于洪波教授
上海交通大学医学院附属第九人民医院,硕士生导师、主任医师。长期从事颌面部畸形与缺损的临床与基础研究。主持包括国家自然科学基金、教育部等在内的科研项目13项,发表论文66篇(其中,SCI论文35篇)。
03、资助信息
该研究得到了国家自然科学基金(82072396, 81871490, 81571022),上海市科委(17510710800),上海市优秀学科带头人(19XD1434500),上海市教委高峰高原双百人计划(20191819),以及上海交通大学医工交叉项目(YG2017MS06)的支持。
04、原文信息
Yu Zhuang#, Chenglong Zhang#, Mengjia Cheng#, Jinyang Huang, Qingcheng Liu, Guangyin Yuan, Kaili Lin*, Hongbo Yu*,
Challenges and strategies for in situ endothelialization and long-term lumen patency of vascular grafts.
Bioact Mater. 6(6), 1791-1809.
doi: https://doi.org/10.1016/j.bioactmat.2020.11.028.

来源:BioactMater生物活性材料


