您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2020-02-22 10:15
上一篇:
表面能的影响(纳米粒子)
当粒子尺寸接近纳米粒子的范围时,粒子的表面能量可能影响溶解度。根据Kelvin方程,由于表面能量对系统总吉布斯自由能的影响,较小的粒子比较大的粒子具有更高的溶解度。Kelvin方程将其量化为:
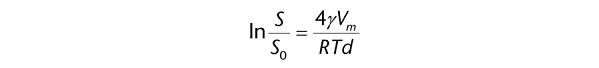
其中R是气体常数,T是温度,y是溶质的表面能(在溶质-溶剂界面),Vm是溶剂的分子体积,S0是一个无限大颗粒的溶解度,S是直径为d的粒子的表观溶解度。通常,这种对溶解度的影响只会对小于1微米的粒子产生影响。
小颗粒和大颗粒之间的溶解度差会导致所谓的Ostwald熟化。小颗粒溶解,导致在溶液中相对于大颗粒的溶解度过饱和,这导致在较大颗粒表面重结晶。较大的颗粒长大,而较小的颗粒溶解,导致悬浮颗粒的平均粒径增加(9)。
实验方法
平衡溶解度测定方法
饱和摇瓶法
摇瓶法是基于40年前开发的相溶解度技术,至今仍被大多数人认为是最可靠和最广泛使用的溶解度测定方法(10 - 15)。当需要测定平衡溶解度时,应使用摇瓶法。其他方法可以用来评价表观溶解度,但不适合评价真正的平衡溶解度。
选择溶解度测量的溶解介质应与其应用相关,并控制表面活性剂的类型和浓度、缓冲液的离子强度、以及在缓冲液中存在的反离子的类型。当结果旨在预测吸收或生物利用度时,建议使用一种生物相关的介质溶液(参见生物相关介质中的溶解度测定)。当结果旨在支持溶出方法开发时,建议使用溶出介质。出于研究目的,当该化合物的pH依赖性正在评估时,建议缓冲液在一个宽的pH范围内控制离子强度和反离子类型(例如,Britton–Robinson or Sörensen缓冲液)。
样品制备:待测物质通常是将过量固体加入到溶解介质中来制备的,这种溶解介质装在一个具塞瓶中。瓶中的介质的量不需要精确测量。建议将固体加到溶解介质中,大约1-2mg/ml,要超过估计的溶解度(对于低溶解度化合物,1-2mg/mL的浓度可能已足够)。固体的表面积可以在加入前通过研磨来增加(例如,用研钵和杵)或在加入到介质中后通过对样品进行超声来增加。
溶液的平衡:为了便于固体溶解,混悬液应混合或搅拌24h。混悬液的温度在整个溶解阶段应该很好的进行控制 (±0.5℃)。在溶解阶段后,建议将多余的固体完全沉淀。取上清液时应避免混入任何不溶解的固体,因为这会显著地影响溶解度的结果。如果沉淀不完全,不能提供一个澄清的上清液进行分析,那么可以使用离心法。混悬液的温度在沉降和离心步骤中也必须很好的控制(±0.5℃),应与溶解时的温度相同。
当对多个样品经过不同的平衡时间进行测定而产生相等的结果时,说明达到了饱和(平衡)。为了确认表观溶解度是平衡溶解度,建议同样的混悬液采用同样方式重新平衡(例如,再增加24h)。
溶液的分析:上清液在分析前可能需要稀释,以保证在分析方法的线性范围内,并且避免产生可能的沉淀。可以采用UV法或HPLC法测定溶液浓度。HPLC法的优点是可以测定不稳定药物的有关物质(12、16)。
溶解度结果的报告:在抽取样品进行分析时,应记录上清液的pH值(在溶解度测量的温度下)。应报告在平衡步骤结束时的pH值和温度下的溶解度值(11)。建议在溶解度测量结束时分析混悬液中过剩的固体,以验证固体形态没有改变。PXRD法或DSC法可以用来评价固体。所报告的平衡溶解度的精密度应该反映在随后的时间点上测量之间的一致程度,而不是溶解度测定的精密度。将平衡溶解度报告为最后时间点的溶解度±最后两个溶解度测量值的差值。
表观溶解度测定方法
电位滴定法
溶解度测定中的酸碱电位滴定法是基于由沉淀引起的滴定曲线中间的一个特征位移。滴定时,将准确体积的标准酸或碱加入到一个含有可电离物质和0.15M氯化钾(为了增加测量的准确性)的溶液中。通过氩气Sparging(一种技术,将化学惰性气体如氮气、氩气或氦气通入到液体中)可以防止大气中的二氧化碳对pH值产生影响。使用一个玻璃电极对pH值进行连续监测。通过酸/碱消耗的体积和pH值得到滴定曲线(12)。
比浊法
比浊法是将化合物溶解在有机溶剂中,通常是二甲基亚砜(DMSO)。每隔1分钟时间,将上述溶液加入到pH7的缓冲液中。通过光散射法对浊度进行第一次检测后,再加入上述溶液。随后,可将加入的体积与浊度作图,然后向后外推至沉淀开始的点作为估计的溶解度。这种方法可以用来测量多达50~300个样品/日。这种方法的缺点包括:DMSO的使用可提高溶解度(作为助溶剂)至一个未知的程度,实验的持续时间短,这导致了一个动力学而不是热力学溶解度估计,析出固体的晶体形态是不知道的,除非它是从悬浮液中分离和溶液中进行表征的。DMSO会稳定形成过饱和溶液,动态测量方法容易预测药物的表观溶解度(12)。
溶解度测定的小型化、高通量和自动化
溶解度不仅在处方前研究中起重要作用,而且在药物开发过程中先导化合物的选择和优化中也起着重要作用。因此,希望有能够以尽可能少的化合物来确定表观溶解度的方法,以及具有必要的高通量特性,使得该方法可用于支持化合物的优化(16)。为此,Glomme等人(12)开发了一种小型化的摇瓶法。该方法基本相当于传统的摇瓶法,但Glomme的小型化法允许使用非常少的溶剂(例如0.5-2ml,这取决于所使用的设备)。
在生物相关介质中的溶解度的测定
除非另有说明,在生物相关溶解度测量中,溶解介质的温度应控制在37±0.5℃。生物相关溶解度测量应遵循摇瓶法,包括在24h的溶解度测量和至少一个额外的时间点,以确认达到平衡的精度。加入到溶解度介质中的药物的盐形式会影响达到平衡的方法。因此,盐和相同药物游离碱的溶解度不应该被认为是一致的,除非开始就通过不同的结晶固体进行独立的测定来证明。
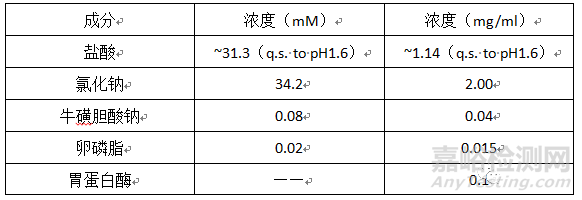
人空腹模拟胃液(FASSGF)(17)
pH:1.6(37℃)
介质组成:
人进食模拟胃液 (FESSGF) (17)
pH:5(37℃)
介质组成:
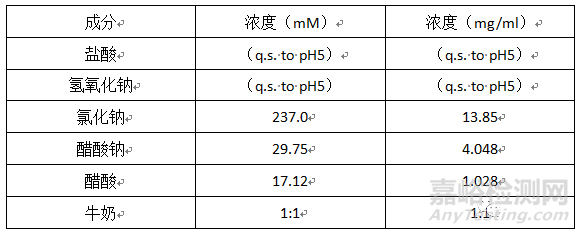
制备缓冲液,与牛奶混合1:1。如果必要的话,调整pH值为5。
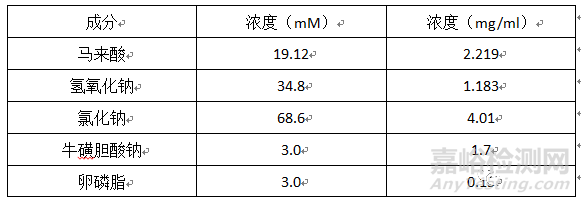
人空腹模拟肠液 (FASSIF-V2) (17)
pH:6.5(37℃)
介质组成:
人进食模拟肠液 (FESSIF-V2) (17)
pH:5.8(37℃)
介质组成:
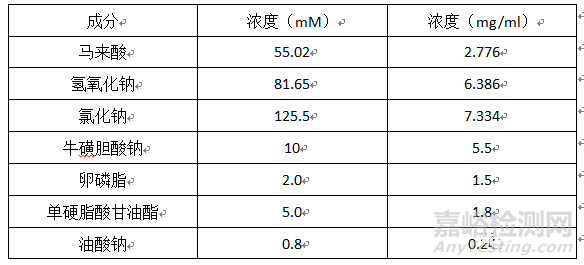
人模拟结肠液(SCOF2) (18)
pH:5.8(37℃)
介质组成:

其他动物物种(如狗和牛)的生物相关介质略,详见USP<1236>原文。
术语表
备注:在本章的上下文中,提供了下列定义,以阐明这些术语的使用。这些定义并不打算取代或否定USP和NF中其他地方的定义。
附着力:是不同分子(溶质-溶剂)之间的热力学相互作用。
内聚力:是同一分子(溶质-溶质,溶剂-溶剂)的热力学相互作用。
表观溶解度:是溶质在溶剂体系中的经验确定溶解度。由于短暂的过饱和或不完全溶解或达到平衡的时间不足,表观溶解度可能高于或低于平衡溶解度。
固有溶解度:是不带电的溶解度(中性)。固有溶解度只能在pH值范围内精确测量,在这个范围内,物种的分布由不带电荷的分子支配。对于某些化合物,可能无法直接测量固有溶解度,必须通过溶解度数据的拟合来确定。
溶解:是在热力学平衡(例如,溶质和溶剂形成均匀混合溶液)中接近溶解度极限的非平衡过程。溶解速率会影响达到平衡所需的时间,但不会影响最终平衡溶解度。
溶解度:是在热力学平衡条件下的浓度极限,溶质可以均匀地混合到溶剂中。这可以称为平衡(饱和)溶解度,以区别于表观溶解度。溶解度可以用质量摩尔浓度、摩尔分数、摩尔比、重量/体积比、重量/重量比等浓度单位表示。

来源:药事纵横


