您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-04-22 09:57
IVDR将于2022年5月26日强制执行,很多体外诊断试剂厂商觉得时间还早,法规狗却深深觉得已经不早了,因为相比较MDR对于医疗器械企业的影响,IVDR对于体外诊断试剂的厂商影响更大。为什么呢?
IVDD时代只有20%左右的体外诊断试剂是需要公告机构发证的,还有80%企业可以自我声明。到了IVDR这两个比例会倒过来,也就是80%左右的体外诊断试剂需要公告机构发证,20%左右企业自我声明。
举个例子,肿瘤标志物CA19-9检测的试剂盒,在IVDD法规下是自我声明,到了IVDR就需要公告机构发证。既然影响这么大,体外诊断试剂的厂商又该如何应对呢?法规狗认为应从以下8个问题入手,分别是分类,标准,科学有效性,分析性能,临床性能,上市后性能跟踪,UDI和公告机构。
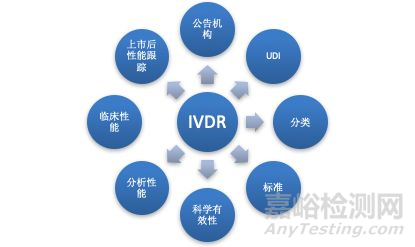
IVDD将体外诊断医疗器械分为三类:List A、List B、自我检测(Self-test)和其它(others)。
其中,List A包含:1)血型分型试剂(用于确定ABO系统和rhesus(C,c,D,E,e)anti-Kell系统);2)艾滋病(含HIV1/2)、人体T细胞白血病病毒(含HTLV I/II)、乙型肝炎、丙型肝炎、丁型肝炎的诊断试剂。
List B包含:1)血型分型试剂((anti-Duffy和anti-Kidd系统);2)抗红细胞不规则抗体检测试剂;3)传染病类(风疹、弓形虫、巨细胞病毒、衣原体)诊断试剂;4)肿瘤标志物类(前列腺特异抗原)诊断试剂;5)21三体综合征检测试剂、苯丙酮尿症诊断试剂;6)HLA组织类别(DR/A/B)检测试剂;7)自我诊断血糖检测试剂。
IVDR参照GHTF的分类思路按照风险等级将IVD产品分为4类:Class A(风险最低)、Class B、Class C和Class D(风险最高),涉及血型分型、血液或组织相容性、传染性疾病、肿瘤筛查、伴随诊断、基因检测、先天性疾病筛查、自我检测、IVD分析仪器等细分领域;并根据产品的预期用途和被测量的分析物制定了7条分类规则,相比于旧版IVDD,大大扩充了产品的分类范围。如果产品符合多条分类规则,则按照“就高不就低”的原则进行分类。
IVDD法规规定List A试剂,List B试剂及自我测试的试剂需要由公告机构发证。IVDR法规规定B,C,D类的体外诊断试剂都需要由公告机构发证。这就回应了引子里说的80/20的事情。
所以体外诊断试剂的厂商应先搞清楚自己的产品在IVDR的分类,如果不是A,就需要和公告机构尽早取得联系了。
在做体外诊断试剂的CE认证时我们首先要意识到欧盟和国内标准的差异,我们都知道欧盟有自己的协调标准,如果你抱着GB和YY可能是不够的。举个例子:
法规狗有看过一些国内的体外诊断试剂的技术审查指导原则,举个例子来说《C-肽测定试剂注册技术审查指导原则》中有提到空白限,在该原则中有提到空白限是这样做的:
空白限的确定常使用同批号试剂对零浓度校准品(或校准品稀释液)进行至少20 次重复检测,计算所得信号值均值和标准差(SD),将(X +2SD)带入剂量—反应曲线,计算出的浓度 值即为空白限。
这个空白限法规狗理解为是检测限。如果C-肽测定试剂盒要去做CE认证,你会发现CE对于检测限的要求更高,检测限可以衍生出三个:
LOB: Limit of blank, 这个就是上述原则中提到的空白限。
LOD: Limit of detection, measured quantity value, obtained by a given measurement procedure, for which the probability of falsely claiming the absence of a measurand in a material is β, given a probability α of falsely claiming its presense.( 通过给定的测量程序获得的测量量值,在该测量值下,错误地宣称不含分析物(实际上有分析物)的概率为β,错误地宣称含分析物(实际上不含分析物)的概率为α) 。
LOQ: Limit of quantitation,Lowest amount of a measurand in a material that can be quantitatively determined with stated accuracy. (材料中测量值的最低值,可以用所宣称的准确度定量确定)。
我相信看到这里大家一定是头大了,就是一个检测限扯出这么多问题。如果你按照cFDA的思路去做只有LOB看上去是符合要求了,但你再细看呢?它就做了20次重复,那为什么20次重复就够了呢?这些问题你在做CE认证的时候要基于科学依据去回答,而不是仅仅告诉审核员我就做了20次重复,要告诉它为什么,并且你的理由是站得住脚的。
所以厂商要基于自己的产品去查询有哪些协调标准是要满足的。在这里法规狗提前通告一下,了解了你的产品要满足的协调标准之后你发现这些协调标准还会指向CLSI的标准,因此你还要把CLSI的标准找出来。
CLSI是美国【临床实验室标准化协会】的英文缩写,英文名为Clinical and Laboratory Standards Institute。CLSI前身是NCCLS【美国临床实验室标准化委员会】,英文名称为National committee for clinical laboratory。
美国CLSI的抗微生物药物敏感性试验操作方法和判断标准,是国内临床细菌检验遵循的标准。由于制订该项标准需要投入大量的人力、财力和物力,所以大多数国家包括中国都还没有能力建立自己的标准而依赖CLSI的方法和标准。CLSI标准经常更新,是否让你想起了CE法规的State of the art的精神。
科学有效性( Scientific validity)是在IVDR中出现的新词汇,到底是什么意思呢? 法规狗查询了一下维基百科,定义是这样的: Scientific validity is the applicability of a conclusion drawn in the context of a scientific experiment to the world at large. 翻译一下: 科学有效性是指科学实验在全世界范围内得出的结论的适用性。
通俗一点说,厂商需要找大量的信息来证明试剂的检测方法是科学合理的。那么要如何来说明这个问题呢? 法规狗认为主要是要说明样本中的分析物和某种疾病或者某种疾病的发展状态等等之间的关系是科学有效的。
举个例子,对于糖化血红蛋白HbA1c检测的试剂盒而言, 你要证明糖化血红蛋白H1bA1c和糖尿病之间的关系,换句话说通过检测H1bA1c的含量来得知病人是否有潜在的得糖尿病的可能性是科学有效的。你可能会说这不是显而易见的嘛,那就请你提供证据。
证据可以从哪里来呢? 在IVDR的法规中也提到了证据主要来自于以下几个方面:
针对于同一分析物或者标志物的科学合理性的相关信息(你就理解为如果你之前准备了这个资料,下一次类似产品要准备可以参考之前的资料)
科学文献
专家意见
研究结果(Results from proof of concept studies)
临床性能研究结果
可以看出后续为了证明科学有效性,至少要查询大量的文献。基于法规狗的经验,查文献绝对是一门技术活。
IVDR附录I的9.1(a)有提到分析性能的要求,主要要考虑以下分析性能指标:
测量的准确度( Accuracy of measurement)
测量的正确度(Trueness of measurement)
测量的精密度(Precision of measurement)
法规狗经常用打靶的例子来解释准确度和精密度,请见下图:
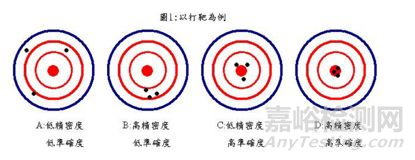
正确度和准确度是不同的,不同在哪里呢? 我们来看定义:
Accuracy(准确度): Closeness of agreement between a test result and the accepted reference value. (EP17-A)
Trueness(正确度): The closeness of agreement between the average value obtained from a large series of test results and an accepted reference value; NOTE: The measure of trueness is usually expressed in terms of bias.
可以看出准确度关注的是单次测量值,而正确度关注的是平均测量值。正确度会影响准确度。
分析敏感性(Analytical sensitivity)就是我们平常讲的检测限,但是CE的检测限的含义和国内有较大不同
分析特异性(Analytical specificity)主要要评估干扰物质和交叉反应物质对于检测结果的影响,干扰物质分为内源性的和外源性的,内源性的包括: 血红蛋白,脂类,胆红素等等。外源性只要指你吃进去喝进去的东西,比如: 药品,酒精,食物等等。交叉反应物质主要是指: 和待测分析物类似的蛋白,或者待测分析物的代谢产物等等。
线性范围及可测量范围
临界值(Cut-off value)
有两点要提起注意: 1,在进行分析性能评估之前先要做方案;2, 定性体外诊断试剂和定量体外诊断试剂分析性能评估的内容会有很大不同。
IVDR附录I的9.1(b)有提到体外诊断试剂主要要考虑以下临床性能,主要包括:
敏感性(Sensitivity): 定性体外诊断试剂检测结果是阳性的数量占金标准检测结果是阳性数量的百分比。
特异性(Specificity): 定性体外诊断试剂检测结果是阴性的数量占金标准检测结果是阴性数量的百分比。
阳性预测值(Positive predictive value, PPV)是指筛检试验检出的全部阳性例数中,真正“有病”的例数(真阳性)所占的比例,反映筛检试验结果阳性者患目标疾病的可能性。
阴性预测值(negative predictive value, NPV)指检验结果为阴性的受试者中真正未患病的比例。诊断试验的预测值受到敏感度、特异度和受试者中患病率的影响。
阳性似然比(Positive likelihood ratio)是筛检结果的真阳性率与假阳性率之比。说明筛检试验正确判断阳性的可能性是错误判断阳性可能性的倍数。比值越大,试验结果阳性时为真阳性的概率越大。
阴性似然比(Negative likelihood ratio)是筛检结果的假阴性率与真阴性率之比。表示错误判断阴性的可能性是正确判断阴性可能性的倍数。其比值越小,试验结果阴性时为真阴性的可能性越大。
上述六个指标基本上是针对于定性的体外诊断试剂的,我们用一个例子来和各位解释一下。
|
金标准 |
总数 |
|||
|
阳性 |
阴性 |
|||
|
待评估试剂 |
阳性 |
真阳性(TP) |
假阳性(FP) |
TP+FP |
|
阴性 |
假阴性(FN) |
真阴性(TN) |
FN+TN |
|
|
总数 |
TP+FN |
FP+TN |
N |
|
预计敏感性(Sens)= 100X [TP/(TP+FN)]
预计特异性(Spec)= 100X[TN/(FP+TN)]
阳性预测值= 100X[TP/(TP+FP)]
阴性预测值= 100X[TN/(FN+TN)]
阳性似然比=Sens/(1-Spec)
阴性似然比=(1-Sens)/Spec
还有一个指标是和定量的体外诊断试剂相关的:正常人群和得病人群的某一指标的预计值
上述这些数据很大程度上是需要通过临床试验获得的,有一些医疗器械厂商有可能在国内做了临床,那么你要考虑国内的临床试验数据是否可以用于CE的申请,因为毕竟可能会有人种和流行病学的差异
如果接触过上市后临床跟踪的厂商就会很容易理解体外诊断试剂的上市后性能跟踪(PMPF, post-market performance follow-up)。思路和上市后临床跟踪是一样的,我不知道产品上市后大规模使用会出现什么问题,因此法规要求体外诊断试剂的厂商持续关注产品上市后的临床表现。那么这个工作主要可以通过哪些方式去做呢?
IVDR的附录XIII的Part B给出了具体的信息:
收集客户的信息
收集文献的信息
同行实验室对比试验(Ring trial)
流行病学研究
检索临床试验数据库
开展上市后临床试验
等等
如果你认为你的试剂不需要做PMPF那么请给出充足的理由。关于PMPF法规狗预计后续欧盟会出台指南文件,因为目前给出的信息没有太多的实际指导意义。
对于UDI(Unique device identifier)我相信大家或多或少都有一些了解。法规狗在很多场合讲过UDI就是医疗器械的“身份证”,这个“身份证”可以方便医疗器械的追溯。MDR中对于UDI有明确的要求。
满足UDI,体外诊断试剂的厂商需要考虑两个方面的要求,一个方面是内部要建立一套UDI的编码系统,另外一个方面医疗器械厂商需要把在欧盟销售的产品的UDI信息在欧盟的数据库中做登记。
第一方面该如何在内部建立一套UDI的编码系统呢?厂商首先要确定选用哪一家的编码系统,在MDR的条款120中已经提到除非欧盟再特别指定一些UDI的发证机构,那么目前比较成熟的三家发证机构GS1, HIBCC和ICCBBA就被认为是欧盟认可的UDI发证机构。
国内的医疗器械厂商对GS1应该不陌生。GS1就是国际物品编码协会,该协会的主要目的是促进客户、合作伙伴和供应商之间以一套供应链标准语言进行沟通,GS1有主导很多供应链标准的制定。我国的物品编码中心代表中国加入了GS1, 负责推广国际通用的、开放的、跨行业的全球统一编码标识系统和供应链管理标准,向社会提供公共服务平台和标准化解决方案。因此如果国内的医疗器械厂商想采用GS1的系统,就可以和中国物品编码中心联系。
另一方面厂商还需要把产品的UDI信息在欧盟的数据库中做登记,这个应该不是很难。在MDR的附录VI的B部分已经非常清楚地列出厂商需要提交哪些信息,看上去等到数据库正式运行之后直接去做递交就可以了。
有一点法规狗要提醒大家,因为UDI涉及到所有的产品,因此法规狗推测提交UDI的信息的截止时间会因产品分类不同而不同,FDA执行UDI的要求计划要花7年左右的时间(2013-2020),估计欧盟要花的时间也不会少。因此医疗器械厂商要密切关注和UDI相关法规的出台。
截止04/19/2019有IVDD发证资质的公告机构总共只有22家,你是不是还觉得挺多,这22家里面除掉英国的公告机构(因为脱欧),再除掉没有在中国设办公室的,你会发现你能选择的只有两家(请见下图)。
因此对于广大中国体外诊断试剂厂商而言,预计会遇到粥多僧少的局面,法规狗觉得现在是那些还未开辟中国市场的公告机构的绝佳机会。对于那些真正要往欧洲销售的厂商来说,及时关注公告机构拿资格的动态信息,并及早做准备尤为重要。



洋洋洒洒讲了这么多,我再把重点提炼一下,赶紧把你的体外诊断试剂的分类搞清楚,如果需要公告机构介入(粗略地说80%的可能性需要), 那么要尽早准备。你们是比医疗器械厂商多两年,但是你们之前落下了太多的功课。人在江湖走,迟早都是要还的。

来源:启升资讯


