您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2018-07-12 17:47
本部分规定了用于灭菌周期检测的生物指示物(包括染菌载体和菌悬液)在生产、标签、检测方法和性能等方面的通用要求,GB18281的其他部分规定了对于不同灭菌过程的生物指示物的具体要求。
1 范围
适用
GB18281的本部分规定了拟用于确认和监测灭菌周期生物指示亢(包括染菌载体、试验菌悬液)及其他组成部分在生产、标识、检测方法和性能方面的通用要求。本部分的基本要求适用于GB18281的其他各部分。对于用于特殊灭菌过程中的生物指示物的要求在GB18281的其他部分独有所规定。本部分适用于没有特殊要求的生物指示物。
不适用
本部分不适用于依靠物理方式去除微生物的检测体系。本部分应包含相应的微生物测试系统的内容。
2 试验微生物
菌株
试验微生物应为被确定的菌株,来源于公认的菌种保藏机构,并能通过正常的检测方法进行确认。
试验微生物应为符合以下条件的菌株:
1)试验微生物需用合适的方法来处理,不需要特殊保藏方法,不需要特殊的操作条件,不需要特殊的运输和邮递要求。
2)在规定的保质期内运输和存储,可以保持其菌株的抗力。
3)除细菌芽孢外,试验微生物也可以是被证明对灭菌过程有合适抗力的微生物。
菌悬液的初始接种物
每批试验微生物悬液的最初接种物应符合以下要求:
1)可追溯到公认的菌种保藏机构的标准菌株;
2)验证其种类和纯度。
制定保存试验微生物菌种的方法应当能保证培养物不受污染,且引起其固有的性质发生变化的不利影响减少到最小。制造商应记录和验证每株试验菌的详细确认检验。
试验微生物数量
用户需要试验微生物生长指数情况时,应将有效试验微生物数表达为占显微镜检测所得的细菌总数的百分比。
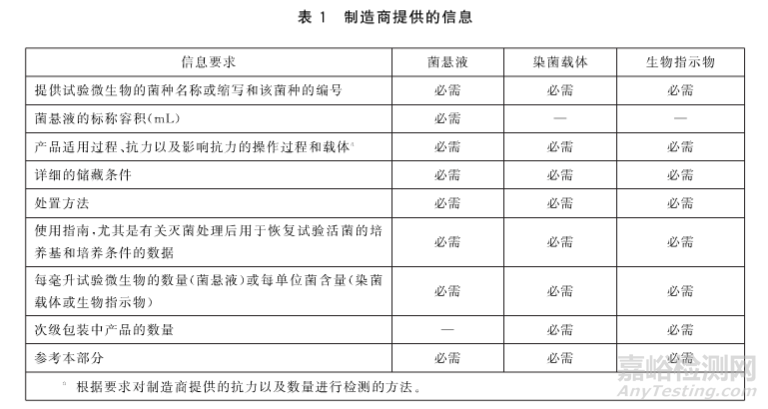
制造商提供的信息(标签)
每批菌悬液、染菌载体和生物指示物的标签上应有以下说明
1)可追溯生产过程的唯一性编号;
2)试验微生物的名称;
3适合菌悬液、染菌载体和生物指示物的灭菌工艺;
4)按照ISO8601规定的方式标明失效期,例如××××年××月××日;
5)制造商的名称,商标,地址或其他标识方法;
6)在适当的地方使用国际公认的符号;
7)每批产品的外包装应该包括表1中给出的信息。
8)标签使用的符合可参照ISO15223的规定。
3 储存和运输
对染菌载体的包装方式应不影响其标明的数量和每个染菌载体的性能。
生产菌体要求
1)菌悬液
2)载体、初级和次级包装
3)染菌载体
4)生物指示物
5)自含式生物指示物
4 抗力测定
抗力的通用要求
每批次/批量生物指示物的抗力应经过试验,以证明符合本部分及GB18281的其他部分的性能要求。灭菌过程中生物指示物的抗力性能在GB18281的其他部分重没有规定时,应该按照已经描述灭菌过程的试验条款确定。某些灭菌过程中使用不符合GB18281要求的生物指示物的最小菌量和抗力,需确定和明示,并被公认,能够提供以下信息的生物指示物是可以被接受的。
1)符合GB18281所有其他要求(包括菌量和抗力的检测方法);
2)产品信息中,包括对菌数和抗力的详细说明;
3)当菌量和/或抗力(若适用)低于GB18281的相关部分的规定值时,产品标签需要有明确警示;
4)生物指示物的抗力可用FBIO值标识。
试验微生物
应规定试验微生物。
试验微生物的数量
在有效期内,制造商或第三方机构利用制造商给出的方法检测出活菌的数量,应介于制造商标定值的50%~300%之间 .
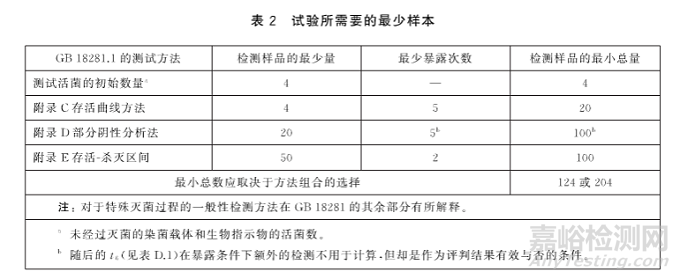
试验所需要的最少样本。

来源:嘉峪检测网


