引言
近年来,全球冠心病患者数量逐年攀升,冠状动脉介入手术(percutaneous coronary intervention,PCI)量屡创新高,高危PCI患者群体数量庞大。同时,全球每年有几十万的心源性休克患者由于得不到及时有效的治疗而失去生命[1-4]。介入式心室辅助装置(percutaneous ventricular assist device,pVAD)是一种用于辅助心室泵血的三类医疗器械,亦称为“介入式人工心脏”,主要用于为急性左心功能不全的患者提供临时血液循环辅助,辅助时间通常为7~14d。其工作原理是通过一个细长的导管插入患者心脏腔室及大动脉血管,通过微型泵系统将血液从心室直接泵入动脉系统。pVAD可以有效减轻患者心脏的负荷,改善全身的血流循环状态。
介入式心室辅助装置临床应用十几年,循证医学已经证实其适用于高危PCI介入手术的辅助治疗和各类心源性休克救治。pVAD能够明显提高患者生存率,降低临床风险,改善预后[5-9]。研究表明,介入式心室辅助装置作为中短期使用的临时心室支持装置,适合以下情况:①对于心力衰竭的患者,当心脏因心室扩大导致心肌功能减弱而无法有效泵血时,它可以帮助改善血液流动,因此在等待心血管介入或外科手术及等待心脏移植的患者中得到推荐;②对于心源性休克的患者,当心脏病发作和其他紧急情况可能导致心脏泵血能力受阻时,它通过泵送血液、降低心脏前负荷、维持外周灌注等操作提高患者从心源性休克中恢复的概率;③对于需要进行PCI手术且合并出现血流动力学波动或心源性休克的患者(高危PCI患者),其可以在手术期间帮助维持外周灌注及降低心脏负荷,从而降低手术风险。
可靠性是医疗器械安全性、有效性之外的又一重要指标。介入式心室辅助装置由于需要长期植入人体并运行,已有许多学者开展了较为深入的可靠性测试与验证[10-15],而介入式心室辅助装置的可靠性研究一直没有相关公开的文献报道。pVAD的临床预期最长使用时间为14d,其最高转速为30000~50000 r/min。因而在pVAD产品使用期限内,电机总旋转次数将达到6亿~10亿次。考虑到工作环境为搏动的压力环境,周期性的正负压差作用在叶轮上,这对pVAD轴承等关键部件的稳定性提出了要求。pVAD真实临床工作环境为心衰或心源性休克,患者心脏已经无法满足外周灌注。若器械出现故障,则将直接导致心源性休克或者心脏骤停,大脑和其他重要脏器可能会很快缺血和缺氧,导致细胞损伤和死亡。这类细胞损伤往往是不可逆的,会导致患者永久性功能障碍。因此,对介入式心室辅助装置的可靠性要进行系统性测试与评价。
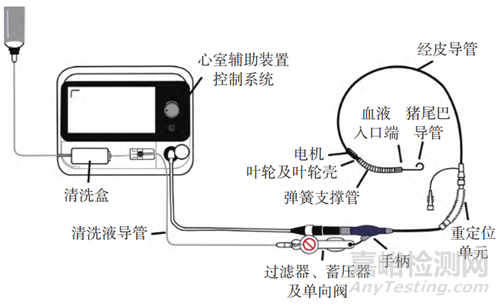
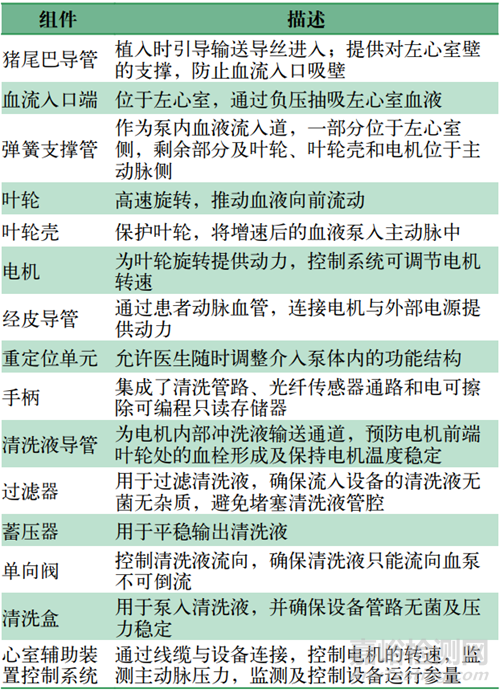
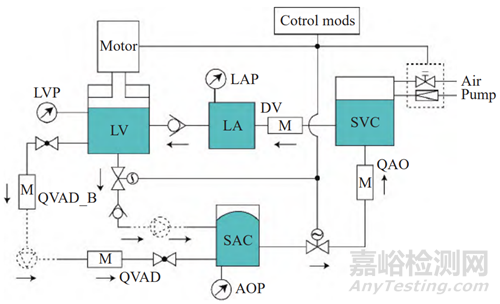
pVAD作为一种三类医疗器械,具有复杂的机电结构,其系统构成如图1所示,各组件的定义及功能描述如表1所示。
图1 介入式心室辅助装置系统构成Fig.1 pVAD system composition
表1 各组件定义及描述Tab.1 Component definition and description
2、可靠性试验设计
2.1 可靠性试验接受推荐准则
国外已有人工心脏企业对其介入式心室辅助装置开展了可靠性测试。Impella 2.5型号pVAD在80%的可靠度和80%的置信水平下,使用寿命可达12d;其Impella 5.0型号pVAD在80%可靠度和80%的置信水平下,使用寿命可达23d。由此可知,双80原则是美国食品与药品管理局对VAD可靠性的要求[16]。
参考Impella的可靠性水平,对于支持时长达14d的介入式心室辅助装置,置信水平为80%,可靠度达到80%。
2.2 可靠性试验样本量
在可靠性试验中,确定适当的样本量是一个关键问题,需要在工程意义和成本之间进行平衡。样本量的大小直接影响到试验结果的可信度和准确性,以及试验所需的时间和资源。
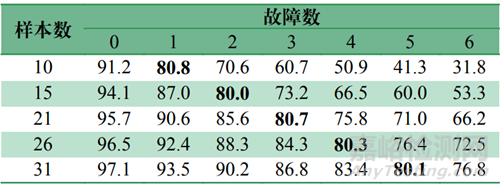
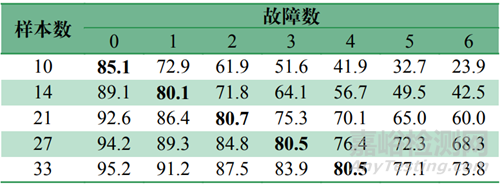
根据GB/T 4087—2009 《数据的统计处理和解释二项分布可靠度单侧置信下限》,对于置信水平为60%的可靠性试验(见表2),在10台样本数的情况下,至多能有1台出现故障,才能保证可靠度在80%以上;对于置信水平为80%的可靠性试验(见表3),在10台样本数的情况下,均正常工作,才能保证可靠度在80%以上。
表2 60%置信水平下的样本量与可靠度关系(%)Tab.2 Correlation between sample size a
表3 80%置信水平下的样本量与可靠度关系(%)Tab.3 Correlation Between sample size andreliability with 60% confidence (%)
允许发生的故障数同样本量成区间线性相关。以80% 可靠度、80%置信水平(见表3)为例,推测出:样本量10、11、12、13均不允许出现故障,才能实现80%可靠度的要求;样本量14、15、16、17、18、19、20均至多允许发生1次故障,才能实现80%可靠度的要求。因此合理选择样本量对于节省可靠性测试成本有重要意义。对于80%置信水平、80%可靠度的可靠性试验,推荐样本量为10、14、21、27、33。
2.3 故障分类
可靠性故障事件通常根据严重程度划分为不同的类别。对于pVAD故障,有清晰的事件分类和标准非常重要,以便及时处理和防止患者风险。可以划分为以下几类:
类别Ⅰ:轻微(minor),这类故障通常对患者的影响较低且可修复,解决措施简单,例如重新插接线缆或更换某个组件。
类别Ⅱ:轻度(mild),这类故障可能会引起患者身体不适或导致轻度症状,但通常不会威胁患者生命,可以通过调整心室辅助装置在心室和主动脉的位置等措施来处理。
类别Ⅲ:中度(moderate),这类故障可能会导致较严重的症状,需要及时干预,但一般不会立即危及患者生命,可能需要重新介入或更换关键组件。
类别Ⅳ:严重(severe),这类故障可能威胁患者生命或产生重大健康风险,需要在短时间内进行临床干预。
类别Ⅴ:危急(critical),这类故障可能是即刻致命的,对患者生命构成即时威胁或可能导致永久性损害,需要紧急救治。
针对介入式心室辅助装置的产品特点,基于此5类故障进行裁剪,形成如表4所示的故障分类。其中,危急和严重故障需纳入可靠度统计,中度、轻度和轻微故障可不纳入可靠度统计。
表4 故障分类
Tab.4 Failure classification
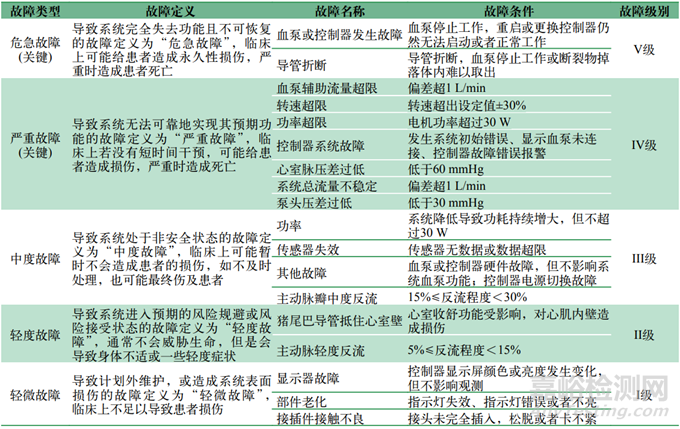
注:1 mmHg=133.32 Pa
2.4 可靠性测试装置
介入式心室辅助装置可靠性测试平台主要由模拟循环回路、集成电控箱、转换器及电脑主机构成。其中核心单元的模拟循环回路由5大部分组成:心室腔、主动脉顺应性腔、左心房腔、静脉储液器和介入旁路体腔(见图2)。其中模拟循环回路由左心室腔(LV)、主动脉顺应性腔(SAC)、左心房腔(LA)、静脉储液器及顺应性腔(SVC)构成;总流量(QAO)、泵体正向流量(QVAD)和泵体反流流量(QVAD_B)由流量计测得;左心室压(LVP)、左心房压(LAP)、主动脉(AOP)由压力传感器测得;黏度(DV)由黏度传感器测得;空气压缩机(pump)为静脉腔和系统整体提供背景压力;上位控制机(control mods)控制各程控单元执行动作。
图2 回路设计
Fig.2 Loop design diagram
心室腔是系统的核心循环动力源,由柔性膜片与刚性腔体形成一个密闭的容腔。直线电机在运动过程中与柔性膜片接触,模拟左心室的主动收缩机制;而在回程运动时与柔性膜片分离,模拟左心室的被动充盈机制。通过调整直线电机的运动行程、运动周期以及进程与回程时间比,可以模拟心室容积、心率以及收缩舒张比等参量。模拟主动脉瓣和二尖瓣作为被动元件,根据心室与主动脉、心室与心房之间的压力差,控制其开关状态,以确保循环系统中液体的单向流动。pVAD可靠性测试样例如图3所示。

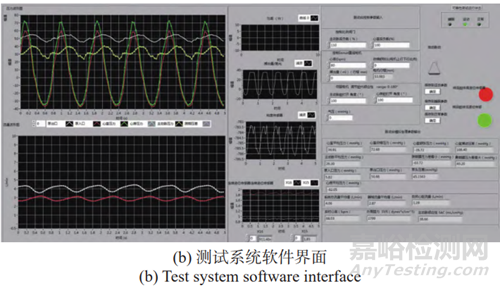
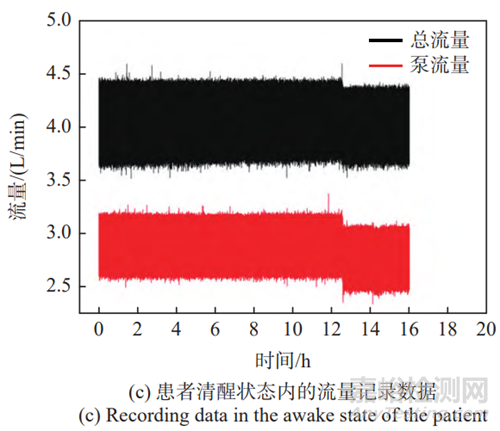
图3 可靠性测试样例
Fig.3 Reliability test example
辅助流量对于介入式心室辅助装置性能的稳定性评价具有重要意义。在流量测试中,使用流量计是最简单有效的方式。因此在可靠性测试中应配单独流量计的介入旁路体腔,以单独测量介入式心室辅助装置流量。通过设计介入旁路体腔中的弹性膜片卡紧导管泵的外壁,实现旁路流量全部流经介入泵,从而测量器械辅助流量。
模拟液温度的稳定性对于器械可靠性的客观科学评价具有重要意义。模拟液的温度变化对于封闭腔体内的气压影响显著,这将影响气压和流量相关可靠性评价参量。可通过热电偶、加热单元以及PID温控逻辑单元,实现模拟血液温度接近人体生理环境,并保持相对稳定,温度偏差不超过±2℃。
黏度也是一个重要参量。一般在黏度2.3~3.4mPa·s的模拟液体环境下开展pVAD的性能评价,以保证器械水力学性能尽可能接近其在临床上的表现。介入泵通常采用灌注系统压入灌注液,以保护血细胞,同时降低轴承磨损。低黏度液体下的机械磨损将更显著,因此pVAD可靠性评价采用更低黏度的模拟液体将更加保守和严苛。
2.5 可靠性测试状态表设定
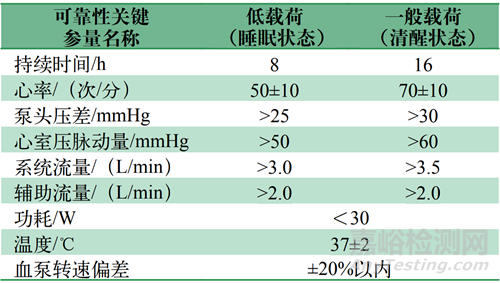
患者在14d内的临床使用过程中,经历着低载荷(睡眠状态)和一般载荷(日常活动状态)的状态轮换。因而,在pVAD可靠性测试中,测试装置要能够实现这些生理状态,并可以轮换。与此同时,pVAD应当相应地调节转速等参量,以适应患者的生理状况。
通过模拟不同载荷情况,可以全面评估介入式心室辅助装置在不同活动水平下的性能表现和可靠性,确保其在临床应用中能够稳定运行并满足患者的需求。可靠性测试状态可以参考表5设置。其中低载荷状态对应睡眠状态,其显著特征为低心率和低流量;一般载荷对应清醒状态,其显著特征为高心率和高流量。
表5 可靠性测试状态
Tab.5 Reliability test status
2.6 可靠性示范测试
基于上文所述评价方案,开展示范性的可靠性试验,其单台测试界面如图3(b)所示。对于清醒模拟状态,可靠性测试台模拟心率为68 次/分,pVAD开启后:
(1)系统平均总流量达到4.06 L/min ,大于3.5 L/min的可靠性要求;
(2)器械平均辅助流量达到2.87 L/min,大于2.0 L/min的可靠性要求;
(3)器械泵头压差稳定在45.2 mmHg,大于30 mmHg的可靠性要求;
(4)心室脉压差稳定在108.4 mmHg,大于60 mmHg的可靠性要求。
连续测试16 h,其流量波形结果如图3(c)所示,可以看出被测样品在连续测试过程中流量趋势稳定。由于测试台的脉动特性,流量均呈现周期性波动,其平均值在可靠性可接受范围内。系统流量(黑色)始终大于3.5 L/min的判定阈值,且偏差不超过±1 L/min;泵辅助流量(红色)始终大于2.0 L/min的判定阈值,且偏差不超过±1 L/min。由此可知,在该测试中不存在表4所列危急和严重故障。
需要指出的是,pVAD体外可靠性测试与临床环境存在一定的差异:①体外可靠性模拟测试平台搭建时只要考虑左心系统循环生理参量,不涉及右心系统;②人体对于外周阻力具有自我调节能力,但模拟管路本身并不具备自我调节能力;③体外可靠性模拟测试平台采用由甘油-水配置而成的模拟血液,这是因为血液的溶血、血容量、抗凝和抗感染性病菌等条件并不适用于体外模拟管路的设定。
上述原因导致可靠性测试试验中的压力、流量以及外周阻力等参量与临床存在一定程度的差异。考虑到可靠性测试试验的核心目的在于评价器械长时间运行的可靠性,在测试环境和参量比临床条件更保守的前提下,允许一定的差异存在。
3、结论
本研究基于可靠性测试方法学和介入式心室辅助装置的特点,深入总结了介入式心室辅助装置可靠性中的关键问题,提出了一个具有工程化可行性的介入式心室辅助装置可靠性测试方案。该方案能够模拟不同载荷和使用状态,有效评估介入式心室辅助装置的可靠性水平,同时能及早发现潜在问题,优化设计和制造过程,确保介入式心室辅助装置设备在临床应用中的安全性和有效性。对pVAD的高可靠性要求同样适用于植入式人工心脏、全人工心脏以及体外膜氧合器等循环辅助生命维持设备。本工作中的可靠性工程化实践方法可以为这些品类的生命维持设备的可靠性工作提供借鉴,加快这些医疗器械的可靠性工作朝着标准化和制度化进步,从而提升患者的用械安全。
参考文献
[1] 超116万 冠心病介入治疗量质齐升[N]. 医师报, 2022-07-07(B01).
[2]LEMOR A, BASIR M B, TRUESDELL A G, et al.Trends in the outcomes of high-risk percutaneousventricular assist device-assisted percutaneous coronaryintervention, 2008-2018[J]. Am J Cardiol, 2021, 156: 65-71.
[3] INOHARA T, KOHSAKA S, SPERTUS J A, et al.Comparative trends in percutaneous coronary interventionin Japan and the United States, 2013-2017[J]. JACC,2020, 76(11): 1328-1340.
[4]JIN C, YANDRAPALLI S, YANG Y, et al. Acomparison of in-hospital outcomes between the use ofImpella and IABP in acute myocardial infarctioncardiogenic shock undergoing percutaneous coronaryintervetion[J]. J Invasive Cardiol, 2022, 34(2): E98-E103.
[5]AL-KHADRA Y, ALRAIES M C, DARMOCH F, et al.Outcomes of nonemergent percutaneous coronaryintervention requiring mechanical circulatory support inpatients without cardiogenic shock[J]. Catheter CardiovascInterv, 2020, 95(3): 503-512.
[6]TEHRANI B N, TRUESDELL A G, SHERWOOD M W,et al. Standardized Team-based care for cardiogenicshock[J]. JACC, 2019, 73(13): 1659-1669.
[7]FLAHERTY M P, KHAN A R, O’NEILL W W, et al.Early initiation of impella in acute myocardial infarctioncomplicated by cardiogenic shock improves survival: aMeta-analysis[J]. JACC Cardiovasc Interv, 2017, 10(17):1805-1806.
[8]SILVER S A, CHERTOW G M. The economicconsequences of acute kidney injury[J]. Nephron, 2017, 137(4): 297-301.
[9] PAPPALARDO F, SCHULTE C, PIERI M, et al.Concomitant implantation of impella on top of venoarterial extracorporeal membrane oxygenation mayimprove survival of patients with cardiogenic shock[J].Eur J Heart Fail, 2017, 19(3): 404-412.
[10] 黄柊喻, 党维国, 陈琛, 等. 完全磁悬浮心室辅助装置的体外模拟循环系统实验研究[J]. 医用生物力学, 2017,32(2): 174-180.
[11]LEE J. Long-term mechanical circulatory support systemreliability recommendation by the National Clinical TrialInitiative Subcommittee[J]. ASAIO J, 2009, 55(6): 534-542
[12]LEE J, MILLER P J, CHEN H, et al. Reliability modelfrom the in vitro durability tests of a left ventricular assistsystem[J]. Asaio J, 1999, 45(6): 595.
[13]REYES C, CHORPENNING K, LAROSE J A, et al. Sixyear in-vitro reliability results of the heartware HVADpump[J]. Asiao J, 2014, 60(5): 541-544.
[14]YAMANE T, KYO S, MATSUDA H, et al. Japaneseguidance for ventricular assist device/total artificialhearts[J]. Artificial Organs, 2010, 34(9): 699-702.[15]李澍, 王浩, 任海萍. 心室辅助装置可靠性试验设计和接受准则的研究[J]. 中国医疗设备, 2018, 33(9): 1-5.
[16]PARK S J, PARK S D, KIM K S, et al. Reliabilityevaluation for the pump assembly using an acceleratedtest[J]. Int J Pressure Vessels Piping, 2006, 83(4): 283-286.
【文章来源】中国医疗器械杂志医疗器械可靠性 2024年 48卷 第1期