摘 要 Abstract
伴随着中药工业化、现代化、国际化进程,中药监管体系构建与能力提升正处在全球化监管合作与监管协调发展的战略机遇期。加快打造具有中国特色、符合中药特点、全球领先的中药卓越监管体系是我国构建“科学、高效、权威”药品监管体系战略的重要组成部分,是中国式现代化药品监管实践的新要求,是统筹高水平安全监管和产业高质量发展的新举措。中药卓越监管体系作为新时代赋予药监人的新任务和新目标,其构建策略可概括为3 个层次、5 个维度和3 个机制:要聚焦中国特色、中药特点、全球领先3 个层次进行立体布局,要综合法规制度、组织机构、科技支撑、产业发展、国际影响5 个维度进行系统设计,要围绕中药全链条监管工作协调会商机制、中药监管科学研究者联盟工作机制及中药监管全球化政策协调机制3 个工作进行方法创新,强化基础学科向监管应用转化,支持中药科学监管决策,推进高质量中药传承创新发展和高水平中药监管国际合作协调。
With the industrialization, modernization, and internationalization of traditional Chinese medicine (TCM), the regulatory system of TCM is currently experiencing a strategic opportunity to enhance global regulatory cooperation and coordination capabilities. Accelerating the development of a global leading TCM excellent regulatory system (TCM-ERS) with Chinese characteristics and in line with TCM's unique features is an important part of China's strategy to build a "scientific, efficient and authoritative" drug regulatory system. It represents a new requirement for drug regulatory practices in Chinesestyle modernization and a novel measure to coordinate high-level safety regulation with high-quality industrial development.The construction strategy of TCM-ERS, as a new task and goal assigned to drug regulatory authorities in the new era,can be summarized into three aspects: (1) a three-dimensional layout around three levels: Chinese characteristics, TCM characteristics, and global leadership. (2) a system from five dimensions: laws and regulations, organizational structure,technological support, industrial development, and international influence. (3) three working mechanisms: a TCM full chain coordination and consultation mechanism (TCM-FCCCM), a TCM regulatory science coalition mechanism (TCM-RSCM) and a TCM global policy coordination and regulation mechanism (TCM-GPCRM). Furthermore, it supports the transformation of basic disciplines into regulatory applications, assist scientific regulatory decision-making, and promote the inheritance and innovation of TCM.
关键词 Key words
中药;中药监管科学;中药卓越监管体系;构建策略;前景展望
traditional Chinese medicine (TCM); TCM regulatory science; TCM excellent regulatory system; building strategies; development prospects
中药监管从传统的经验管理、简单的行政执法,到以科学为决策基础的科学监管,再到信息化时代的智慧监管,科学技术的进步从来没有像今天这样深刻影响着中药监管事务、中药产业发展及中药传承创新。新时代新征程,要以习近平新时代中国特色社会主义思想为指导,全面贯彻落实党的二十大精神,准确把握以中国式现代化全面推进中华民族伟大复兴的新目标,深刻领悟药品监管部门强化药品安全监管、促进中医药传承创新、“三医”协同发展治理的新使命,认真贯彻2024 年全国药品监督管理工作会议对中国式现代化药品监管实践的新要求,加快打造具有中国特色、符合中药特点、全球领先的中药卓越监管体系的新任务,建立中药监管科学研究转化新机制[1],高位推进中医药传承创新发展,不断满足人民群众对中医药服务的需求,为我国构建“科学、高效、权威”药品监管体系发展战略做出贡献。
1、 高质量发展呼唤中药卓越监管体系
1.1 新兴科技驱动中药监管主动变革
中药作为在中医药理论指导下使用的药用物质及其制剂,是中医药传承创新发展的物质基础,具有悠久的临床使用历史。随着21 世纪科技飞速进步,中药新药研发已经采用系统生物学、AI+、纳米药物等创新技术,中药生产创新也涉及连续制造,先进的过程控制和自动化等先进工艺。科学技术发展必然导致许多中药新产品的出现和前所未有的监管问题,加之不同国家和地区药品监管部门的监管要求和监管环境存在较大差异,医药科技创新和药品安全监管也成为全球范围内需要共同面对的监管挑战。药品创新和药品监管是针对同一个产品的不同视角的工作。从药品监管者的角度来看,关注的是这些新技术新产品有效性、安全性证据是否充分,有没有受到严格的质量安全监管。从研发创新者的角度来看,如果加强法规的监管和过多的技术要求,有可能阻碍创新的脚步和新产品的上市。
科技创新与严格监管之间的矛盾和冲突直接推动了一门新兴的监管科学(Regulatory Science)诞生。监管科学从1970 年美国国家环境保护局(EPA)Alan Moghissi 提出概念,到2010 年美国食品药品监督管理局(FDA)提出相对公认的科学定义,前后经历了边界工作(boundary work,1962 年)、超科学(trans-scientific,1972 年)/跨科学(interdisciplinary,1972 年)、循证医学(evidence based medicine,1990 年)、转化医学(translational medicine,1996 年)、精准医学(precision medicine,2011 年)等多学科融合发展,现已成为21 世纪战略性前沿学科[2]。2019 年4 月,国家药监局启动中国药品监管科学行动计划,通过中药监管科学研究基地、国家药监局中药监管重点实验室、中药监管科学重点项目“三位一体”整体推动,中药监管科学研究及成果转化应用步入快车道。2020 年9 月,国家药监局对中药注册分类进行重大调整,新分类包括中药创新药、中药改良型新药、古代经典名方中药复方制剂、同名同方药[3]。新的中药注册分类注重以临床价值为导向,鼓励具有中医药特点的中药复方制剂创新,不再仅以物质基础划分注册类别和评价药物研制水平及药物疗效的高低[4]。国家药监局2023 年1 月发布《关于进一步加强中药科学监管促进中药传承创新发展的若干措施》、2023 年2 月发布《中药注册管理专门规定》,主动采取措施以适应日新月异科技进步的挑战。2023 年5 月,国家药监局中药监管科学研究团队及相关技术团队,首次对中药监管科学(TCM Regulatory Science,TCMRS)的科学内涵和定义进行诠释,即通过中西医跨学科知识、技术融合研究,创新研发符合中药特点的新工具、新标准和新方法,用以评估受监管中药产品的安全性、有效性、质量和风险获益综合性能的新兴科学,进而发展中药监管科学创新体系、转化体系、学科体系及国际协调体系,不断强化我国中药监管体系建设和科学监管能力提升,强化对复杂多样的中药新技术新产品质量和安全进行有效监管,为建立具有中国特色、符合中药特点、全球领先的中药卓越监管体系提供科技支撑[5-6]。中药监管科学作为我国新兴的、亟待发展的中西医交叉融合科学,不仅是监管科学在中药监管领域的全新应用场景,更是一种根植于传统中医药学土壤的中西医融合研究新模式和原创性科学思维方式[7]。
1.2 产业发展挑战中药安全监管
我国是全球最大的中药研发、生产及使用市场。我国中药工业经过近30 年的快速发展,已经建立了较为完备的全产业链质量安全监管体系和中药产业生态。截至2022 年底,中药生产企业4569 家,其中中成药生产企业2319 家,中药饮片生产企业2250 家,专营中药材、中药饮片的药品经营企业486 家。中药营业收入6919 亿元(同比增长12.4%),利润总额1005 亿元(增长37.1%)。其中,中成药营业收入4862 亿元(增长11.8%),利润总额755 亿元(增长23.2%);中药饮片营业收入2057 亿元(增长13.7%),利润总额249 亿元(增长102%)。国家药监局监管的中药批准文号57 991 项,制剂品种8670 个;2020 年版《中国药典》一部收载中药标准 2711 项,局颁中药标准13 091 项。现有中药配方颗粒生产企业73 家,上市备案15 718 件,品种880 个。中药医疗机构制剂批准文号总数16 548 个,按传统工艺备案13 434 个[8-9]。
2023 年8 月,国务院常务会议审议通过《医药工业高质量发展行动计划(2023 - 2025 年)》《医疗装备产业高质量发展行动计划(2023 -2025 年)》,强调“要充分发挥我国中医药独特优势,加大保护力度,维护中医药发展安全”。与国际上传统药、天然药物、草药或现代药的定义不尽相同,我国中药产品既有采用传统工艺、传统给药途径、传统剂型,功能主治以中医术语表述的古代经典名方中药复方制剂,也有新发现的中药材、新的药用部位及珍稀濒危中药替代品及其制剂,还有化学成分明确的小分子药物或组分相对明确的中药提取物及其制剂。药品监管部门监管的中药产品涉及中药材、提取物、中药饮片、配方颗粒、医院制剂、中成药等,在产业、文化、生态、卫生等多个产业领域发挥重要而又独特的作用,不能简单套用国际上的传统药、草药、天然药物或者现代药规则对中药进行监管。2023 年12 月中央经济工作会议强调,“要以科技创新推动产业创新,特别是以颠覆性技术和前沿技术催生新产业、新模式、新动能,发展新质生产力”。中药产业需要开辟未来产业新赛道,中药监管也要主动服务产业需求,统筹高水平安全监管和产业高质量发展,加快传统产业转型升级,推动我国从中药制药大国向中药制药强国跨越。
1.3 中药传承创新呼唤卓越监管
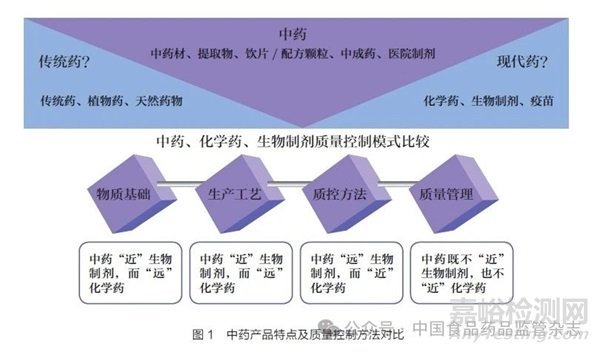
2019 年10 月《中共中央 国务院关于促进中医药传承创新发展的意见》强调,建立健全符合中医药特点的中药安全、疗效评价方法和技术标准。2021 年5 月,习近平总书记在南阳医圣祠考察时强调,要做好守正创新、传承发展工作,积极推进中医药科研和创新,为人民群众提供更加优质的健康服务。2023 年5 月,习近平总书记在考察石家庄市国际生物医药园时强调,“要坚持人民至上、生命至上,研发生产更多适合中国人生命基因传承和身体素质特点的‘中国药’,特别是要加强中医药传承创新发展”。中药兼有中医属性和药品属性,这类特殊而重要商品的监管挑战和困难也不言而喻。中药传承创新呼唤具有中国特色、符合中药特点的卓越监管体系。一方面,在中药监管立法的过程中,由于传统中医属性的个体用药与现代药品属性的群体用药的理论不同,在中医药理论指导下的中药复方组合用药,在面临批准或者不批准、撤市或者不撤市的监管决策关头,如何避免“以西律中”,建立既符合中医药特点,又符合群体用药的有效性、安全性、质量及获益风险评估要求的中药新药审评标准评价体系和制度[10] ;另一方面,在中药产品生产过程中,中药产品既不等同于国外的传统药、草药或天然药物,也很难与现代药画等号,从中药、化学药、生物制剂特点及质量控制模式比较不难发现,中药的物质基础、生产工艺“近”生物制剂而“远”化学药,但中药现行质量控制方法却“远”生物制剂而“近”化学药,质量管理则既不“近”生物制剂,也不“近”化学药(图1)[11]。以上均反映出建立健全符合中医药特点的中药安全、疗效评价方法和技术标准的重要性和紧迫性。
2 、中药卓越监管体系构建的设计策略
2.1 卓越药品监管体系的科学内涵
尽管我国的药事管理最早可以追溯到3000 年前的西周时期,但现代意义的独立的药品监管体系建设始于1998 年成立的国家药品监督管理局(直属国务院),2018 年机构改革设立国家药品监督管理局划归新成立的国家市场监督管理总局管理,至2023 年中国药品监管体制改革历经25 年[6,12]。2023 年7 月5 日国务院新闻办举行“强化药品监管 切实保障人民群众用药安全”发布会,国家药监局坚决贯彻落实习近平总书记关于药品监管的重要指示批示精神,持续深化药品医疗器械审评审批制度改革,持续强化药品全生命周期质量监管,有效维护了药品安全形势的总体稳定,推动我国从制药大国向制药强国跨越,有力保护和促进了公众健康[13]。新时期中国式现代化药品监管实践对中药监管提出新要求:加快打造具有中国特色、符合中药特点、全球领先的中药卓越监管体系[1]。
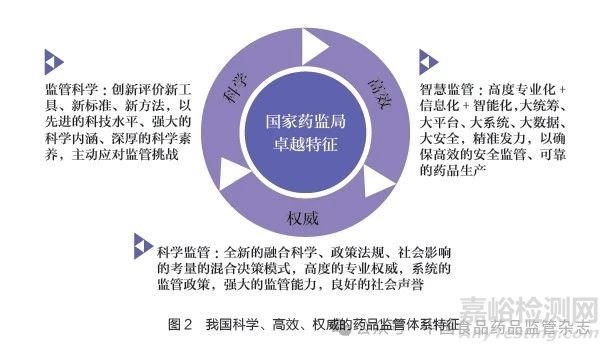
就全球范围药品监管实践来看,FDA 自称为国际上最强大、最先进的监管机构,无论是美国药物监管法律,还是美国制药工业都已经成为全球制药工业的领跑者[14-15]。FDA 药品监管体系的“卓越”特征,对内表现为强大的科学内涵和科学文化,对外呈现高度专业性,以及由此而来的权威性和社会声誉[2]。我国在2006 年8 月全国食品药品监督管理工作座谈会就提出“科学监管”概念[16]。2019 年4 月,国家药监局实施中国药品监管科学行动计划。2021 年4 月,《国务院办公厅关于全面加强药品监管能力建设的实施意见》正式提出“加快建立健全科学、高效、权威的药品监管体系”。2023 年7月,国家药监局印发《全面强化药品监管科学体系建设实施方案》。2023 年11 月,国家药监局提出要全面贯彻党的二十大精神,认真落实习近平总书记关于药品安全“四个最严”重要要求,建立科学高效权威的药品监管体系,不断强化高效能监管,保障高水平安全,促进高质量发展[17]。我国药品监管部门在推动我国从制药大国向制药强国跨越的进程中,监管能力建设重点围绕“创新、质量、效率、体系、能力”五大主题,聚焦“科学、高效、权威”三大核心内容,开启了我国药品监管体制机制创新的新阶段。可见,我国“卓越”药品监管体系具有自身的科学内涵,其核心内容:一是“科学”,基于监管科学新工具、新标准、新方法,以先进的科技水平、强大的科学内涵、深厚的科学素养,主动迎接监管挑战;二是“高效”,基于高度“专业化+信息化+ 智能化”的智慧监管,大统筹、大平台、大系统、大数据、大安全,以确保高效的安全监管、可靠的药品生产;三是“权威”,完善的政策法规体系,高素质的专业人才队伍,创新性混合决策模式,彰显高度的专业权威,具有良好的社会声誉(图2)。
2.2 中药卓越监管体系构建的战略目标
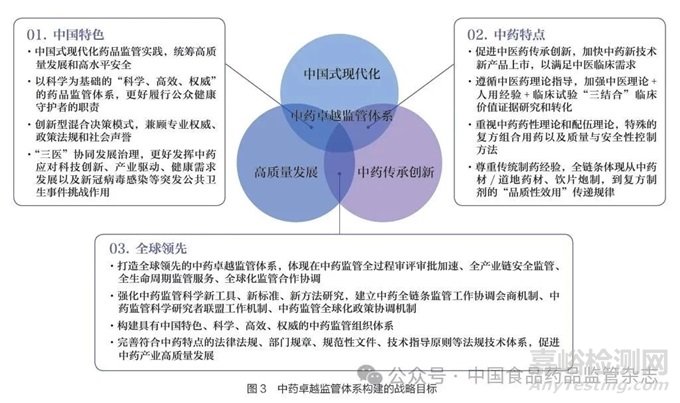
中药卓越监管体系作为我国“科学、高效、权威”药品监管体系的重要组成部分,其顶层设计具有更加丰富的战略考量和科学内涵,要从具有中国特色、符合中药特点、全球领先3 个层次进行设计(图3)。
(1)中国特色:核心是坚持中国式现代化的发展道路。我国独特的文化传统,独特的历史命运,独特的基本国情,注定了我们必然要走适合自己特点的发展道路。中国式现代化药品监管实践,要建立以科学为基础的“科学、高效、权威”的药品监管体系,要统筹高质量发展和高水平安全。要创新科学监管混合决策模式,兼顾专业权威、政策法规和社会声誉,更好履行公众健康守护者的职责。要坚持“三医”协同发展治理,更好发挥中药应对科技创新、产业驱动、健康需求发展以及新冠病毒感染等突发公共卫生事件挑战作用。
(2)中药特点:重点是建立具有中药特点的审评审批体系。要遵循中医药理论指导,促进中医药传承创新。加强中医理论+ 人用经验+ 临床试验“三结合”临床价值证据研究和转化。要重视中药特殊的药性(毒性)理论和配伍理论,特殊的复方组合用药以及质量与安全性控制方法。要尊重传统制药经验和质量控制方法,体现从中药材/ 道地药材、饮片炮制,到复方制剂全链条的“品质性效用”传递规律,加快中药新技术新产品上市,以满足中医临床需求。
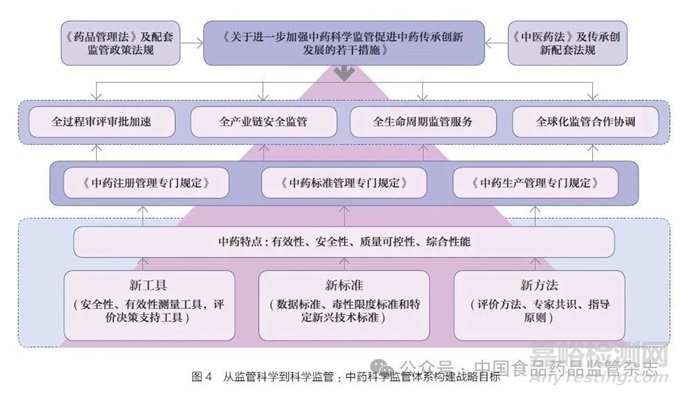
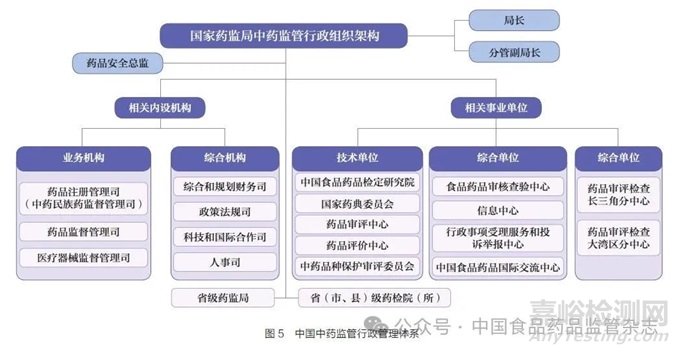
(3)全球领先:关键是高质量发展和高水平对外开放。全球领先的基础是高质量发展,是创新成为第一动力、协调成为内生特点、绿色成为普遍形态、开放成为必由之路、共享成为根本目的的发展,是国家推进高水平对外开放的必然要求。全球领先中药卓越监管体系要以全方位中药监管科学创新为支撑,实现监管全过程审评审批加速、全产业链安全监管、全生命周期监管服务、全球化监管合作协调(图4)。强化中药监管科学新工具、新标准、新方法研究,建立中药全链条监管工作协调会商机制、中药监管科学研究者联盟工作机制、中药监管全球化政策协调机制,完善符合中药特点的法律法规、部门规章、规范性文件、技术指导原则等法规技术体系[18],支持基础学科向监管应用转化,支持中药科学监管决策,构建具有中国特色、高效运转的中药监管行政管理体系(图5)
3、 中药卓越监管体系实践成效与发展前瞻
3.1 中药卓越监管体系的建设内容
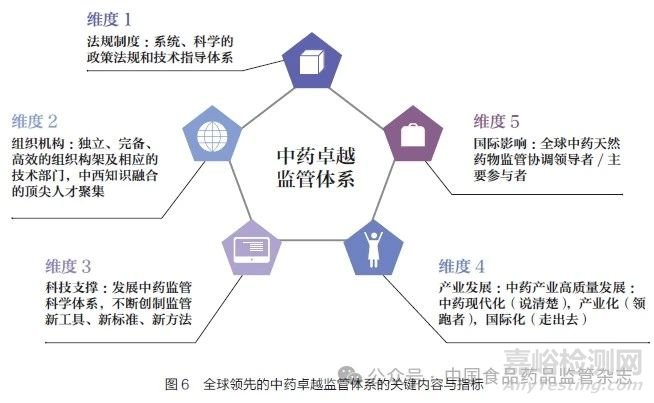
通过全球范围内药品监管体系建设比较研究,结合我国药监工作实践和建立健全科学高效权威的药品监管体系战略目标,我们提出构建“全球领先的中药卓越监管体系”重点内容,在中国特色、中药特点、全球领先3 个层次战略布局基础上,要综合法规制度、组织机构、科技支撑、产业发展、国际影响5 个维度进行系统设计,完善工作内容和核心指标(图6),确保全球领先战略目标达成。
(1)法规制度:系统、科学的政策法规和技术指导体系,涵盖产品研发、审评审批、标准管理、安全生产、流通、使用等全产业链和全生命周期的安全监管。
(2)组织机构:独立、完备、高效的组织构架及中西知识融合的顶尖人才聚集,确保管理运行的科学、高效、权威。
(3)科技支撑:强化中药监管科学体系和转化机制建设,不断创制符合中药特点的监管新工具、新标准、新方法。
(4)产业发展:通过中药监管创新和智慧监管,支持中药产业化、现代化、国际化,实现传统中药产业转型升级和高质量发展,成就我国中药的“强大产业”。
(5)国际影响:建立中药全链条监管工作协调会商机制,中药监管科学研究者联盟工作机制,中药监管全球化政策协调机制,全球中药天然药物监管协调领导者/ 主要参与者。
3.2 中药卓越监管体系的实践与成效
(1)组建中药监管高端智库。首次组建由中医药领域和其他相关学科领域的院士、国医大师以及资深专家组成的中药管理战略决策专家咨询委员会。组建专门的中药材生产质量管理规范(GAP)专家工作组、珍稀濒危中药材替代品监管政策与技术要求研究专家工作组、含马兜铃酸类成份中药安全风险控制专家工作组、已上市中药注射剂上市后研究和评价专家工作组等。初步构建中药监管决策咨询制度,形成定位明晰、特色鲜明、规模适度、布局合理的具有中国特色的中药监管智库体系。
(2)大力发展中药监管科学。实施中国药品监管科学行动计划、《全面强化药品监管科学体系建设实施方案》,组建中药监管科学研究基地2 家,国家药监局中药监管重点实验室27 家,开展中药监管科学重点项目研究并形成一批中药监管新工具、新标准、新方法。成立中国药品监督管理研究会中药监管研究专业委员会、中国药学会监管科学与国际规范专业委员会等。召开首届国家中药科学监管大会(2022 年7 月14 日,北京)、第二届国家中药科学监管大会(2023 年7 月18 日,上海)、第六届中国药品监管科学大会、中药监管科学研究——中药新药审评审批新工具新标准新方法研讨会、中国药学会监管科学与国际规范专业委员会成立大会暨第一届监管科学与国际规范大会、国家中药科学监管大会中药监管科学平行论坛等,积极推动粤港澳三地药品监管部门协作会议机制、西太区草药监管协调论坛(FHH)、中国- 东盟、澜湄国家、金砖国家传统药监管研讨等会议和监管协调。研究完成《中药监管科学战略研究报告》,编辑出版《中国中药监管政策法规与技术指引》《2021 国家中药监管蓝皮书》《2022 国家中药监管蓝皮书》等,为中药科学监管和智慧监管提供技术支撑。
(3)强化中药全产业链质量安全监管。深入推进药品安全巩固提升行动,创新建立《中药全链条监管工作协调会商机制工作方案》。研究制定《中药生产管理专门规定》以及制修订《中药材生产质量管理规范》《中药品种保护条例》《实施审批管理的中药材品种目录》《实施审批管理的中药饮片品种目录》《地区性民间习用药材管理办法》等重要文件,印发《关于进一步加强中药生产质量监管工作的通知》,组建中药材GAP 专家工作组,开展中药材GAP 监督实施示范省(自治区、直辖市)建设,加强中成药上市后监测和评价。2023年抽检中成药43 个品种5584 批次、中药饮片9 个品种2185 批次,合格率分别达到99.5% 和97.1%,中药质量整体情况持续稳定向好。
(4)深化中药审评审批制度改革。研究制定《关于进一步加强中药科学监管促进中药传承创新发展的若干措施》《中药注册管理专门规定》《中药标准管理专门规定》及系列中药研究技术指导原则等,不断完善中药全链条全生命周期监管体系,我国中药监管进入全方位科学监管新阶段。近年来,中药注册审评新药临床试验申请(IND)、新药上市申请(NDA)和补充申请受理数量均大幅增长,2021~2023 年分别有12、10、11 个新药获批上市(以受理号计),并在2023 年首次实现了新的中药(天然药物)注册分类调整后4 个类别的全覆盖。
(5)全方位推进中药监管国际协调。我国高度重视药品监管国际协调,共同应对不断出现的新问题和新挑战。充分发挥西太区草药监管协调论坛(FHH)、第7 届中国- 东盟药品合作发展高峰论坛、澜湄国家、金砖国家传统药监管研讨会议及亚洲合作资金项目、中国- 东盟合作基金作用,成功推选中国澳门成为FHH 正式会员,并推动设立FHH 永久秘书处落户澳门大学。完成22 个中药技术文件翻译工作,为对外交流宣传推广提供基础。2023 年9 月,笔者等出席第13 届全球监管科学峰会(GSRS),以“中国药品监管的科学化进程”为题进行了大会报告,并与FDA 以及有关药品企业、行业协会进行了交流。近年来,我国的监管科学和新兴技术研究取得了重要突破,尤其是中药监管体系建设和监管成效引起了国际上高度重视,显著提升了我国在国际监管科学领域的影响力。
中药监管体系建设、能力和成效得到业界高度评价:① 2023 年2 月25 日,中华中医药学会发布2022 年度中医药十大学术进展——学术研究助力“三结合”中药注册审评证据体系构建[19]。② 2023 年12 月7 日,中华中医药学会发布《新时代中医药标志性科技成果(2012-2022)》——中药新药审评理念革新推动一批代表性新药获批[20]。③ 2023 年12 月25 日,《中国医药报》评出2023 年度中国医药十大新闻——中药科学监管开创新局面[21]。④ 2024 年1 月22 日,《中国中医药报》评选2023 年中医药十大新闻——国家药监局发布《中药注册管理专门规定》,加快推进完善中医药理论、人用经验和临床试验相结合(“三结合”)的中药审评证据体系,加速中药新药研发和产业发展[22] 等。
3.3 中药卓越监管体系发展前瞻
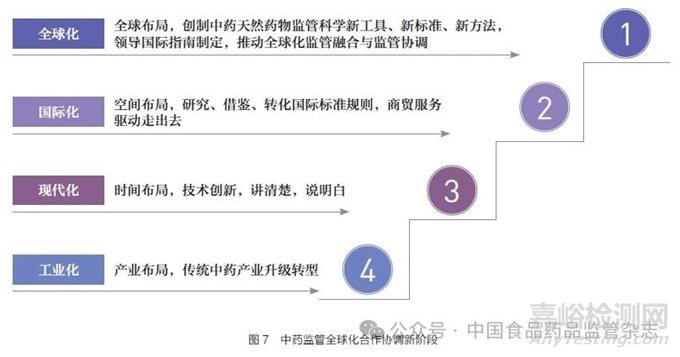
伴随着中药工业化、现代化、国际化进程,中药监管体系建设与能力提升正处在全球化中药监管融合与监管协调发展的战略机遇期(图7)[23]。国家药监局2024 年工作要点明确提出,持续推进《关于进一步加强中药科学监管促进中药传承创新发展的若干措施》落实,加快打造具有中国特色、符合中药特点、全球领先的中药卓越监管体系,建立中药监管科学研究转化机制。这是新时代赋予药监人的新任务,是中国式现代化药品监管实践的新要求,是统筹高质量发展和高水平安全,是促进中药传承创新发展的根本保证。
中药卓越监管体系作为我国“科学、高效、权威”药品监管体系的重要组成部分,是实现中药高水平安全监管和高质量产业发展的综合、高效、先进的管理系统,是以中医药传承创新为目标、以中药监管科学为基础、以高水平科学监管为特征的新型监管组织体系。其构建策略包括3 个方面内容:①要聚焦中国特色、中药特点、全球领先3 个层次进行立体布局。②要综合法规制度、组织机构、科技支撑、产业发展、国际影响5 个维度进行系统设计。③要围绕全链条中药监管工作协调会商、全方位中药监管科学研究者联盟及全球化中药监管政策协调3 个机制进行方法创新。中药卓越监管体系建设的基础是科学技术进步,要充分发挥药品监管科学全国重点实验室的高水平平台作用,创新中药监管科学中西医融合研究新模式,建立中药监管科学转化新机制[24]。要按照国家药监局《全面强化药品监管科学体系建设实施方案》要求,探索建立符合中药特点的先进临床试验方法、中医动物模型、生物标志物等中药监管新工具、新标准、新方法,开展基于真实世界证据的具有人用经验中药的风险获益评价新方法、人工智能与中药科学监管、中医治未病的监管科学与审评决策研究。进一步完善中医药理论、人用经验和临床试验相结合的中药注册审评证据体系,建立人用经验收集与整理的方法和工具,研究符合中医药特点的临床疗效评价新方法。要持续推进中药质量控制技术研究,完善符合中药特点的药学评价技术体系,突破中药复杂体系质量的高级表征和系统控制技术瓶颈。2024 年1 月启动新的一批药品监管科学体系建设重点项目,中药及监管科学共性问题主要聚焦中药监管科学中西医融合研究新模式,重点发展中药监管学科理论与方法,组织开展中药监管科学体系及学科体系、新工具新方法转化认定程序,中药真实世界数据、有效性、安全性、质量及风险获益评价方法等研究,为建立符合中医药特点的中药审评审批体系提供技术支撑。
总之,2024 年全国药品监督管理工作会议提出“加快打造具有中国特色、符合中药特点、全球领先的中药卓越监管体系”是我国构建“科学、高效、权威”药品监管体系战略的重要组成部分,是中国式现代化药品监管实践的新要求,是统筹高水平安全监管和产业高质量发展的新举措。这是没有先例可循、没有经验可借鉴的伟大奋斗目标,需要我们立足时代方位,大胆探索,创造先例。我们要更加准确把握党中央对药品监管的新要求,准确把握药品安全面临的新挑战,准确把握医药创新呈现的新态势,系统研判中药行业性特征、阶段性特点和当前监管难点、痛点、卡点,强化中药卓越监管体系战略性、前瞻性、系统性设计,统筹中药高水平安全监管和中药产业高质量发展,为推进中药传承创新发展贡献药监力量。
参考文献
[1] 国家药品监督管理局.2024 年全国药品监督管理工作会议召开[EB/OL].(2024-01-10).https://www.nmpa.gov.cn/yaowen/ypjgyw/hyxx/
zhhyxx/20240110172910106.html.
[2] 杨悦. 美国药品监管科学研究[M]. 北京:中国医药科技出版社,2020.
[3] 国家药品监督管理局.《中药注册分类及申报资料要求》政策解读[EB/OL].(2020-09-30)[2021-02-03].https://www.nmpa.gov.cn/xxgk/zhcjd/
zhcjdyp/20200930164259184.html.
[4] 王停, 林红梅, 于江泳, 等. 基于新法规下的中药创新药研发策略[J]. 中国中药杂志,2021,46(12):3150-3155.
[5] 赵军宁. 中药监管科学:助力更高水平的中药科学监管[J]. 中国药学杂志,2023,58(9):749-761.
[6] 赵军宁, 王军志, 李波,等. 中国药品监管的科学化进程与监管科学发展[J/OL]. 中国科学: 生命科学,1-18[2024-02-21].http://kns.cnki.net/
kcms/detail/11.5840.Q.20240118.1430.002.html.
[7] 赵军宁, 黄璐琦. 中药监管科学: 发展中的新兴融合科学[J/OL]. 中国科学基金,1-10[2024-02-21].https://doi.org/10.16262/
j.cnki.1000-8217.20240209.003.
[8] 国家药品监督管理局.2022 中国药品监督管理统计年鉴[M]. 北京:《中国食品药品监管》杂志社,2022.
[9] 国家中药监管蓝皮书编委会.2022 国家中药监管蓝皮书[M]. 北京:中国医药科技出版社,2023.
[10] 戴瑛, 张翼冠, 曾瑾,等. 伊尹汤液之谜——中药复方非典型药理效应规律发现与评价策略[J]. 中国中药杂志,2022,47(16):4261-4268.
[11] 肖小河, 张定堃, 王伽伯, 等. 中药品质综合量化评控体系——标准评控力金字塔[J]. 中国中药杂志,2015,40(1):7-12.
[12] 胡颖廉. 中国药品监管体制改革25 年回顾[J]. 中国食品药品监管,2023(3):4-15.
[13] 国务院新闻办网站. 国务院新闻办就“强化药品监管 切实保障人民群众用药安全”举行发布会[EB/OL].(2023-07-05).https://www.gov.cn/
govweb/lianbo/fabu/202307/content_6890069.htm.
[14] 孟八一. 严厉的监管成就强大的产业——FDA 药物监管110 年剪影( 连载一)[J]. 中国食品药品监管,2018(6):47-55.
[15] 孟八一. 严厉的监管成就强大的产业——FDA 药物监管110 年剪影( 连载二)[J]. 中国食品药品监管,2018(7):50-59.
[16] 谢志洁. 论科学发展观指导下的科学监管理念[J]. 中国医药技术经济与管理,2007(5):84-89.
[17] 李利. 建立健全科学高效权威的药品监管体系[N]. 学习时报,2023-11-10(1).
[18] 国家药品监督管理局. 中国中药监管政策法规与技术指引[M]. 北京:中国医药科技出版社,2023.
[19] 中华中医药学会.2022 年度中医药十大学术进展发布[EB/OL].(2023-03-01). https://www.cacm.org.cn/2023/03/01/22021/.
[20] 中华中医药学会.《新时代中医药标志性科技成果(2012-2022)》发布[EB/OL].(2023-12-07).https://www.cacm.org.cn/2023/12/07/26494/.
[21] 中国医药报.“2023 年度中国医药十大新闻”揭晓[EB/OL].(2023-12-25).http://mtest.health-china.com/c/2023-12-25/1034890.shtml.
[22] 2023 年中医药十大新闻[N]. 中国中医药报, 2024-01-22(1).
[23] 张伯礼, 陈传宏. 中药现代化二十年(1996-2015)[M]. 上海:上海科学技术出版社,2016.
[24] 赵军宁. 培育和强化药品监管领域国家战略科技力量[J]. 中国食品药品监管,2023(4):4-13.