您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-09-29 14:22
前言
遗传毒性(genotoxcity)是指遗传物质中任何有害变化引起的毒性,而不考虑诱发该变化的机制,又称为基因毒性。遗传(基因)毒性杂质是指能引起遗传毒性的杂质,包括致突变性杂质和其他类型的无致突变性杂质。
遗传(基因)毒性杂质主要来源于原料药或制剂的生产过程,如起始原料、反应物、催化剂、试剂、溶剂、中间体、副产物、降解产物等。致突变性杂质(mutagenic impurities)指在较低水平时也有可能直接引起DNA损伤,导致DNA突变,从而可能引发癌症的遗传毒性杂质。
基因毒性杂质的研究和控制对质量研究工作者来说一直是具有挑战性的,近些年来CDE关于基毒杂质研究的发补案例也不在少数。
本文宗旨
相信很多小伙伴也看过不少相关的法规和文章了,但是面对基因毒性杂质时,是不是往往会出现下面的问题和困惑:
● 毒性数据库的网址保存了不少,但是仍不知如何运用,检索没有条理;
● 部分化合物找不到相关的毒理学数据时,无法确定是否具有基因毒性,研发早期(工艺摸索阶段),没有做(Q)SAR预测时,不知是否需要将该杂质当作基因毒性杂质控制;
● 基因毒性杂质限度计算的公式不止一个,不同计算方式之间到底有什么区别,哪种计算方式更合理;
● 基因毒性杂质如何科学地制定控制策略,是否定入质量标准?怎样既能满足申报,又能减少检测成本;
为了帮助大家解决以上的问题,笔者为大家梳理了基因毒性杂质评估的流程,杂质限度计算的方式,以及控制策略。
1、 基因毒性杂质评估-定性
基因毒性杂质的定性评估包括以下4个步骤:
● Step1-“根据警示结构,确定潜在致突变杂质”:即根据工艺情况,结合警示结构筛选出潜在的致突变杂质。常见的警示结构包括:环氧类、亚硝胺类、磺酸酯、卤代烃、肼、芳香胺、硝基化合物、氨基化合物等。
● Step2-“数据库+文献检索”:通过数据库检索或者查找文献,获取化合物的致癌性、致突变性数据,若有充分的数据支持,则可直接借助文献得出定性结论。
常用的基因毒性杂质的定性检索数据库包括如下:
|
网站名 |
网址链接 |
定性类别 |
|
日本厚生 |
https://anzeninfo.mhlw.go.jp/user/anzen/kag/sokatutbl.htm |
致突变评估 |
|
NTP |
https://manticore.niehs.nih.gov/cebssearch |
致突变评估 |
|
OECD |
https://hpvchemicals.oecd.org/UI/Search.aspx |
致突变+致癌评估 |
|
EPA |
https://comptox.epa.gov/dashboard/ |
致突变+致癌评估 |
|
CPBD |
https://files.toxplanet.com/cpdb/cpdb.html |
致癌评估(含TD50) |
笔者在前文也提到过,部分化合物查询不到相关的数据(致癌性和致突变性都查不到),必须借助商业化软件预测,但是在研发早期(工艺摸索阶段),工艺路线没有确定,此阶段的基因毒性杂质评估不是必做不可,因此部分企业出于成本考虑,一般不会做(Q)SAR预测,这就势必导致部分化合物无法确定是否纳入基因毒性杂质考虑。但是研发早期(工艺摸索阶段),如若能够进行风险预判,对于工艺路线的筛选也是有利的。
那么有没有一种办法可以帮助质量研究工作者进行基因毒性杂质的风险预判呢?笔者为大家整理了400+个化合物的Ames和染色体畸变数据(文末有领取方式),可以直接对杂质进行致突变评估,而没有查询到的化合物,也可通过该数据库中的结构类似化合物进行风险预判。
以氯乙醛为例,在该数据库中查到染色体畸变为Positive,故氯乙醛定为基毒杂质,并且可在该数据库中直接获取检测的pdf报告的网址。

以三氯乙酸为例,未能查询到该杂质的基毒数据,但查询到相关化合物氯乙酸和二氯乙酸的数据如下,存在Positive的检测结果。因此在没有进行商业化正规软件预测前,应先将三氯乙酸视为关注的潜在基因毒性杂质,即:风险严控。
● Step3-“软件预测”: 依据step2的数据库检索,如若没有充分的数据用于定性,则应当使用商业化软件预测,根据ICH M7的要求,应采用两个相补的(Q)SAR 预测方法。一个方法应基于专家规则,另一个方法应基于统计学。
● Step4-“遗传毒性试验”:根据CDE公布的《药物遗传毒性研究技术指导原则》,推荐两种标准试验组合,如下:
组合一:(1)一项细菌回复突变试验;(2)一项检测染色体损伤的体外细胞遗传学试验(体外中 期相染色体畸变试验或体外微核试验),或一项体外小鼠淋巴瘤 细胞 Tk 基因突变试验;(3)一项体内遗传毒性试验,通常为啮齿类动物造血细胞 染色体损伤试验,用于检测微核或中期相细胞染色体畸变。
组合二:(1)一项细菌回复突变试验;(2)采用两种不同组织进行的体内遗传毒性试验,通常为 一项啮齿类动物造血细胞微核试验和第二项体内试验。
备注:感兴趣的小伙伴可以直接在CDE官网上搜索《药物遗传毒性研究技术指导原则》进一步学习。
2 、基因毒性杂质的分类和限度计算-定量
通过本文01项下的定性数据(数据库和文献检索致癌性和细菌致突变性数据,(Q)SAR评估以及遗传毒性试验等),按照表1(源自ICH M7)将其归为类,不同类别的基因毒性杂质对应不同的限度计算方式。
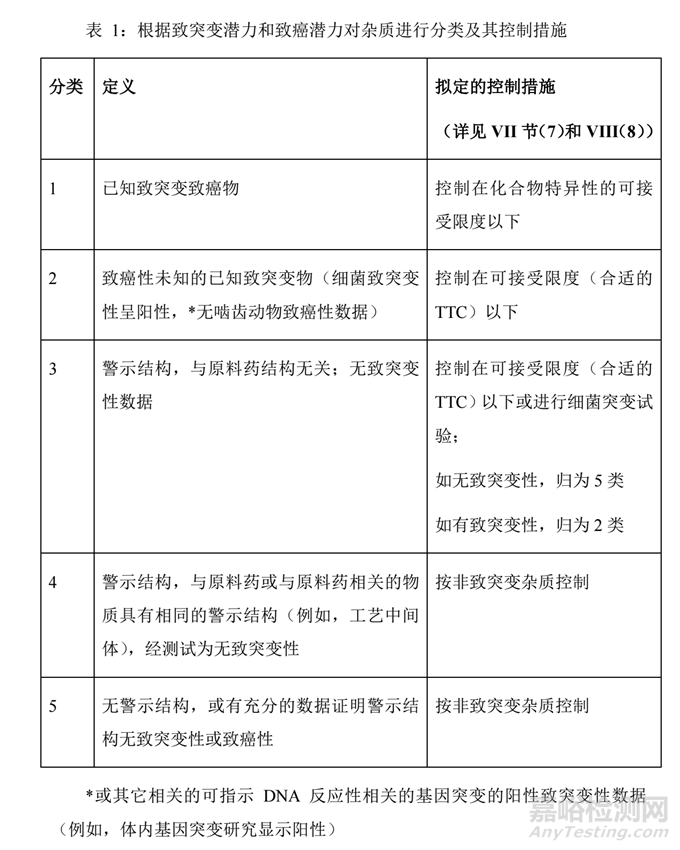
对于1类基因毒性杂质:通常可查询到PDE值或TD50值,亦或者是毒理学阈值,可通过这三种方式计算限度。计算的优先顺序通常为:PDE法>TD50线性外推法>毒理学阈值。
(1)计算方式1(PDE法):
限度=PDE/最大日剂量
(2)计算方式2(TD50线性外推法):即通过啮齿类动物致癌性数据来计算杂质的可接受摄入量。如采用TD50值的1/50000作为摄入量,即相当于终生潜在发生肿瘤的风险为十万分之一。
限度=TD50/50 000×50kg/最大日剂量
(3)计算方式3(基于毒理学阈值):此类杂质可通过未观察到作用剂量(no-observed effect level,NOEL)或者观察到作用的最低水平(lowest-observed effect level,LOEL)和釆用不确定性因子来计算每日允许暴露量(permitted daily exposure,PDE),再根据计算方式1计算杂质限度。
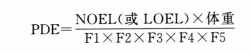
式中 体重以50kg计;
F1为从不同物种外推到人的因子;
F2为个体差异因子;
F3为根据毒性暴露周期釆用的可变因子;
F4为根据毒性严重情况采用的可变因子;
F5采用NOEL时一般为1,采用LOEL时应根据毒性的严重程度确定,最高可为10。
这个时候,小伙伴们是不是又有疑问了,PDE、TD50、NOEL这些数据去哪里查呢?笔者常用的一些数据库网址如下:
|
化学物质毒性数据库 |
https://www.drugfuture.com/toxic/ |
|
Pumbchem |
https://pubchem.ncbi.nlm.nih.gov/ |
|
CPBD |
https://files.toxplanet.com/cpdb/cpdb.html |
|
ASTDR |
https://www.atsdr.cdc.gov/toxprofiledocs/index.html |
|
Toxinfo |
https://www.toxinfo.io/ |
|
IPCS |
https://www.ilo.org/global/lang--en/index.htm |
|
CTD |
https://comptox.epa.gov/dashboard/ |
|
ICH M7附录 |
可在CDE官网指导原则栏搜索 |
对于2类基因毒性杂质:根据毒理学关注阈值(threshold of toxicological concern,TTC)计算可接受摄入量,可根据给药周期调整日摄入量。
限度=TTC/最大日剂量
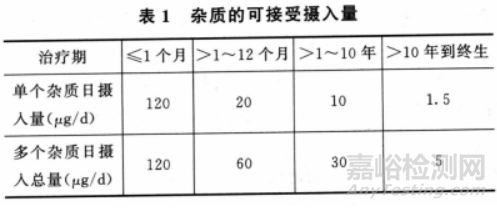
备注:此表源于9306 遗传毒性杂质控制指导原则
对于3类基因毒性杂质:根据软件评估结果或Ames试验,纳入2类或5类控制,限度计算分别参考各分类项下描述。
对于4、5类杂质:按一般杂质控制。
3、 基因毒性杂质的控制策略
基因毒性杂质如何科学地制定控制策略,既能满足申报,又能减少检测成本?ICH M7中描述了4种控制策略,实际工作中都是非常常用的,不同品种看情况可以灵活使用。
策略1---定入质量标准,周期性检测
在连续6次中试批次或者3个连续的生产批次中,致突变杂质均低于可接受限度的30%,则不纳入常规检测中,但需进行周期性检测。
策略2---定入中间体质量标准
在成品中无有效方法控制,可定入中间体,限度与成品保持一致。
策略3---制定一个高于成品的限度(限度放宽),控制点向上游动
使用合适的分析方法,结合杂质的去向和清除实验(Spiking),且多批次中试终产品中杂质均低于限度30%,则可在上游工艺中采用高限度控制策略,且在后续工艺中无需再进行检测。
策略4---不定入任何质量标准
明确工艺参数与残留杂质水平的关系,任何的工艺变动,杂质均未超过限度的30%,则可不定入质量标准。(尤其适用于极不稳定的杂质,如酰氯类)
主要参考文献:
【1】《中国药典》2020版,9306
【2】ICH M7

来源:注册圈


