在刚刚过去的2023年,美国FDA发布多份检查类文件,包括1月发布CPGM 7356.843“批准后检查”,4月发布更新后的CPGM 7356.002“药品生产检查”,6月发布MAPP 5014.1 Rev.1“了解 CDER 基于风险的场地选择模型”,10月发布“药品生产和生物研究监测设施的远程交互式评估”等,从内部工作规范到外部指南,阐述FDA的检查要点和整体考量。
FDA在2023财年药品检查次数,国内819次,国外654次,其中有483缺陷的总计510次。生物制品检查次数,国内1125次,国外50次,其中有483缺陷的总计45次。医疗器械检查次数,国内1042次,国外345次,其中有483缺陷的总计720次。此外,FDA在2023年共发出80封药品cGMP相关的警告信。
本文将按照时间线顺序,对2023年10大FDA热门检查事件进行年度盘点总结。
1. FDA 发布 36 页长 483 详述印度工厂数据可靠性劣迹
FDA于 2023 年 1 月 18 日公布在检查了位于印度古吉拉特邦Intas工厂之后发出的长达36页的483报告,Intas 药业多次违反GMP,存在的问题包括数据可靠性、SOP实践、准确性、产品检测方法以及旨在防止微生物污染的程序问题。其中最值得注意的一条观察项是,FDA 检查员“发现一辆卡车上装满了装有碎文件的透明塑料袋和黑色塑料袋,其中大部分文件被人手随机撕成碎片并与其它废料混合在一起。这辆卡车被发现时距工厂约 150 米,正在等待清除废料的许可。”这份483也直接导致了FDA随后对Intas工厂发布的进口禁令。
值得一提的是,在FDA 2018 年发给Intas的483中,数据可靠性问题也是占据了主导地位,这类问题在印度企业的检查缺陷中早已屡见不鲜,对于我国药企也同样是一直以来的热点问题。
图1. 数据可靠性评估报告(部分展示)
2. FDA猛查印度药企:狼可能要来了
PDA 2023 年会于 2023 年 2 月在印度举行,此次会议特点有三:一是讲者中美国FDA人员占比大;二是讲者中无一人来自印度药监局,当时在印度有近20位FDA检查员对出口美国的药企做全面检查;三是会议还安排了数据可靠性特别讲座,讲者就是当年因在印度查出大量数据可靠性问题而出名的Peter Baker先生。
我国药企应该趁FDA把精力花在印度的时候,抓紧排除数据可靠性问题。一旦FDA移师我国,都能顺利过关,从而借助FDA的检查,向全球展示我国的药品质量可靠,至少是比印度的可靠。果不其然,自2023年4月以来,FDA开始对中国药企做大规模检查,并且不经通知的飞行检查比例明显上升。
3. 印度 Lupin 工厂再收 FDA 483,十项主要违规行为
FDA 于 2023 年 4 月公布了一封发给印度 Lupin 公司的 483,陈述了多项 GMP 违规行为。
主要缺陷包括以下几点:(1)未能充分调查设备故障,从 2019 年 1 月到 2023 年 3 月,Lupin 记录了 1695 份故障通知,但仅调查了 41 份。(2)未能保证受计算机故障影响的计算机系统中数据的可靠性,企业记录了 16 次故障通知,但只对一次故障进行了调查。(3)对于一名目检人员在 2020 年 10 月 20 日的目视检查中发现的一枚外来空胶囊的来源也没有开展调查。(4)未能调查投诉并对投诉进行跟进,包括采取措施来防止再次发生。(5)员工缺乏履行指定职能所需的必要培训,且未能向外包人员提供持续的 GMP 培训。
4. 滴眼液企业表示“不知道眼科药品必须是无菌的”
FDA 于 2023 年 5 月 16 日公布了签发给 Pharmedica USA 公司的警告信。2023 年3 月,Pharmedica 因非处方眼药水污染问题将产品召回,使用这些被污染的非无菌滴眼液可能导致眼部感染,重则失明。
警告信中表示,本应无菌的产品正在不卫生的条件下制备或贮存,并且可能已经“被污染或对健康有害”。检查员还指出,厂房设施“年久失修”,没有用于存放无菌产品的区域。“在检查期间,企业告诉我们不知道眼科药品必须是无菌的,并且承认厂房设施没有适当地设计控制和装备来处理或生产无菌药品。”
Pharmedica 也未能对药品中使用的物料进行适当检测,“在没有确定供应商检测分析的可靠性的情况下”就接收了原辅料,并且没有获得或审核所有原辅料的分析报告单(COA)。Pharmedica 也没有设立质量部门来监督产品生产。
5. FDA修订基于风险的检查场地选择模型指南
FDA 药品质量办公室(OPQ)于 2023 年 6 月 26 日发布了政策和程序手册(MAPP)5014.1“了解 CDER 基于风险的场地选择模型”第一版修订稿,解释了 FDA 检查员必须使用的确定 GMP 监督检查优先顺序的风险因素。
该指南增加了一个与场地设施所在国家或地区的合规历史相关的风险因素,包括与该国家或地区出口的产品相关的违规历史。也就是以后 FDA 在审查检查风险因素时不仅要看企业的合规历史,还要看企业所在国家的合规历史,例如,印度经常出现数据可靠性不合规情况(483 或警告信),那么今后印度企业在这一项中的检查场地选择风险得分就会相应增加。虽然在 MAPP 中 FDA 并没有提具体国家或地区,但可以想像今后印度和中国的企业将受到重点关注。
6. Catalent 工厂 483,导致再生元重磅药 Eylea 被拒主因
FDA 于 2023 年 7 月 14 日公布了签发给 Catalent 印第安纳工厂的 483, 列举了三大观察项。这些检查缺陷导致再生元(Regeneron)重磅药物 Eylea(aflibercept)新版本的上市申请遭拒。
在检查过程中,FDA 表示,Catalent 印第安纳工厂没有遵循书面程序,设备重新验证不充分,设施及其设备没有得到充分清洁或维护。检查员记录了工厂某个区域“缺乏良好的无菌技术”以及“手套”未消毒。检查员发现了一个“有凹痕的过滤器”,并表示一个生产车间处于“年久失修的状态”,胶带从墙壁上剥落、过滤器变色以及推车轮子生锈。通往物料接收平台的门“门框密封不充分”。
Catalent 对 FDA 的处罚并不陌生。该印第安纳工厂去年也收到了一封长达 19 页的 483,导致 Moderna 新冠疫苗分发的推迟 。
7. 众议员22问FDA在印度和中国药品检查方面的进展
美国众议院三名共和党高层议员于 2023 年 7 月 18 日致信 FDA 局长 Robert Califf,质疑 FDA 在解决印度和中国药品和原料药生产工厂问题方面的进展。信中共向 FDA 提出了 22 个问题,包括一般性检查问题、针对印度检查的问题,以及针对中国检查的问题。
信中表示,在中国“面临比印度更危险的情况”,尤其是在 2020 至 2022 财年期间,FDA 仅在中国进行了 40 次检查,相比之下,2019 年为 131 次。信中指出,直到 2023 年 4 月,FDA 才重新启动了对中国的疫情后检查。
信中还重点关注了中国国家安全法可能对检查造成的影响。对于在中国的检查,议员们同样询问了 FDA 是否有在中国启动飞行检查的计划。另外对于在过去十年中收到警告信的中国企业,要求 FDA 提供清单说明在向这些企业发布警告信之后是否执行了现场检查、远程检查还是没有进行检查。
另外,信中还要求 FDA 提供从 2020 年 1 月到现在与中国政府部门就药品生产工厂现场检查进行的所有沟通的复印件。
8. 印度无菌制剂483中一系列令人震惊的操作
FDA于 2023 年 10 月 12 日至 10 月 20 日期间,对位于印度的Kilitch Healthcare工厂进行了现场检查,发布了长达20页的483表格,涉及多条缺陷项,包括许多无菌操作和微生物监测相关的严重问题。并且在483发布的3天后就对该企业发布了进口禁令。
第1条缺陷项,观察到了多达16条无菌灌装的高风险操作,涉及到的严重问题,包括:操作人员皮肤暴露在A级区域;俯身在灌装线上和打开无菌瓶,俯身在装有无菌瓶的袋子上,将戴着手套的手伸入装有无菌瓶的袋子;穿着非无菌洁净服的前臂和肘部触碰到无菌洁净区内部;俯身在灌装线上开放的无菌瓶上,头部和躯干在A级灌装区域内;允许从B级区域到扩展LAF的A级区域的自由空气通过;操作员赤脚在C级区传递物料至B级灌装区;操作员在层流罩内脱下帽子并梳理头发。
第2条缺陷项,生产期间微生物监测结果长期造假。具体来说,对于未采集的样品,报告的实验室记录中仍记录了低于警戒限值的结果,并且结果在之前的数据趋势范围内。不收集所有样品,但仍报告合格结果的做法已经发生了至少一年。在过去的五年中,微生物实验室报告了环境监测和人员监测的结果,没有超出行动限的结果和四个超出警戒限的结果,但在2023年10月16日至18日的检查中,读取从与批次相关的无菌灌装区收集到的样品结果时,有39次偏离。这包括15个A级超出行动限的结果、1个B级超出行动限的结果、13个人员监测超出行动限的结果,以及5个人员监测超出警戒线的结果。
第3条缺陷项,涉及两方面问题,其一是烟雾试验结果显示灌装区内部存在湍流和非单向气流,并且烟雾试验未包括相关的设置活动或干预措施;其二是列举了在无菌工艺模拟研究期间进行的干预类型及其持续时间与在商业化生产过程中观察到的干预措施相比发现的差异。
9. CAR-T“致癌风险”警告,FDA宣布安全性审查
FDA 于 2023 年 11 月 28 日发布公告表示,正在调查 CAR-T 疗法是否会在极少数情况下导致淋巴瘤(一种血癌)。继对 CAR-T 疗法发起调查后,FDA 对 CAR-T产品的监管更加严格,并相继采取了一系列措施。
FDA 于 2023 年 12 月 5 日公布了一封 8 月份发给诺华的无标题信,信中概述了 FDA 检查人员在诺华新泽西 Morris Plains 工厂发现的 Kymriah(tisagenlecleucel)生产过程中与 CGMP 要求的重大偏离。FDA 在信中指出,“从 2018 年 12 月到检查之日,企业发现大约 100 批 Kymriah 受到外源颗粒物质的污染(例如,木材、纤维素、铜和钢)。2020 年 11 月企业得出结论,冷冻袋(Cryobags)是最可能的根本原因。尽管企业对收到的冷冻袋实施了加强的目检,但企业仍继续在 Kymriah 成品批次中发现颗粒物。企业最近一次在 2022 年 10 月 8 日将颗粒物归因于冷冻袋。”
2023年12月12日,科济药业发布公告,其美国子公司CARsgen Therapeutics Corporation收到FDA的通知,因为CMC问题暂停三项临床试验,其中包括其进度最快的CLDN18.2 CAR-T,等待对位于北卡罗来纳州达勒姆的生产基地进行检查后得出的结论。
FDA于 2023 年 12 月下旬对强生和传奇生物的 CAR-T 治疗药 Carvykti 添加了黑框警告。传奇生物在 12 月 21 日提交的一份证券文件中表示,Carvykti 的黑框警告包括针对“继发性血液恶性肿瘤,包括骨髓增生异常综合症(MDS)和急性髓系白血病(AML)”的警告。
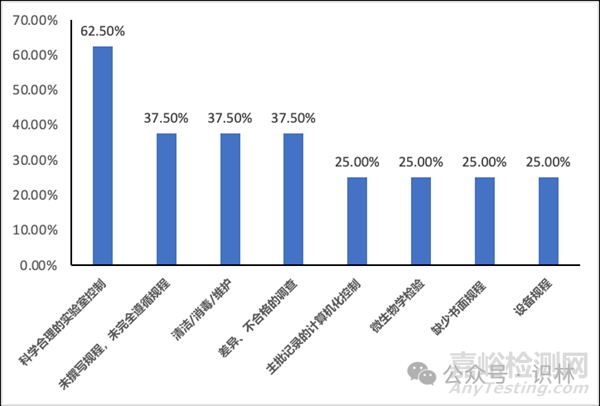
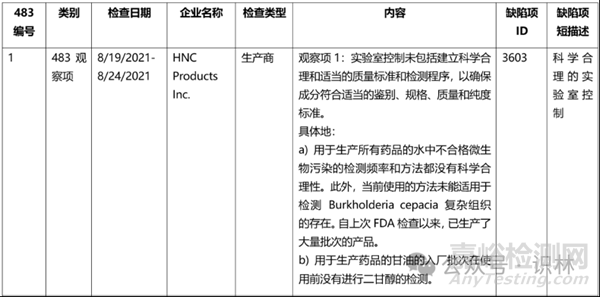
10. 请帮我分析这位FDA检查员
前面已经提到,FDA受到各方面的压力,自 2023 年 4 月以来,开始对中国药企做大规模现场检查。与一些印度药企的摆烂姿态不同,我国药企多数还是积极采取各方面的迎检措施,在众多迎检准备中,业界非常看中的一点,就是对即将到来的这位检查员检查特点的分析。
以下是部分分析图表的简单示例,希望我国药企在这一轮的风口浪尖中都能乘风破浪,顺利通过FDA检查。
图2. Lisa L. Flores所发布的主要缺陷项出现频率(举例)
表1. 近两年Lisa L. Flores所发的483基本情况和缺陷项梳理(部分展示)