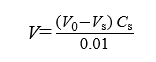刚刚,国家药典委员会发布《关于药包材溶出物测定法标准草案的公示(第二次)》,内容如下:
4204 药包材溶出物测定法
药包材溶出物系指采用特定的浸提介质和浸提条件浸提药包材时,从药包材中释放的物质。溶出物的测定是药包材化学性能检验的重要内容,本法适用于药包材溶出物的化学分析。
溶出物试验总则
本法给出的分析方法大部分为非特异性分析方法,这些方法和指标一般用于产品质量控制,同时也可用于药包材化学危害的初步评估。
由于不同给药途径、不同性质药品的包装材料和容器的生物学风险程度存在差别,应根据所包装药品的风险程度,结合材质和加工工艺等,设定适合的溶出物试验项目及指标。
由于供试液长时间放置可能会影响部分试验项目的检验结果,如易氧化物、紫外吸收、电导率、总有机碳等,因此宜在供试液制备后4小时内试验。
溶出物的供试液制备
供试液制备是一个复杂的过程,受时间、温度、表面积(重量)与体积比、浸提介质以及材料的相平衡的影响。
浸提容器 浸提应在洁净、化学惰性、密闭的容器(如硼硅酸盐玻璃容器)中进行,以确保浸提容器不干扰浸提液。
浸提介质 选择浸提介质时应充分考虑药包材的性质、使用以及所包装药品的成分特性。浸提介质的性质和种类应尽可能包括实际使用的所有状况。常用的浸提介质有:
a) 水;
b) 65%乙醇;
c) 正己烷。
浸提温度和时间 浸提温度和时间的选择一般应参考药包材的工艺条件,结合生产、运输、贮存和使用的最差条件,特别是灭菌工艺条件,同时要与浸提介质相适应。聚合物的浸提温度应在其玻璃化转变温度以下,如果玻璃化转变温度低于使用温度,浸提温度应低于熔融温度。常用的浸提温度和时间有:
a) 58℃±2℃,2h;
b) 58℃±2℃,24h;
c) 70℃±2℃,2h;
d) 70℃±2℃,24h;
e) 100℃±2℃,2h;
f) 110℃±2℃,0.5h;
g) 121℃±2℃,0.5h。
浸提比例 浸提比例的选取一般应考虑药包材的形态及用途,使试样所有被测表面都浸没在浸提介质中。浸提之前可将材料切成小块,下表中给出了推荐的切割尺寸;如相关通则中给出了具体的尺寸,应按照通则执行。对于橡胶密封件、涂层材料、复合材料、多层材料等,考虑完整表面与切割表面存在潜在的溶出性能差异,应尽可能完整浸提。如需切割试样时,应考虑新暴露表面(如内腔或切面)的影响。一般按照表面积进行浸提,不规则形状的试样可按照质量进行浸提,对于某些袋、瓶等容器类药包材的浸提可采用标示装量。常用的浸提比例有:
a) 表面积/体积为6cm2/ml;
b) 表面积/体积为3cm2/ml;
c) 表面积/体积为0.5cm2/ml;
d) 质量/体积为0.2g/ml;
e) 标示装量。
药包材溶出物测定常用的供试液制备方法见下表。
表 药包材溶出物测定常用供试液制备方法
|
序号
|
供试液制备方法
|
适用的产品
|
|
一
|
取试样平整部分,切成约5cm×0.5cm或更小的尺寸,置于玻璃容器中,按表面积/体积为6cm2/ml的比例加水,振摇洗涤,弃去水,重复操作两次。然后加同体积水,密闭,置高压蒸汽灭菌器中,在121℃±2℃下浸提0.5h(若加热至121℃导致材料被破坏,则采用100℃±2℃浸提2h),取出放冷至室温,将试样与液体分离,作为供试液。另取同批水不加试样,同法操作,作为空白液。
|
适用于规则的注射液用塑料容器及组件。
|
|
二
|
取完整试样适量,置于玻璃容器中,按表面积/体积为0.5cm2/ml的比例加水,煮沸5分钟,放冷,再用同体积水冲洗5次。移至玻璃容器中,加同体积水,密闭,置高压蒸汽灭菌器中,在121℃±2℃下浸提0.5h,取出放冷至室温,将试样与液体分离,作为供试液。另取同批水不加试样,同法操作,作为空白液。
|
适用于(卤化)丁基橡胶和聚异戊二烯橡胶密封件。
|
|
三
|
取试样适量,切成适宜的尺寸,置于玻璃容器中,按质量/体积为0.2g/ml的比例加水,振摇洗涤,弃去水,重复操作两次。然后加同体积水,密闭,置高压蒸汽灭菌器中,在121℃±2℃下浸提0.5h,取出放冷至室温,将试样与液体分离,作为供试液。另取同批水不加试样,同法操作,作为空白液。
|
适用于不规则的注射液用塑料容器及组件。
|
|
四
|
取试样平整部分,切成约3cm×0.3cm或更小的尺寸,置于玻璃容器中,按表面积/体积为3cm2/ml的比例加水,振摇洗涤,弃去水,重复操作两次。然后加同体积水,密闭,置高压蒸汽灭菌器中,在110℃±2℃下浸提0.5h,取出放冷至室温,将试样与液体分离,作为供试液。另取同批水不加试样,同法操作,作为空白液。
|
适用于口服制剂用铝箔。
|
|
五
|
取试样平整部分,切成约3cm×0.3cm或更小的尺寸,置于玻璃容器中,按表面积/体积为6cm2/ml的比例加水,振摇洗涤,弃去水,重复操作两次。然后加同体积水,密闭,在70℃±2℃下浸提24h,取出放冷至室温,将试样与液体分离,作为供试液。另取同批水不加试样,同法操作,作为空白液。
|
适用于规则的滴眼剂用塑料瓶及组件。
|
|
六
|
取试样适量,切成适宜的尺寸,置于玻璃容器中,按质量/体积为0.2g/ml的比例加水,振摇洗涤,弃去水,重复操作两次。然后加同体积水,密闭,在70℃±2℃下浸提24h,取出放冷至室温,将试样与液体分离,作为供试液。另取同批水不加试样,同法操作,作为空白液。
|
适用于不规则的滴眼剂用塑料瓶及组件。
|
|
七(1)
|
取试样平整部分,切成约5cm×0.3cm或更小的尺寸,置于玻璃容器中,按表面积/体积为6cm2/ml的比例分别加水,振摇洗涤,弃去水,重复操作两次。在30~40℃下干燥后分别加同体积水、65%乙醇、50%乙醇和正己烷,密闭,分别在70℃±2℃、70℃±2℃、70℃±2℃和58℃±2℃下浸提24h,取出放冷至室温,将试样与液体分离,用同批试验用浸提介质补充至原体积作为供试液。另取同批水、65%乙醇、50%乙醇和正己烷不加试样,同法操作,作为空白液。
|
适用于规则的外用软膏剂用塑料复合管及组件、外用液体药用塑料瓶及组件、口服药用塑料瓶及组件。
|
|
八(1)
|
取试样适量,切成适宜的尺寸,置于玻璃容器中,按质量/体积为0.2g/ml的比例分别加水,振摇洗涤,弃去水,重复操作两次。在30~40℃下干燥后分别加同体积水、65%乙醇、50%乙醇和正己烷,密闭,分别在70℃±2℃、70℃±2℃、70℃±2℃和58℃±2℃下浸提24h,取出放冷至室温,将试样与液体分离,用同批试验用浸提介质补充至原体积作为供试液。另取同批水、65%乙醇、50%乙醇和正己烷不加试样,同法操作,作为空白液。
|
适用于不规则的外用软膏剂用塑料复合管及组件、外用液体药用塑料瓶及组件、口服药用塑料瓶及组件。
|
|
九(2)
|
取试样平整部分,切成约3cm×0.3cm或更小的尺寸,置于玻璃容器中,按表面积/体积为6cm2/ml的比例分别加水、65%乙醇和正己烷,密闭,分别在70℃±2℃、70℃±2℃和58℃±2℃下浸提2h,取出放冷至室温,将试样与液体分离,用同批试验用浸提介质补充至原体积作为供试液。另取同批水、65%乙醇和正己烷不加试样,同法操作,作为空白液。
|
适用于口服药用复合膜及袋。
|
|
十
|
取试样平整部分,切成约3cm×0.3cm或更小的尺寸,置于玻璃容器中,按表面积/体积为3cm2/ml的比例分别加水、65%乙醇和正己烷,密闭,分别在70℃±2℃、70℃±2℃和58℃±2℃下浸提2h,取出放冷至室温,将试样与液体分离,用同批试验用浸提介质补充至原体积作为供试液。另取同批水、65%乙醇和正己烷不加试样,同法操作,作为空白液。
|
适用于口服固体药用硬片。
|
|
十一
|
取完整试样适量,置于玻璃容器中,按0.05g/ml的比例加水,加热回流5h,放冷至室温,将试样与液体分离,作为供试液。另取同批水不加试样,同法操作,作为空白液。
|
适用于硅橡胶密封件。
|
注:(1)50%乙醇仅适用于外用液体药用塑料瓶及组件。另外,如果材料表面印刷对外用软膏剂用塑料复合管及组件的溶出物试验结果有影响,可按内表面积/体积为3cm2/ml的比例分别加入水、65%乙醇、正己烷,尽可能去除管内空气,将管尾热封,按照上述条件进行制备。
(2)对于含纸类的复合膜,可制成内表面积(不含热封边)约150cm2的三边封袋适量(袋则按实际试样尺寸内表面积计),按内表面积/体积为3cm2/ml的比例,分别加入水、65%乙醇、正己烷,尽可能去除袋内空气,将第四边热合封口,按照上述条件进行制备。
溶出物分析方法
澄清度 取水供试液适量,照澄清度检查法(通则0902)检查。
颜色 取水供试液适量,照溶液颜色检查法(通则0901第一法)检查。
pH变化值 取水供试液和空白液各20ml,加入氯化钾溶液(1→1000)1ml,照pH测定法(通则0631)测定,计算二者之差。
酸/碱度 取水供试液20ml,加溴麝香草酚蓝溶液(取溴麝香草酚蓝50mg,加0.02mol/L氢氧化钠溶液4ml和乙醇20ml的混合溶液,使溶解,再加水稀释至100ml,即得)0.1ml,如溶液显黄色,用氢氧化钠滴定液(0.01mol/L)滴定至溶液显蓝色;如溶液显蓝色,用盐酸滴定液(0.01mol/L)滴定至溶液显黄色;如溶液显绿色,无需滴定。同法操作空白液校正。
吸光度 取供试液适量,必要时用孔径为0.45μm的滤膜过滤,照紫外-可见分光光度法(通则0401)在规定的波长范围内测定。
易氧化物 精密量取水供试液20ml,精密加入0.002mol/L高锰酸钾溶液20ml与稀硫酸1ml,煮沸3分钟,迅速冷却至室温,加碘化钾0.1g,在暗处放置5分钟,用硫代硫酸钠滴定液(0.01mol/L)滴定至淡黄色,再加入5滴淀粉指示液后滴定至无色。另取空白液同法操作。易氧化物含量以二者消耗硫代硫酸钠滴定液(0.01mol/L)的体积之差表示, 按下式计算:
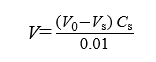
式中 V为二者消耗硫代硫酸钠滴定液(0.01mol/L)的体积之差,ml;
Vs为供试液消耗硫代硫酸钠滴定液的体积,ml;
V0为空白液消耗硫代硫酸钠滴定液的体积,ml;
Cs为硫代硫酸钠滴定液的实际浓度,mol/L;
0.01为标准中规定的硫代硫酸钠滴定液的浓度,mol/L。
不挥发物 量取供试液及空白液各50ml,分别置于已恒重的蒸发皿中,水浴蒸干,在105℃干燥至恒重或经过验证的干燥时间后称重,计算二者之差。
电导率 用水冲洗电导率仪的电极(光亮铂电极或铂黑电极)数次,取空白液冲洗电极至少2次,测定空白液的电导率不得过3.0μS/cm(20℃±1℃);再用水供试液冲洗电极至少2次,测定水供试液的电导率。若测定不是在20℃±1℃条件下进行,则应对温度进行校正。
铵离子 取25ml纳氏比色管一支,加入水供试液10ml,另取一支,加入规定浓度的氯化铵标准溶液10ml,再分别加入碱性碘化汞钾试液2ml,放置15分钟,目测比较颜色深浅。
氯化铵标准贮备液:称取0.297g氯化铵,置1000ml量瓶中,加水适量溶解,并稀释至刻度(每1ml相当于0.1mg的NH4)。
氯化铵标准溶液:临用前精确量取氯化铵标准贮备液稀释至所需浓度。
锌离子 取25ml纳氏比色管一支,加入经孔径为0.45μm的滤膜过滤的水供试液10ml,另取一支,加入标准锌溶液(称取44.0mg硫酸锌七水化合物,用新沸过的冷水溶解并稀释至1000ml,应临用新制)3ml和空白液7ml,再分别加入2mol/L盐酸1ml和亚铁氰化钾溶液(称取亚铁氰化钾三水化合物4.2g,加水溶解并稀释至100ml,摇匀,即得)3滴,混匀,目测比较浊度大小。
总有机碳(TOC) 照制药用水总有机碳测定法(通则0682)分别测定水供试液和空白液的TOC含量,计算两者之差。TOC分析方法检测限应达到0.2mg/L,线性范围应为0.2~20mg/L(经验证,也可适当提高线性范围的上限)。如果供试液的TOC含量超出了该线性范围的上限,则可将其进行适当稀释后再分析。
【附注】在TOC试验中,通常可采用邻苯二甲酸氢钾或蔗糖作为对照品进行标准曲线的配制。
起草单位:山东省医疗器械和药品包装检验研究院 联系电话:0531-82682912参与单位:上海市食品药品包装材料测试所、四川省药品检验研究院、山西省检验检测中心
药包材溶出物测定法起草说明
一、制修订的目的意义
溶出物的测定是药包材化学性能检验的重要内容,一般用于产品质量控制,是评估药包材安全性的重要指标。
二、参考标准
参考国家药包材标准、《化学药品注射剂与塑料包装材料相容性研究技术指导原则(试行)》(国食药监注〔2012〕267号)、GB/T14233.1-2008《医用输液、输血、注射器具检验方法 第1部分:化学分析方法》、美国药典、欧洲药典、日本药典等标准中的相关内容。
三、需重点说明的问题
本标准确定了澄清度、颜色、pH变化值、酸/碱度、吸光度、易氧化物、不挥发物、电导率、铵离子、锌离子及总有机碳(TOC)共10项试验项目,并给出了相应的试验方法。除TOC和酸/碱度外,其余8项是现行《国家药包材标准》中原有的试验项目,本标准对这些试验项目的试验方法进行了规范统一。TOC灵敏度高,可反映溶出物中有机物的总体情况,是评价药包材溶出特性的有效手段,因此参照中国药典及美国药典中的相关内容,增加了TOC试验项目及方法。本标准为方法标准,具体限度参见相关通则。
四、主要意见反馈及处理情况
1. 本方法中所有分析试验宜以两个平行试验组进行,系指平行制备两份供试液各测定一次或两次还是对同一份供试液平行测定2次,建议明确。建议规定各项目平行试验结果的允许偏差。回复:根据专家评审意见,删除“为减少偶然误差,本方法中所有分析试验宜以两个平行试验组进行”。
2. 溶出物试验总则中部分项目要求在制备4小时内完成试验,实际操作中,如溶出物项下检测项目较多,4小时完成全部项目较难实现,建议对此描述进一步细化,限定产品及检测项目。回复:未采纳。供试液长时间放置可能会影响部分试验项目的检验结果,标准中也对该类试验项目进行了说明,如易氧化物、紫外吸收、电导率、总有机碳等。另外,由于本标准适用的药包材产品种类繁多,无法对具体产品进行限定。
3. 建议在“溶出物试验总则”中增加“除另有规定外,滴定液均为符合中国药典要求的滴定液”。回复:未采纳。本标准为《中国药典》拟收载的方法通则,滴定液均需符合药典要求。
4. 建议公示稿表1中序号一至十一中,“将样品与液体分离”的描述全部删去,因为分离不分离对本次研究中验证过的所有样品都不影响检测结果。据YBB标准一直执行以来的经验,不需进行分离,可以达到质控目的,分离将造成实验室用容器增加一倍,清洁工作量加倍。回复:未采纳。试样与液体分离更为科学规范,可避免试样长时间浸泡影响检测结果。
5. 溶出物的供试液制备增加了“对于某些袋、瓶等容器类药包材的浸提可采用标示装量”的制备方法,建议具体描述,在什么情况之下选择标示容量,而不选择依据面积、质量制备供试液。回复:未采纳。本标准配合各中小通则使用,具体品类药包材供试液制备方法的选择见相应的中小通则。
6. 表中 序号二:建议免洗和免洗免灭菌橡胶密封件无需进行煮沸和冲洗。回复:未采纳。5200 药品包装用橡胶密封件通则(公示稿)中已明确“免洗和免洗免灭菌橡胶密封件无需进行煮沸和冲洗”。
7. 表中 序号七:塑料瓶按要求切好后,因样品有弯曲,置于玻璃容器中时不能平整放置,导致会出现样品不能完全浸泡于溶剂中,建议在标准中注明“浸提时需保证样品完全浸没于溶剂中”。回复:未采纳。在标准中浸提比例部分已有相关描述“浸提比例的选取一般应考虑药包材的形态及用途,使试样供试品所有被测表面都浸没在浸提介质中”。
8. 表中 序号九:含纸类复合膜,分别按照序号九和注进行供试液制备,二者“易氧化物”项目结果差别很大,建议含纸类复合膜按注进行供试液制备。回复:未采纳。注中已有相应描述“对于含纸类的复合膜,可制成内表面积(不含热封边)约150cm2的三边封袋适量……”。
9. pH变化值和酸/碱度: 验证结果发现这两个项目考察的是同一个性质,却难以相互对比检测结果,只能得到所有检测样品均为合格。由于酸碱度是一个新的方法,这里是否推荐采用哪种方法作为仲裁方法或首选方法,什么情况下采用第二法。回复:未采纳。酸/碱度是橡胶密封件中要求的检测项目(见5200 药品包装用橡胶密封件通则公示稿)。
10. 吸光度:建议明确检测波长范围。回复:未采纳。检测波长范围见相应的中小通则,如通则5300药品包装用塑料容器及组件公示稿。
11. 建议列入金属离子项。回复:未采纳。金属离子有相应的分析方法通则,见通则4214药包材元素杂质测定法 公示稿。