近年来,与医疗器械结合使用的软件变得越来越重要,开发了许多新的应用程序,以改善医院和社区环境中的患者护理。与任何其他医疗器械一样,安全有效地使用该软件对患者和医疗保健专业人员都至关重要。由于软件在技术上与医疗器械类似,因此MDR规定了确保其安全性、有效性和质量的要求。
软件作为医疗器械到底是什么?
作为医疗器械软件是执行或支持医疗器械功能的软件。该软件可以嵌入到器械中,例如起搏器,也可以与器械结合使用,例如用于iPhone的分析和记录心脏数据的应用程序。即使它是医疗器械的一部分,该软件也必须具有自己的医疗功能才能成为医疗器械。
MDR设定了一些要求:
-该软件可以独立工作或与医疗器械一起工作,但应具有其自身的作用,被视为医疗器械。
-该软件可以在任何地方操作,无论是连接到器械、手机还是云。
-该软件可用于医疗保健人员或非专业人员。
-即使该软件是附件或没有任何独立的医疗用途,它也属于MDR的管辖范围。
-软件和附件的详细信息可在MDR或IVDR第2(2)条中的“MDR附录XVI器械”和“附件”中找到。
该软件可以包括任何类型的计算机程序代码(例如,操作系统)、固件等。它还包括记录在拟用于医疗目的的数字设备的材料介质上的任何信息。然而,不一定是临床或与患者直接相关的软件,例如与支付相关的软件,不被认为是SaMD。体外诊断设备软件设备受法规(EU) 2017/746 (IVDR)的保护。SaMD仅从IVD设备来源的数据中工作,属于这些法规的考虑范围。其他则属于(欧盟)法规2017/745 MDR。
CER用于作为医疗器械的软件
医疗器械软件的临床评估过程与其他医疗器械非常相似。大多数医疗器械软件都不是高风险类,所以要求实际上比高风险器械要宽松一些。然而,公告机构是参与其中的。
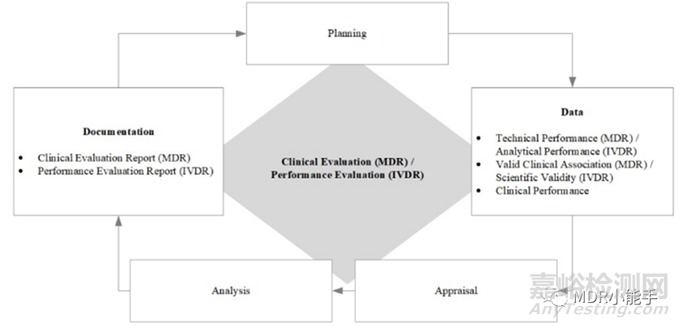
在指南MDCG 2020-1《医疗器械软件临床评价(MDR) /性能评价(IVDR)指南》文件中,提供了以下图表作为医疗器械软件的标准医疗器械临床评价过程。
指南对医疗器械制造商的主要要求是:
-CER和PER的所有要求可在MDR第61条(及附录XIV)和IVDR第56条(及附录XIII)中找到。
-基于软件的特性、风险和预期用途,临床证据必须是充分和适当的。
-软件预期用途的临床情况、条件、适应症或参数必须有足够的证据证明科学有效性或有效的临床关联。简而言之,该软件必须有明确、准确的临床用途。
-软件的技术性能或分析性能必须通过在输入的基础上产生正确的输出来证明。
-它的临床表现必须通过产生正确的、与临床证据相关的、具有积极影响的输出来证明。
-如果该软件的临床效益不明显,则可以通过其可用性。
-与现有技术相比,该软件还必须具有有效的风险收益比。
-上述证据将作为临床证据,需要有足够的数量和质量。
-必须提交几个参数和范围的临床数据,以考虑该软件具有足够的临床性能。医疗器械软件的不同之处在于,由于它们是模块化的,测试也可以以模块化的形式进行。
-属于IVDR的软件,必须进行临床性能研究。
-除此之外,除非满足MDR第61(4)、(5)或(6)条的要求,否则需要进行临床试验。
-临床试验或临床性能研究通常需要确保是安全有效的软件。它可以是基于软件使用的前瞻性或回顾性研究。
-所有文件收集完成后,风险-收益分析完成,临床评价准备提交。